奶山羊胎儿成纤维细胞的分离培养及SRY基因性别鉴定*
陈华涛,胡林勇,杨 艳,李 倩,靳亚平
(西北农林科技大学动物医学院,农业部动物生殖生理和胚胎工程重点开放实验室,陕西杨陵 712100)
奶山羊胎儿成纤维细胞的分离培养及SRY基因性别鉴定*
陈华涛,胡林勇,杨 艳,李 倩,靳亚平*
(西北农林科技大学动物医学院,农业部动物生殖生理和胚胎工程重点开放实验室,陕西杨陵 712100)
为了探索和建立奶山羊胎儿成纤维细胞体外分离培养及性别鉴定的技术方法,获得转基因克隆羊的供体细胞,本试验用组织块培养法分离纯化得到两株奶山羊胎儿成纤维细胞系,进行细胞形态观察、生长曲线及细胞周期和倍性分析。同时根据GenBank上发布的山羊SRY基因设计合成一对PCR引物作为性别鉴定引物,另外根据山羊BLG基因序列设计一对引物作为内参引物,建立PCR反应体系对两株胎儿成纤维细胞系进行性别鉴定。结果表明,分离的胎儿成纤维细胞活力良好,可在体外快速生长、增殖、稳定培养;阳性对照和山羊胎儿成纤维细胞系2经PCR扩增得到337 bp片段和498 bp的BLG基因片段,而阴性对照和山羊胎儿成纤维细胞系1经PCR扩增得到498 bp的β-乳球蛋白基因片段。将337 bp片段和pMD19-T载体连接,构建重组载体pSRY,通过测序证明337 bp片段为SRY基因片段。这说明有337 bp扩增带的细胞系为雄性,无337 bp扩增带的细胞系为雌性。本试验为转基因奶山羊新品种的培育奠定了基础。
奶山羊;成纤维细胞;SRY基因;性别鉴定
*通讯作者
近年来,基于细胞核移植技术及细胞介导的转基因技术的发展,为精确改造家畜的基因型提供了比传统的育种筛选方案更为直接快速的方法。通过体细胞核移植技术已经成功的获得了转基因牛[1-3]、绵羊[4]、猪[5]、山羊[6-7]等动物。胎儿成纤维细胞容易分离,培养和转染,适合作为供体细胞通过体细胞核移植技术来生产转基因动物,其已经成为生产转基因克隆动物所普遍应用的体细胞系。然而,体细胞系有一个主要的缺点,细胞的寿命是有限的。它们的增殖能力取决于动物种类,山羊和绵羊成纤维细胞增殖次数在40~120之间,牛和猪成纤维细胞增殖次数在30~50之间[8-10]。不同个体分离的胎儿成纤维细胞系,其活力也存在差别。
奶山羊具有妊娠周期短、产奶量较绵羊高、抗病力强及饲养成本低的优点,使其成为了理想的转基因宿主动物。为了获得具有体外传代次数多,基因组稳定,活力强的奶山羊胎儿成纤维细胞系,本研究在前人研究的基础上,从配种后30 d奶山羊胎儿中分离培养胎儿成纤维细胞,并用组织块贴壁培养法进行原代培养,在传代过程中观察总结了体外培养成纤维细胞的生长特征,用PCR法鉴定了胎儿性别,为后续山羊体细胞克隆与胚胎移植及高产优质奶山羊新品种的培育奠定前期基础。
1 材料与方法
1.1 材料
1.1.1 试验用材料 配种后30 d的奶山羊胎儿、阳性对照和阴性对照羊血液,取自西北农林科技大学克隆羊基地。
1.1.2 主要试剂 DMEM/F12,Gibco产品;胰蛋白酶,二甲基亚砜(DMSO)以及其他无机盐为Sigma公司产品;胎牛血清(FBS),Hyclone公司产品;蛋白酶K、基因组提取试剂盒、胶回收试剂盒,天根公司产品;pMD19T载体、Taq酶,Takara公司产品;二甲基噻唑二苯基四唑溴盐(MTT);青霉素和链霉素,哈药集团制药总厂产品。
1.1.3 主要仪器设备 SW-CJ-1F超净工作台(苏净集团安泰公司);Conic,XDS-1B(组织培养倒置显微镜);BB5060UV CO2恒温培养箱(Heraeus公司);U410-86超低温冰箱(NBS公司);5430R高速离心机(Eppendorf公司);ZHWY-100B恒温振荡器(上海智城分析仪器制造有限公司),TC-96/G/H梯度PCR仪(杭州博日科技有限公司);细胞培养板和培养瓶(Costar公司)。
1.2 方法
1.2.1 奶山羊胎儿成纤维细胞的分离培养 通过外科手术法,无菌操作取出2只配种后30 d的胎儿,迅速将其放入盛有PBS溶液的保温杯内,溶液内含有双抗。1 h内送至实验室,并迅速转移至超净台内,于培养皿内加750 mL/L的乙醇浸泡1 min,然后用PBS冲洗胎儿3次。将胎儿转入另一加入PBS的培养皿中,去除四肢、头部和内脏。余下的组织在无菌PBS液中洗涤2次~3次后转移至青霉素小瓶内,用眼科剪刀,将剪碎的组织块转移到60 mm培养皿中,并借助弯头吸管使组织块均匀分布于生长面。将培养皿倒置与37℃、体积分数为5%的CO2、饱和湿度的培养箱中,培养 5 h~6 h后,待组织块周围开始变干前加入4 mL含100 mL/L胎牛血清和200单位/mL双抗的DMEM/F12培养液。培养2 d~3 d时,成纤维细胞从组织块周围蔓延生长出来,将原来的培养液换为等量的新培养液,继续培养,此后每隔 3 d观察换液。待细胞长至80%~90%汇合时,将一部分细胞冻存起来,一部分按1∶5的比例传代培养。
1.2.2 奶山羊胎儿成纤维细胞系的性别鉴定
1.2.2.1 引物设计 根据NCBI中检索得到山羊SRY基因全序列,运用Primer Primenr5引物设计软件设计引物:SRYU 5′-GAACGAAGACGAAAGGTGGC-3′,SRYD 5′-GGGACTGTGAGCGGCATAAT-3′,预期产物为337 bp。根据β-乳球蛋白基因序列设计设计合成1对内标引物:BLGU 5′-CACTTGTTCGCCTAAATCCG-3′,BLGD 5′-AGCCTCACTGTCAACTCTGC-3′,预期产物为498 bp。引物由上海捷瑞生物工程有限公司合成。
1.2.2.2 基因组DNA的提取 用天根血液、细胞、基因组提取试剂盒提取奶山羊胎儿成纤维细胞基因组DNA,阴性、阳性对照羊血液基因组DNA,作为PCR反应的模板。
1.2.2.3 PCR反应体系及反应条件 采用50 μ L反应体系,以山羊基因组DNA为模板,其中基因组模 板 为 2 μ L,10 × PCR buffer(Mg2+)5 μ L,10 mmol/L dNTP Mixture 4 μ L,引 物 各 1 μ L(20 μ mol/L),TaqPolymerse 0.5 μ L,ddH2O 34.5 μ L;PCR扩增条件为:94℃3 min;94℃30 s,59℃30 s,72℃20 s,30个循环;72℃8 min。PCR产物用20 g/L琼脂糖凝胶进行电泳分析。
1.2.2.4 pSRY重组质粒的构建、测序及同源性分析 SRY基因PCR产物用天根胶回收试剂盒回收,胶回收产物与pMD19-T载体按5∶1摩尔数的比例混合,10 μ L连接反应体积中含 SolutionⅠ5 μ L,16 ℃连接 3 h,转化 200 μ L 感受态 DH5α后,涂布于含60 μ g/mL氨苄青霉素的SOB固体培养板上(含X-gal/IPTG),37℃培养过夜,挑取白色菌落,提取重组质粒,进行酶切鉴定,目标重组质粒命名为pSRY。将pSRY重组质粒用M13通用引物测序,测序结果与GenBank上的SRY基因序列进行同源性分析。
1.2.3 MT T法生长曲线的测定 取第4代处于对数生长期的细胞,常规消化进行细胞计数,按2×104/mL的密度接种于 96孔培养板,每孔接种150 μ L。从接种时间算起,每隔 24 h选取 3孔吸弃50 μ L培养液后加入20 μ L MTT 溶液(5 mg/mL),37℃继续孵育4 h,4 h后将各孔中的每一孔吸弃100 μ L液体,尽量避免将针状结晶弃掉,各孔加入150 μ L DMSO溶解缓冲液,37℃过夜。于次日将处理好的3孔液体转入另一96孔板,在酶联免疫检测仪上,于492 nm处以加入MT T溶液和DMSO溶解缓冲液的培养液调“0”,测定各孔光吸收值,记录结果。以培养时间(d)为横坐标,平均OD值为纵坐标作生长曲线。
1.2.4 细胞增殖周期测定及细胞倍性分析 消化对数生长期的第4代和第15代的奶山羊胎儿成纤维细胞,将消化下来的细胞分别用2.5 mL的PBS洗涤2次(800 r/min~1 000 r/min离心5 min),弃上清,然后加入1 mL的PBS将细胞混匀,再加入2 mL无水乙醇立即震荡混匀,封口膜封口,置于冰盒送检,用流式细胞仪检测细胞周期和DNA倍体。
2 结果
2.1 奶山羊胎儿成纤维细胞系的分离培养
通过外科手术法,获得了2只30 d的奶山羊胎儿(图1)。按照细胞原代培养的组织块培养法得到了胎儿的原代成纤维细胞,并通过细胞传代分别获得了GFF1、GFF2两株胎儿成纤维细胞系,分别来自这2只胎儿。组织块培养第3天,细胞从组织块游离出,此时的细胞混有一部分上皮样细胞(图2)。培养7 d时,细胞生长良好,活力旺盛,铺满皿底(图3)。
图1 30 d胎儿Fig.1 Goat fetus of 30 day s
图2 培养3 d时成纤维细胞迁移生长出组织块(40×) Fig.2 T he growth and emigration of fetal fibroblasts in vitro at 3 days(40×)
2.2 胎儿成纤维细胞系的性别鉴定

图3 培养7 d时长至成纤维细胞汇合(40×)Fig.3 The confluence of fetal fibroblasts in vitro at 7 days(40×)
分别以公山羊、母山羊血液基因组为阳性、阴性对照,检测了GFF1、GFF2两株细胞系。结果显示,阳性对照组及GFF2扩增出337 bp(SRY基因)和498 bp(BLG内参)大小的两个条带,而阴性对照及GFF1只扩增出498 bp的一个条带,这表明GFF1为雌性细胞系,GFF2为雄性细胞系(图4)。

图4 山羊胎儿成纤维细胞系SRY-PCR扩增结果 Fig.4 Amplified results of goat fetal fibroblasts by SRY-PCR
2.3 奶山羊SRY基因序列测序与同源性分析结果
将PCR产物回收后与pMD19-T载体连接、转化、筛选,成功构建pSRY载体,挑选阳性克隆由南京金斯瑞生物科技有限公司进行测序,测序结果如图5所示。测序结果与NCBI上发表的SRY基因序列99%同源,更进一步说明了性别鉴定结果的正确性。

图5 PCR产物测序结果Fig.5 The sequencing results of PCR products
2.4 奶山羊胎儿成纤维细胞的生长曲线
从生长曲线可见,奶山羊胎儿成纤维细胞接种后第1~2天生长较慢,第3天开始快速生长,进入对数生长期,第5天到达高峰期,随后进入平台期,第7天细胞生长减慢,细胞开始死亡(图6)。
2.5 细胞周期测定及细胞倍性分析结果
奶山羊胎儿成纤维细胞第4代(T0)和第15代(T15)的细胞生长周期流式细胞仪检测结果如图7、图8所示,数据分析见表1。
(1)计算不同代次细胞的DNA指数(DI):第4代细胞为正常二倍体对照细胞,DI=70.88(T15)/69.23(T0)=1.02≈1.0,根据判定标准,DI=1.00±0.1为二倍体,说明第15代胎儿成纤维细胞细胞仍为正常的二倍体细胞。此细胞经长时间的体外培养传代后,染色体倍体仍正常。此胎儿成纤维细胞系可用于后续的核移植和细胞筛选试验。
(2)计算不同代次细胞的增殖指数(PI):PI(T0)=%(G2+S)=90.33%,PI(T15)=%(G2+S)=91.69%,这两个代次细胞增殖指数读很高,且相差不大,说明奶山羊胎儿成纤维细胞活力很强,经历长时间的传代后,其增殖能力基本没有变化。为以后细胞经受长时间的药物筛选提供前提条件。
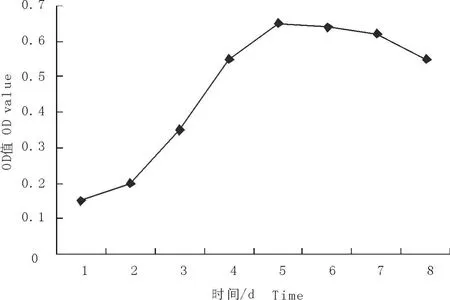
图6 奶山羊胎儿成纤维细胞的生长曲线Fig.6 T he growth curve of fetal fibroblasts of dairy goat

表1 奶山羊胎儿成纤维细胞第4代和第15代细胞生长周期比较Table 1 The comparison of cell growth cycle between passage 4 cells and passsage 15 cells

图7 第4代胎儿成纤维细胞生长周期Fig.7 The cell growth cycle of passage 4 cells

图8 第15代胎儿成纤维细胞生长周期Fig.8 The cell growth cycle of passage 15 cells
3 讨论
3.1 山羊胎儿成纤维细胞培养
当前对胎儿成纤维细胞培养比较常用的方法主要有两种,即组织块贴壁培养法和分离单细胞接种培养法。组织块贴附法具有简单方便,细胞均质性好,易于操作,避免对细胞造成伤害,节约费用和成功率高等优点,培养动物成纤维细胞多采用此法[11-12]。分离单细胞接种培养法虽然也可以较好的培养细胞,但消化酶对细胞的伤害较大,会影响原代细胞的存活率和贴壁率。因此,本试验选用组织块贴壁培养法培养细胞。屠迪等[13]研究表明,组织块培养法培养的牦牛原代胎儿成纤维细胞和早期传代细胞中,会混有较多的上皮样细胞,需要多次传代才能得到高纯度的细胞。成纤维细胞和上皮细胞相比,对消化液敏感性强,通过控制适当的消化时间可以纯化细胞,一般经3次~5次传代纯化,就可以得到较纯的成纤维细胞[14]。本试验的研究结果和上述研究相一致,奶山羊胎儿成纤维细胞原代及前3代都混有一些上皮样细胞,直到第4代才分离到纯化的胎儿成纤维细胞。另外,原代细胞的培养中,污染成为困扰着我们的一个常见问题,本试验在原代细胞的培养液里加入了200单位/mL的双抗,很好的防止了原代细胞的污染,这和马忠辉等[15]的做法相同。本试验分离的奶山羊胎儿成纤维细胞系生长曲线呈“S”型,细胞表现为明显的3个分期,潜伏期、对数生长期和平台期。接种第1~2天的细胞处于恢复期,细胞数量基本变化不大;从第2天后进入对数生长期;3 d~5 d为增殖高峰期,5 d后进入平台期,细胞逐渐长满,7 d后细胞出现接触抑制而开始死亡。该细胞生长曲线表明,符合体外细胞的生长特征,具有正常的细胞生物学特性。对体细胞介导的基因打靶生产转基因动物而言,从细胞转染到获得阳性克隆至少需要20 d以上,相当于细胞8代以上。到转基因细胞进行核移植时,细胞在体外至少培养了10代以上,因而核供体细胞需要有较好的增殖活性而又不容易发生染色体的畸变。本试验应用流式细胞仪测定第4代和第15代奶山羊胎儿成纤维细胞细胞周期和倍性。通过对这两代细胞测定结果进行对比分析,以第4代胎儿成纤维细胞作为二倍体对照,第15代细胞仍为二倍体细胞,没有发生染色体变异。另外,细胞周期分析表明,细胞在体外传了15代后,其增殖活性仍然很好,和第4代细胞相比,没有多大变化。因而此细胞系可以用于细胞筛选,在获得阳性克隆后作为转基因克隆的供体细胞。
3.2 SRY-PCR法胎儿性别鉴定
目前性别鉴定的方法有许多种,如染色体核型分析法,细胞免疫学方法,DNA探针法及SRY-PCR法等。这几种方法相比较,SRY-PCR方法具有特异性强,灵敏度高,操作方便快捷且准确(准确率达95%~100%)的优点,因而成了一种广泛应用的方法。SRY是在不同动物中高度保守的雄性Y染色体上性别决定区的基因[16]。SRY基因的表达决定了胚胎向雄性方向分化,因此可通过特异性扩增SRY基因的核心序列对动物胚胎或细胞进行性别鉴定。曾溢涛等通过对SRY基因核心序列HMG盒测序设计引物对奶牛胚胎进行性别鉴定,准确率达100%[17]。Harely V R等[18]从SRY基因核心序列以外的片段扩增产物鉴定了人和牛早期胚胎的性别。本试验根据设计的SRY基因扩增引物可以从阳性对照公山羊血液基因组有效的扩增出337 bp的预期片段,而阴性对照母山羊血液基因组却未能扩增出该片段。说明,含有相同337 bp特性一片段GFF2为雄性细胞系,而不含该特异性条带的GFF1为雌性细胞系。序列测定及同源性分析进一步证明扩增产物为SRY基因片段,说明该试验设计的引物可用于PCR扩增准确鉴定山羊胎儿成纤维细胞的性别。PCR扩增技术的高灵敏性,极易受到污染,影响鉴定结果。因而在操作过程中要注意,比如要建立空白对照,吸头、离心管均高压灭菌,一次性使用;戴一次性手套,配制PCR预混液等,尽量减少因操作不当而造成的污染。另外,本试验采用了复合PCR,就是在同一个反应环境中,使用多对PCR引物对多个基因进行扩增。我们根据山羊β-乳球蛋白基因设计了一对内标引物,同时进行PCR反应。这样可以避免因基因组提取不当或操作过程中的失误而造成的假阴性。
本试验成功分离培养了两株奶山羊胎儿成纤维细胞系,并对细胞系进行了SRY-PCR性别鉴定,GFF1为雌性,GFF2为雄性。细胞生长曲线与细胞周期及倍性分析表明,这两株细胞系活力旺盛,能够进行长时间的体外培养,适于作为体细胞核移植的供体细胞,为高产优势奶山羊新品种的培育奠定了基础。
[1]Sendai Y,Sawada T,Urakawa M,et al.alpha1,3-galactosyltransferase-gene knockout in cattle using a single targeting vector with loxP sequences and creexpressing adenovirus[J].Transplantation,2006,81(5):760-766.
[2]Kuroiwa Y,Kasinathan P,Matsushita H,et al.Sequential targeting of the genes encoding immunoglobulin-mu and prion protein in cattle[J].Nat Genet,2004,36:775-780.
[3]Richt J A,Kasinathan P,Hamir A N,et al.Production of cattle lacking prion protein[J].Nat Biotechnol,2007,25(1):132-138.
[4]M cCreath K J,Howcroft J,Campbell K H,et al.Production of gene-targeted sheep by nuclear transfer from cultured somatic cells[J].Nature,2000,405(6790):1066-1069.
[5]Lai L,Kolber-Simonds D,Park K W,et al.Production of alpha-1,3-galactosyl transferase knockout pigs by nuclear transfer cloning[J].Science,2002,295(5557):1089-1092.
[6]Yu G,Chen J,Yu H,et al.Functional disruption of the prion protein gene in cloned goats[J].Gen Virol,2006,87:1019-1027.
[7]Zhu C,Li B,Yu G,et al.Production of Prnp(/)goats by gene targeting in adult fibroblasts[J].Transgenic Res,2009,18(2):163-171.
[8]Denning C,Dickinson P,Burl S,et al.Gene targeting in primary fetal fibroblasts from sheep and pig[J].Cloning Stem Cells,2001,3:221-231.
[9]Polejaeva I A,Campbell K H.New advances in somatic cell nu-clear transfer:Application in transgenesis[J].Theriogenology,2000,53:117-126.
[10]Shen W,Yang Z T,Li L,et al.The parameter of gene targeting and characteristic anaysis of goat fetal fibroblasts[J].Anim Biotechnol Bull,2004,10:21-27.
[11]杨东山,杜晨光,高飞,等.牛胎儿成纤维细胞的组织块贴附法分离培养与电穿孔法基因转染[J].动物学研究,2006,27(1):41-47.
[12]王 超,李向臣,安志兴.山羊胎儿成纤维细胞的冷冻保存和体外培养[J].西北农林科技大学学报:自然科学版,32(4):55-58.
[13]屠 迪,崔 燕,余四九.牦牛胎儿成纤维细胞的分离培养[J].中国兽医科学,2006,36(7):573-577.
[14]Xu J,Guo Z,Su L,et al.Developmental potential of vitrified holstein cattle embryos fertilizedin v itrowith sex-sorted sperm[J].J Dairy Sci,2006,89(7):2510-2518.
[15]马忠辉,赵巧香,杨焕民.牛胎儿成纤维细胞的培养及性别鉴定[J].黑龙江畜牧兽医,2009(7):19-21
[16]Gubby J,Collig non J,Koopman R,et al.A genemapping to the sex-determining region Y gene chromosome is a member of a novel family of embryonically expressed genes[J].Nature,1990,346(6281):245-250.
[17]曾溢滔,张美兰,陈美珏,等.应用PCR扩增SRY序列进行奶牛胚胎性别的鉴定[J].中国科学:B辑,1993,23(4):371-374.
[18]Harley V R,Jackson D I,Hextal P J,et al.DNA binding activity of recombinant SRY from normal and XY female[J].Science,1992(255):453-456.
Isolation and Culture of Diary Goat Fetal Fibroblasts and Sex Indentification by SRY Gene
CHEN Hua-tao,HU Lin-yong,YANG Yan,LI Qian,JIN Ya-ping
(Key Laboratory of Animal Reproductive Endocrinology and Embryo Biotechology of Agriculture Ministry of China,College of Veterinary Medicine,Northwest A&F University,Y angling,Shaanxi,712100,China)
In order to explore and establish the method for isolation,cultivation,and sex identification of dairy goat fetal fibroblasts(GFFs)in vitro,obtain the donor cells for dairy goat transgenic cloning,two dairy goat fetal fibroblast cell lines passing through separation and purify were obtained by tissue explant attachment.The GFFs were examined by cell morphology,growth curve,cell cycle and DNA ploidy.A pair of PCR primers were designed to identify the sex of GFF cell lines according to the goat SRY gene,the other pair of inner reference PCR primers were designed according to the goat BLG gene,the SRY-PCR reaction system was established and the two GFF cell lines were identified.T he cytological bioactivity of the isolated cell lines was excellent,they could grow and proliferate quicklyin vitro.T he positive control sample and GFF2 sample obtained the PCR fragment of 337 bp and the BLG gene PCR fragment of 498 bp.However,the negative control sample and the GFF1 sample did not amplify the PCR fragment of 337 bp.The PCR fragment of 337 bp was cloned into pMD19-T vector and the pSRY recombinant vector was constructed,then the vector was sequenced by M13 universal primers.The result of sequence determined that the corresponding gene is partial SRY gene fragment.The result indicated that the cell line with 337 bp fragment is male.This study laid the foundation for breeding new breed of transgenic dairy goat.
dairy goat;fetal fibroblast;SRY gene;sex identification
Q813.11
A
1007-5038(2010)08-0001-07
2010-05-14
国家转基因生物新品种培育重大专项(2008ZX08008-004)
陈华涛(1984-),男,安徽砀山人,硕士研究生,主要从事家畜生殖内分泌与转基因动物新品种培育研究。

