中国北方汉族男性血管内皮生长因子基因C936T单核苷酸多态性与HiHiLo后心功能变化的关联研究
聂晶 胡扬 衣龙燕 张漓
1江西师范大学(南昌 330022) 2北京体育大学 3国家体育总局体育科学研究所
低氧训练作为提高运动员有氧耐力素质的手段已广泛应用,但训练效果存在明显个体差异[1],推测可能与机体对低氧环境的适应性不同有关。迄今为止,国内外学者已发现一些基因多态性与低氧适应能力有关[2,3]。
血管内皮生长因子(VEGF)是血管内皮特有的有丝分裂原,在生理性和病理性血管新生过程中均起关键的调控作用[4,5]。大量研究表明,低氧运动可使心肌组织中VEGF基因表达增加[6-8],从而诱导心肌组织毛细血管的生成。这一过程将有利于增加心肌组织氧气和能源物质的供应,增强心肌的工作能力。VEGF基因位于人类染色体6p21.3,是已发现的低氧反应基因之一。有文献报道,在该基因的3’非翻译区中,C936T单核苷酸多态性具有功能活性,与VEGF蛋白生成量的差异有关[9,10]。因此,鉴于VEGF基因在心肌中所发挥的重要生物学作用,能否利用C936T单核苷酸多态性预测低氧训练后心功能的变化,目前尚未见相关报道。本研究通过探讨中国北方汉族男性VEGF基因C936T单核苷酸多态性与30天低氧训练前后心功能变化的关联性,为制定个性化的低氧训练方案提供分子遗传学标记。
1 对象和方法
1.1 研究对象
选取62名中国北方汉族平原地区健康男性受试者,无低氧环境居住史,均来自北京体育大学体育系和运动系,平均年龄 21.10±1.37 岁,身高 177.82±5.40cm,体重68.46±8.15kg。受试者对实验均知情同意。
1.2 实验方法
1.2.1 低氧训练方案
HiHiLo方案:低氧睡眠+低氧训练+常氧专项训练,共 30天。其中,低氧睡眠 7d/周,每晚至少 10h(晚21∶00~次日晨 7∶00),氧浓度为 14.8%~14.3%(模拟海拔约 2800~3000m);低氧训练 3次 /周,方式为常压低氧环境(氧气浓度为15.4%~14.8%,模拟海拔约2500~2800m)蹬功率自行车 30min(60r/min),以个体 75%VO2max强度为基础,运动过程中调节功率车负荷使受试者SpO2维持在87%~93%。其余时间在常氧环境下根据受试者的运动项目进行专项训练。低氧环境由国产低氧发生设备提供。
1.2.2 左心室结构和功能的测定
采用Doppler超声心动图仪分别在HiHiLo前后测定1次。每次测试前受试者至少休息24h,测试图像在仰卧、静息5min后获取。测试指标包括直接测试指标和衍生指标。其中,直接测试指标有左室舒张末内径(EDD)、左室收缩末内径(ESD)、左室舒张末后壁厚度(PWD)、舒张末室间隔厚度(IVSD)和心率(HR);衍生指标有每搏输出量(SV)、每搏输出量指数(SI)、心输出量(CO)、心指数(CI)、射血分数(EF)、左室心肌重量(LVM)和左室心肌重量指数(LVMI)。
SV、EF 的测算参照改良 Simpson 法[11,12]。计算公式如下:CO(L·min-1)=SV×HR;LVM(g)=1.04×[(EDD+PWD+IVSD)3-EDD3]-14;体表面积(BSA)=0.006×身高(cm)+0.0128×体重(kg)-0.152;CI=CO/BSA;SI=SV/BSA;LVMI=LVM/BSA。
1.2.3 基因多态性分析
用Promega试剂盒提取全血DNA。采用PCR-RFLP进行基因多态性分析。用primer premier5.0自行设计引物:上游引物:5’-ctc acc agg aaa gac tga tac ag-3’(23bp),下游引物:5’-ctc cca act caa gtc cac ag-3’(20bp)。PCR 扩增体系 (15μl):10×buffer 1.5μl,MgCl20.9μl,dNTP 0.3μl,primer 1.5μl,Taq 0.15μl,模板 0.5μl。扩增条件:95℃预变性 5min;95℃变性 40s,62℃退火50s,72℃延伸 50s,循环 35次;最后 72℃延伸 7min。酶切体系:7μl反应体系:NlaⅢ2U,buffer 0.7μl,扩增产物3.5μl,37℃酶切 4.5h。
1.3 统计学分析
变化率=(训练后-训练前)∕训练前×100%。所有数据处理采用SPSS13.0软件统计包完成。采用卡方检验和精确率检验受试者基因型频率是否符合H-W平衡定律;先用K-S检验训练前后生理指标数据是否符合正态分布,低氧训练后的指标变化采用配对t检验,不同基因型之间训练前以及变化率差异采用独立样本t检验。显著性水平设为P<0.05,非常显著性水平设为P<0.01。
2 结果
2.1 VEGF基因SNP/C936T基因型鉴定结果及分布特征
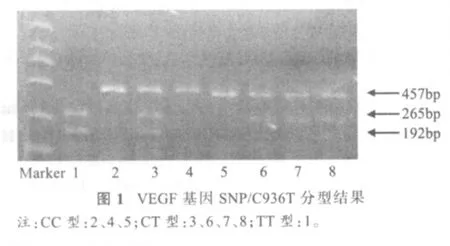
VEGF基因SNP/C936T分型结果见图1。其中,PCR产物长度为457bp,经NlaⅢ内切酶酶切消化后,出现三种类型条带:有酶切位点的纯合型TT被切为265bp和192bp两条带;没有酶切位点的纯合型CC为457bp一条带;杂合型CT为457bp、256bp和192bp三条带。
62名受试者中CC型46人,频率为74.19%;CT型15人,频率为24.19%;TT型1人,频率为1.61%。C等位基因频率为86.29%,T等位基因频率13.71%。经卡方检验,结果显示:χ2(df=2)=0.00,P=1.00,表明该人群符合H-W平衡定律,具有群体代表性。
2.2 HiHiLo后受试者左心结构功能的变化
表1显示,30天低氧训练后,62名受试者左心结构和功能均出现不同程度的变化。在结构指标中,EDD、ESD、PWD、IVSD、LVM、LVMI均较训练前有所增加,其中IVSD、PWD、LVM 和 LVMI增加十分显著(P<0.01),变化率 分 别 为 2.47±5.30% 、2.98±7.95% 、4.04±6.26% 和4.38±6.40%。在功能指标中,EF、SV、SI均较训练前显著增加,其中,SV和 SI增加十分显著(P<0.01)。而 HR、CO和CI均较训练前显著下降,其中HR下降十分显著(P<0.01),为 6.62±15.48%。
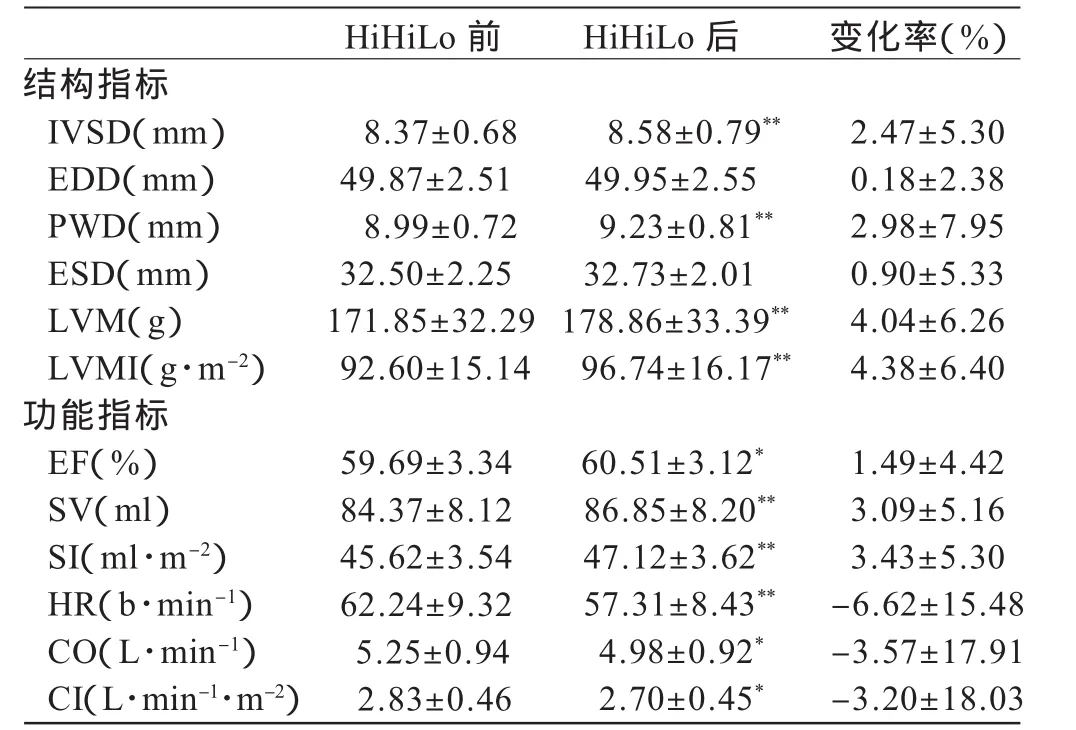
表1 受试者HiHiLo后左心结构功能变化(n=62)
2.3 VEGF基因SNP/C936T与HiHiLo训练后左心结构功能变化的关联性
表2显示,低氧训练前,CC基因型者和CT基因型者左心结构功能指标均无显著性差异。30天低氧训练后,CC基因型者LVM、LVMI增加幅度显著高于CT基因型(P<0.05),且SV、SI变化幅度也存在显著性差异(P<0.01),即CC>CT,其它指标变化幅度在不同基因型之间未见显著差异。
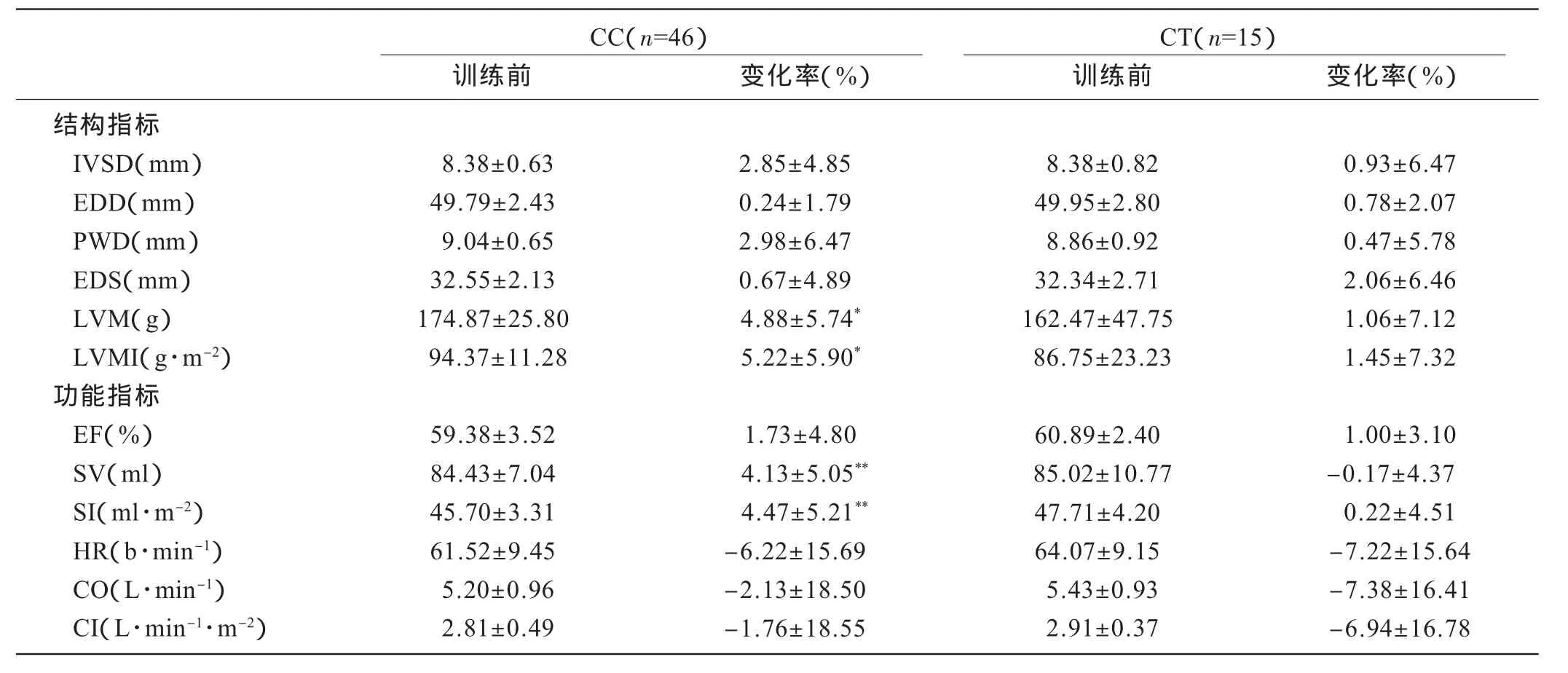
表2 不同基因型受试者HiHiLo后左心室结构功能的变化
3 讨论
本研究发现,30天HiHiLo训练后,受试者左心形态功能均出现良好的生理性重塑。在形态方面,PWD、IVSD、LVM和LVMI增加幅度显著。在心功能方面,EF、SV、SI均较训练前显著增加,HR、CO和 CI均较训练前出现显著性下降,其中SV、SI和HR变化幅度达到十分显著水平(P<0.01)。以上结果表明,心脏出现了明显的能量节省化,心力储备显著提高,并伴随着以心壁增厚为主的运动性心脏肥大。这是机体对低氧刺激产生的一种适应性变化。但本结果与某些报道并不完全一致[13]。这可能与样本量、运动项目、训练水平、训练模式不同有关。
在低氧训练中,机体耐受缺氧的一个最明显的适应性变化就是诱导大量的新生血管形成。已有研究证实,低氧训练能够促进心肌毛细血管的生成[14,15]。心肌组织毛细血管增多,加大了心肌组织中氧气从血液到细胞的弥散面积,加快了弥散速度,有利于心肌组织氧气和能源物质的交换,增强了心肌的工作能力,从而保证输送更多的血液到运动器官。因此,低氧运动中心肌毛细血管的生理性重塑构成了心肌有氧氧化和能量产生增多、心肌功能增强的重要结构基础。而血管新生这一过程受到诸多细胞因子的调节,其中VEGF最为重要。大量研究表明,缺氧、运动或低氧运动均可使心肌组织中VEGF基因表达上调[6-8,16-18]。还有研究推测VEGF基因参与了运动性心肌肥大的形成机制[8]。因而,VEGF基因在心功能改善中发挥了重要的作用。目前,已有研究发现,VEGF基因序列的改变会影响VEGF蛋白的生成量、活性,以及基因表达[9,10,19,20]。这可能会进一步导致低氧训练后心功能改善效果上的个体差异性。
本研究发现,HiHiLo训练后,CC基因型者心脏表现出更好的生理性重塑。其中,CC基因型者LVM、LVMI、SV和SI的增加幅度均显著高于CT基因型者,而其它指标变化幅度在不同基因型之间未见显著差异。以上结果表明,VEGF基因C936T多态性与低氧训练后部分心形态功能指标(LVM、LVMI、SV、SI)的变化有关联。而且提示了CC基因型者对于HiHiLo训练表现出更好的心脏适应能力,主要反映在心肌收缩力以及心脏泵血功能方面。运动员心脏增大(室壁增厚和心腔扩大)对增强心脏做功以及提高每搏量极其重要。而每搏量提高体现了心肌收缩力以及心脏泵血功能的增强。因此,推测CC基因型者在HiHiLo后心肌组织中VEGF基因表达明显增强,进一步诱导了心肌毛细血管的增生,改善了心肌的氧供、增加了能量的生成、从而增强心肌收缩射血的能力。其关联原因可能与该多态所处的位置有关。有研究显示,VEGF基因的3’非翻译区参与了低氧诱导人VEGF mRNA稳定性调节[21]。碱基由 C→T可能导致转录因子AP-4结合位点的消失,改变了mRNA稳定性,从而影响VEGF mRNA水平。在低氧条件下,mRNA稳定性增强是导致稳定的VEGF mRNA增加的原因[22]。Renner等研究证明,C936T多态性与较低的血浆VEGF水平关联,携带T等位基因者血浆VEGF水平偏低[9]。但该多态也可能只是与某个功能性的多态位点处于连锁不平衡。因此,本研究所选取的C936T多态究竟是不是影响心功能(SV、SI)变化的功能位点,这需要进一步对该基因区域进行测序和功能研究。而且,本研究中T等位基因频率分布较低,TT基因型者只有1人,因而还有待加大样本量进一步验证。
4 总结
VEGF基因C936T多态性与HiHiLo训练后的LVM、LVMI、SV及SI的变化有关联。其中,CC基因型LVM、LVMI、SV以及SI增加幅度均显著高于CT基因型,提示CC基因型者在HiHiLo后产生了更好的心脏适应性变化,可作为预测HiHiLo后部分心功能(SV、SI)变化的分子遗传学标记。
[1]Chapman RF,Gundersen JS,Levine BD.Individual variation in response to altitude training.J Appl Physiol,1998,85:1448-1456.
[2]Stobdan T,Karar J,Pasha MA.High altitude adaptation:genetic perspectives.High Alt Med Biol,2008,9(2):140-7.
[3]Ahsan A,Norboo T,Baig MA,et al.Simultaneous selection of the wild-type genotypes of the G894T and 4B/4A polymorphisms of NOS3 associate with high-altitude adaptation.Ann Hum Genet,2005,69(Pt 3):260-7.
[4]Hashimoto E,Ogita T,Nakaoka T,et al.Rapid induction of vaseular endothelial growth factor expression by transient in rat heart.Am J Physiol,1994,267:H1948-1954.
[5]Buschmann I.Sehaper W.The pathophysiology of the collat eral circulatiotn(arteriogenesis).J Pathol,2000,190:338-342.
[6]黄丽英,翁锡全,林文弢.常压模拟高住低练对大鼠心肌低氧诱导因子1α基因表达的影响.中国运动医学杂志,2004,3(2):133-141.
[7]翁锡全,黄丽英,林文弢.常压模拟高住低练对大鼠心肌血管内皮生长因子基因表达的影响.中国运动医学杂志,2003,22(4):354-357.
[8]李昭波,高云秋,杨萍,等.大鼠运动性肥大心脏心肌血管内皮生长因子及其基因表达的研究.中华应用生理学杂志,1999,15(2):123-125.
[9]Renner W,Kotschan S,Hoffmann C,et al.A common 936C/T mutation in the gene for vascular endothelial growth factor is associated with vascular endothelial growth factor plasma levels.J Vasc Res,2000,37(6):443-448.
[10]Zhai R,Gong MN,Thompson TB,et al.Geno-types and haplotypes of VEGF gene are associated with higher ARDS mortality and lower VEGF plasma levels.Thorax,2007,62:718-722.
[11]张贵灿.现代超声心动图学.福州:福建科学技术出版社,2003,68-72.
[12]王新房.超声心动图学.北京:人民卫生出版社,1999,50-52.
[13]李俊涛.低氧训练中国家女子中长跑运动员心功能的变化.中国期刊网—中国优秀博硕士论文全文数据库.22-24.
[14]陈福刁.间歇低氧训练对心肌毛细血管的影响.广州体育学院学报,2005,6:47.
[15]郑澜.低氧运动促进肌组织血管生成的机制.北京:北京体育大学出版社,2006.67-68.
[16]步斌.不同负荷运动对大鼠心肌促血管内皮生长因子表达的影响.中国运动医学杂志,2005,24(2):165-169.
[17]Shweiki D,Itin A,Soffer D,et al.Vascular endothelial growth factor induced by hypoxia may mediate hypoxia initiated angiogenesis.Nature,1992,359:843.
[18]Motoyuki I,Seiji M,Subrina J,et al.Exercise training improves aging-induced down regulation of VEGF angiogenic signaling cascade in hearts.Am J Physiol Heart Circ Physiol,2006,291(3):H1290-H1298.
[19]Shahbazi M,Fryer A,Pravica V,et al.Vascular endothelial growth factor gene polymerphisms are associated with acute renalallograft rejection.J Am Soc Nephrol,2002,13(1):260-264.
[20]Watson C J,Webb N J,Bottomle Y,et al.Identification of polymorphisms within the vascular endothelial growth factor(VEGF) gene:correlation with variation in VEGF protein production.Cytokine,2000,12(8):1232-35.
[21]Claffey KP,Shih SC,Mullen A,et al.Identification of a human VPF/VEGF 3’Untranslated region mediating hypoxia-induced mRNA stability.Mol Biol Cell,1998,9(2):469-481.
[22]刘刊,谢印芝,尹昭云.mRNA稳定机制在低氧反应基因表达调控中的作用.生命的化学,2002,2(22):133-135.

