CIN宫颈组织中Treg细胞和Th1/Th2细胞因子的表达及意义
蒋艳萍 曹来英 洛若愚
宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是与宫颈浸润癌密切相关的一组宫颈病理变化,包括CINⅠ、CINⅡ和CINⅢ等一系列发生、发展的连续过程。人乳头瘤病毒(human papillomavirus,HPV)感染持续存在是宫颈上皮内瘤变进展的必须条件[1]。许多研究显示:与并发HPV感染但无宫颈病变患者比较,高级别CIN病变(CINⅡ和CINⅢ)患者外周血中抗HPV抗原的免疫反应降低[2]。然而,细胞因子在外周血和宫颈黏膜中的表达并非具有一致性[3],宫颈组织的局部免疫反应在宿主抗HPV感染和宫颈病变的进展中也发挥重要作用[4]。近期研究表明,在多种人类肿瘤中,Treg细胞参与抑制免疫反应,与肿瘤免疫逃逸密切相关[5],在宫颈癌的间质和上皮组织中表达增强[6],参与疾病的发生。本研究检测CIN患者宫颈组织中Th1/Th2细胞因子免疫反应和Treg细胞水平的变化,为CIN的防治提供新的思路。
1 材料与方法
1.1 病例选择
选择2009年7月~2010年5月我院收治的189例女性患者,平均年龄为(34.2±3.3)岁,81例(43%)为良性病变,60例(32%)为 CINⅠ,27例(14%)为CINⅡ,21例(11%)为CINⅢ。每位患者均行HPV检测、宫颈TCT检查及宫颈活检,根据组织学结果按病变程度分为良性病变、CINⅠ、CINⅡ和CINⅢ四组。选择研究病例根据HPV高危型和CIN的病变程度。所有研究患者应排除以下条件:绝经期妇女、妊娠、慢性疾病(糖尿病、过敏、自身免疫性疾病)、急性感染、口服避孕药、使用镇痛药至少2周以上(非甾体抗炎药物)。HPV检测:宫颈组织样本收集后送医院检验科检测。
1.2 实验方法
1.2.1 标本采集 宫颈组织样本的收集用于细胞因子的检测[7],简单的说,细胞刷样本放入RNA稳定剂中,储存于-80°C。细胞溶解于Trizol,RNA分离参照说明书进行。宫颈活检组织一部分用于病理检查,一部分制成单细胞悬液用于细胞和细胞因子的检测。
1.2.2 引物设计 从美国国立生物技术信息中心(NCBI)的Entrez核酸数据库(Entrez Nucleotides database)中检索,应用设计软件Primer 5.0进行引物设计,然后将设计出的引物输入BLAST数据库中进行同源性比较,最终得到特异的引物序列。所有引物均由上海赛百胜生物公司合成。设计出的引物序列如下:IL-2 sense primer:5’-TATGCATCCGAGAC AATGGTTC-3’,IL-2 antisense primer:5’-CGAATTCTCAGACTTTAGGTGC-3’;IL-4 sense primer:5’-ACAAAAATCACTTGAGAGAGATCAT-3’,IL-4 antisense primer:5’-AGT TCCATTTGCATGATGCTCTT-3 ’;IFN-γ sense primer:5’-GAACGCTACACAC TGCATC-3’,IFN-γ antisense primer:5’-GA GCTCATTGAATGCTTGG-3’;IL-10 sense primer:5’-ACAGCTCAGCACTGCTCTG-3’,IL-10 antisense primer:5’-AGTTCACATG CGCCTTG-3’;IL-12 sense primer:5’GCCCAGCTGCTGAGGAGAGT-3’,IL-12 antisense primer:5’-TGGGTGGGTCAGGTTTGATG-3’;GAPDH sense primer:5’-ACAACAGCCT CAAGATCATCAG-3’,GAPDH antisense primer:5’-GGTCCACCACTGA CACGTTG-3’。
1.2.3 宫颈组织微量RNA的提取和逆转录合成CDNA 宫颈组织使用微量RNA提取试剂盒(QIAGEN)提取总RNA,具体操作步骤按试剂盒说明书进行。用MBI逆转录试剂盒进行逆转录反应,反应体系为20 μl,全过程在冰上进行。
1.2.4 Q-PCR检测 实验中 Q-PCR所用染料为SYBR Green。反应条件均为95℃12 min,然后95℃15 s,60℃ 60 s,共45个循环。以GAPDH的表达量作为内参照。采用SYBR Green试剂可通过每1个PCR扩增反应中循环产物的荧光信号强度进行实时检测,从而记录产物量。
1.2.5 流式细胞仪检测宫颈组织中Treg细胞的变化
将收集的宫颈组织单细胞悬液计数,每样本细胞数应达到1×106个。检测Treg细胞,加入鼠抗人CD4-FITC单克隆抗体、鼠抗人CD25-PE单克隆抗体、鼠抗人CD127-ACEXA647单克隆抗体,室温孵育30 min。处理好的样品置流式细胞仪按常规进行分析,以相应的荧光标记的同型对照IgG1染色细胞作为阴性对照,应用EXPO2软件分析结果。
1.3 统计学分析
统计学分析采用InStat软件,数据以均数±标准差表示,采用χ2检验进行统计学处理。
2 结果
2.1 4组HPV检测结果
4组患者HPV检测的结果见表1。

表1 4组患者HPV检测情况(例,%)
2.2 Treg细胞表达的检测
统计学分析结果显示,CINⅡ 、CINⅢ患者宫颈组织(cervix biopsy,CB)中Treg细胞占CD4+T细胞比例分别为(7.0 ±1.3)%、(7.3 ±1.4)%,高于良性病变及 CINⅠ患者的(4.9 ±0.9)%和(5.4 ±1.1)%,P <0.05,有统计学意义,见图 1。
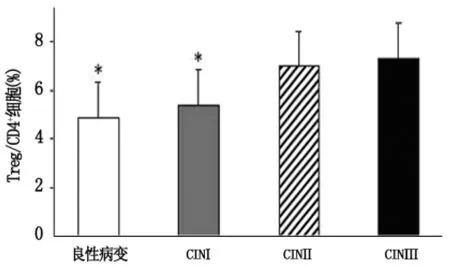
图1 4组宫颈组织中Treg/CD4+T细胞的比例
2.3 Th1/Th2细胞因子的检测
良性病变、CINⅠ、CINⅡ和CINⅢ组宫颈组织(CB)中 IFN-γ 表达水平分别为(6.2 ±1.9) ×103、(5.7 ±1.6)×103、(4.2 ±1.1)×103、(3.9 ±1.0)×103拷贝,逐渐下降,其中良性病变和CINⅠ组高于CINⅡ和CINⅢ组,P<0.05,有统计学意义。IL-10表达水平在良性病变、CINⅠ、CINⅡ 和CINⅢ组宫颈组织(CB)中分别为(3.1 ±0.9) ×103、(3.3 ±1.1) ×103、(4.7 ±1.3)×103和(5.0 ±1.6)×103拷贝,逐渐上升,且CINⅡ和CINⅢ组高于良性病变和CINⅠ组,P <0.05,有统计学意义。IL-2、IL-12 及 IL-4 表达水平在4组患者中无明显差异,见图2。
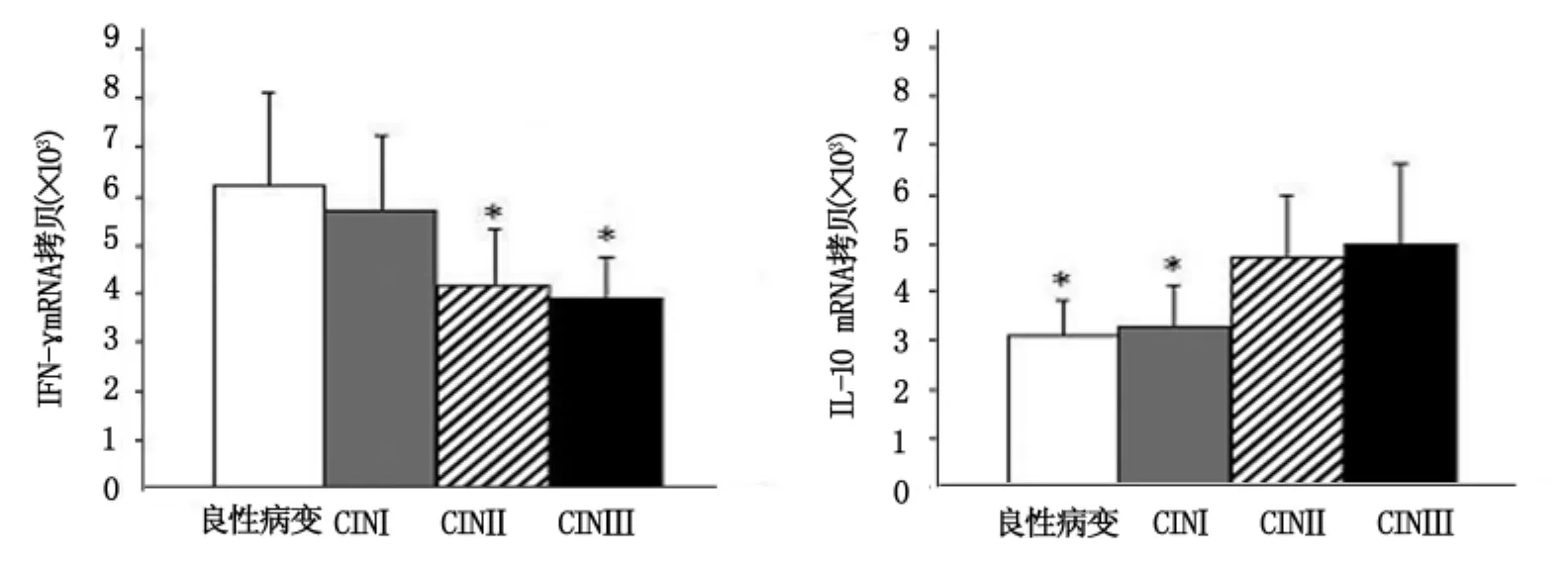
图2 4组宫颈组织中IFN-γ、IL-10表达情况
3 讨论
现已发现多种肿瘤患者体内Th2型细胞因子占优势状态,机体免疫反应向Th2偏移[8]。宫颈上皮内瘤变(CIN)是与宫颈浸润癌密切相关的一组宫颈病理变化,既往关于患者体内细胞因子变化的研究数据多来源于外周血。本文的研究显示:相比较正常良性病变和轻度CIN病变患者,中、重度CIN患者(CINⅡ 和CINⅢ)宫颈组织中 IFN-γ表达水平下降。IFN-γ由Th1型细胞、细胞毒性T细胞及活化的NK细胞分泌,介导有效的Th1型细胞免疫反应,对抗HPV感染。HPV持续感染与IFN-γ分泌下降密切相关,并引起宫颈内瘤病变的进展[9]。本文来源于宫颈组织中IFN-γ的研究结果与既往相关报道结果一致。其他的Th1型细胞因子如IL-2在4组患者宫颈组织中的表达无明显变化。
在宫颈内瘤变的发展过程中,通过外周血中Th2型细胞因子如IL-4和IL-10的高表达,使机体偏向于Th2型细胞免疫反应。在本文研究组患者的宫颈组织中,IL-4的浓度没有明显变化,IL-10的浓度随着CIN病变程度的增加而明显增加。IL-10在免疫抑制中发挥重要的作用,抑制T细胞的激活和Th1细胞的分化。有研究者报道,在中、重度的鳞状上皮病变中,IL-12∶IL-10的比例明显下降,表现为偏向于Th2型细胞免疫反应[10]。IL-12是细胞免疫中重要的免疫调节因子,它可以促进NK细胞和CTL的活性,能刺激T细胞及NK细胞的增殖,并诱导分泌多种细胞因子,尤其是IFN-γ。我们研究发现,随着CIN病变的进展,研究组患者宫颈组织中IFN-γ、IL-12、IL-2表达水平无明显变化或表达下降,与IL-10的比例呈明显下降趋势,支持和扩展了既往的一些研究结果,表明机体抗HPV感染的细胞免疫反应下降,导致CIN病变的进行性发展。
Treg 的表面标志为 CD4、CD25、FOXP3,这些表面标志在人类Treg细胞的检测中存在争议,研究表明CD4+CD25+CD127low/-可作为 Treg细胞检测的标志。既往关于Treg细胞和CIN病变的相关研究较少,有研究表明在CIN及宫颈癌患者外周血单核细胞或CD4+T细胞中Treg细胞比例增加,如果清除CD25+T细胞能提高HPV16 E6-和E7特异性辅助T细胞反应,表明内在的抗HPV反应存在[11],并且Treg细胞参与调节免疫反应,研究显示了人体系统(外周血)中的Treg细胞数增加与HPV持续感染存在关联性。而我们的研究结果来源于局部宫颈黏膜水平,显示CIN病变患者宫颈组织中Treg细胞数增加,并随病变程度的加重呈渐进性增加;同时,CIN程度的增加,高危型HPV感染比例增加,宫颈黏膜组织中Treg细胞数增加亦与HPV的持续感染密切相关。既往的研究和本文的研究分别从系统水平和宫颈黏膜局部水平,支持了Treg细胞下调机体抗HPV感染的免疫反应这一假设,导致CIN病变的渐进性发展。
总之,在HPV感染引起的宫颈CIN病变的进展过程中,宫颈组织中细胞因子网络发生变化:IFN-γ表达水平下降,IL-10表达水平增高,表明了Th1/Th2平衡向Th2偏移;在宫颈黏膜中Treg细胞表达随CIN病变程度的增加而增加。细胞因子和Treg细胞的变化下调机体抗HPV感染能力和抗肿瘤免疫反应。因此,应用相应的免疫治疗等手段纠正机体的免疫紊乱,可能增强机体的细胞免疫功能,克服肿瘤细胞的免疫逃逸和免疫封闭,为防治HPV感染所致的癌前病变中提供治疗的靶点。
[1] Nobbenhuis M,Walboomers J,Helmerhorst T,etal.Relation of human papillomavirusstatus to cervical lesionsand consequences for cervical cancer screening:a prospective study〔J〕.Lancet,1999,354:20.
[2] De Jong A,Van Poelgeest MI,Van der Hulst JM,et al.Human papillomavirus type 16-positive cervical cancer is associated with impaired CD4+T cell immunity againstearly antigens E2 and E6〔J〕.Cancer Res,2004,64:5449.
[3] Castle PE,Hildesheim A,Bowman FP,et al.Cervical concentrations of interleukin-10 and interleukin-12 do not correlate with plasma levels〔J〕.JClin Immunol,2002,22:23.
[4] Castle PE,Giuliano AR.Chapter 4:Genital tract infections,cervical inflammation,and antioxidant nutrients—assessing their roles as human papillomavirus cofactors〔J〕.J Natl Cancer Inst Monogr,2003,31:29.
[5] Baecher C,Anderson DE.Immune regulation in tumor-bearing hosts〔J〕.Curr Opin Immunol,2006,18:214.
[6] Piersma SJ,Jordanova ES,van PoelgeestMI,et al.High number of intraepithelial CD8+tumor-infiltrating lymphocytes is associated with the absence of lymph nodemetastases in patients with large early-stage cervical cancer〔J〕.Cancer Res,2007,67:354.
[7] ScottME,Ma Y,Farhat S,et al.Covariates of cervical cytokinemRNA expression by real-time PCR in adolescents and young women:effects of Chlamydia trachomatis infection,hormonal contraception,and smoking〔J〕.JClin Immunol,2006,26:222.
[8] Kusuda T,Shigemasa K,Arihiro K,etal.Relative expression levels of Th1 and Th2 cytokine mRNA are independent prognostic factors in patients with ovarian cancer〔J〕.Oncol Rep,2005,13(6):1153.
[9] Scott M,Nakagawa M,Moscicki AB.Cell-mediated response to human papillomavirus infection〔J〕.Clin Diagn Lab Immunol,2001,8:209.
[10] Jacobs N,Giannini SL,Doyen J,et al.Inversemodulation of IL-10 and IL-12 in the blood of women with preneoplastic lesions of the uterine cervix〔J〕.Clin Exp Immunol,1998,111:219.
[11] Visser J,Nijman HW,Hoogenboom BN,et al.Frequencies and role of regulatory T cells in patients with(pre)malignant cervical neoplasia〔J〕.Clin Exp Immunol,2007,150:199.

