槲皮素和8-Br-cAMP对肿瘤增变基因表型改变的影响
李 璇
肿瘤的增变基因表型(mutator phenotype)学说主要是指由于调控DNA稳定/修复基因的突变(mutator增变子)而引起监督DNA损伤的抑癌基因,如p53、p16等基因的失活/突变而导致肿瘤细胞对多药耐药性(MDR)增加和抗凋亡等肿瘤恶性的表型。
在失去生长、增殖调控的肿瘤细胞内PKC信号转导途径呈激活状态,而在PKA信号转导途径中PKAⅡ型受体处于失激活状态。槲皮素(类黄酮)具有阻抑PKC/TPK信号转导途径的作用。8-Br-cAMP是PKARⅡ的激动剂。本文主要探讨了槲皮素和8-Br-cAMP单独作用或联合应用是否可呈现不同信号转导途径的互补效应和对增变基因表型变动的影响。
1 材料与方法
1.1 材料 Bcl-2单克隆抗体(Santa Cruz)、Bax、XRCC1单克隆抗体(Lab Vision),TUNEL凋亡试剂(Promega),8-BrcAMP(Sigma),槲皮素(上海试剂二厂);POLB单克隆抗体(Lab Vision),MRP单克隆抗体(Zymed)。
1.2 细胞培养及分组 将培养的Eca-109细胞随机分为4组:①8-Br-cAMP(Br)组,加终浓度为2×10-5mol/L的8-BrcAMP;②槲皮素(Q)组,加槲皮素终浓度为43 μmol/L;③8-Br-cAMP和槲皮素共同作用(Br+Q)组,加终浓度为2×10-5/L的8-Br-cAMP和槲皮素终浓度为43 μmol/L;④对照组(C),仅加DMEM培养液(含10%胎牛血清)。各组细胞均培养48 h后收集细胞,制成1×107/ml细胞悬液滴加至预先处理过的玻片和硝酸纤维素膜(NCM)上。
1.3 细胞凋亡率检测 应用TUNEL法检测各组细胞的凋亡率。
1.4 蛋白免疫反应性的检测 应用免疫细胞化学技术分别对滴片进行MRP、POLB、Bcl-2、Bax和XRCC1免疫反应性(IR)的强弱和定位观察。应用免疫斑点印迹技术检测NCM膜上的POLB、MRP、Bcl-2、Bax和XRCC1的印迹并应用薄层层析扫描仪(Shimadu)以470 nm波长进行扫描。计总积分值。
1.5 统计学处理 采用SPSS10.0软件,计量资料用单因素方差分析,结果判定以α=0.05为水准。
2 结 果
2.1 各组细胞凋亡率 C组为4%,Br组为42%,Q组为35%,(Br+Q)组为70%,见图1~4。(Br+Q)组>Br组或Q组>C组,P<0.01。
2.2 Bcl-IR、Bax-IR和XRCC1-IR Bcl-IR和Bax-IR呈棕黄色颗粒,位于胞质内;XRCC1-IR呈棕黄色颗粒,多位于胞核,也可见到有些细胞的整个细胞呈阳性反应。四个实验组的免疫组化信号强弱积分值见表1。
2.3 各组Eca-109细胞的Bcl-2-IR、Bax-IR和XRCC1-IR的相关性 Bcl-2-IR与Bax-IR呈显著负相关,r=-0.984 9,P<0.01;Bcl-2-IR与XRCC1-IR呈显著正相关,r=0.992 6,P<0.01;Bax-IR与 XRCC1-IR呈显著负相关,r=-0.996 2,P<0.01。
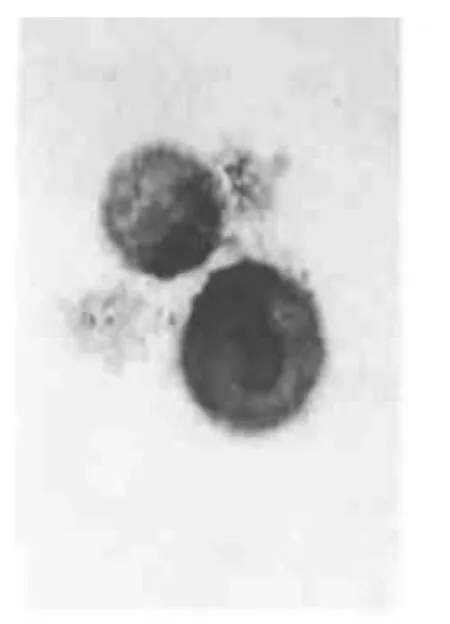
图1 Br组Eca-109细胞凋亡增加 TUNEL,×1000
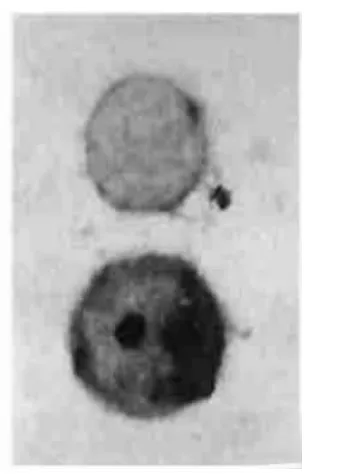
图2 Q组Eca-109细胞凋亡增加 TUNEL,×1000
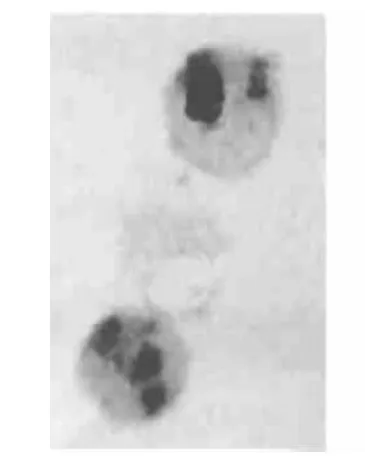
图3 (Br+Q)组Eca-109细胞凋亡显著增加 TUNEL,×1000
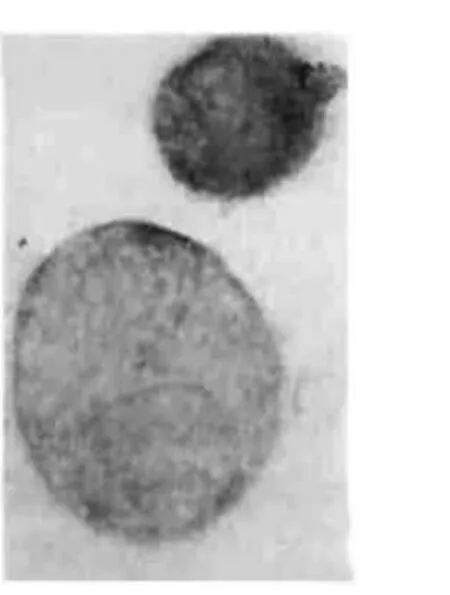
图4 C组Eca-109细胞凋亡很少见 TUNEL,×1000

表1 各组细胞Bcl-2、Bax、XRCC1-IR积分
2.4 各组免疫斑点印迹薄层色谱扫描数值 见表2。
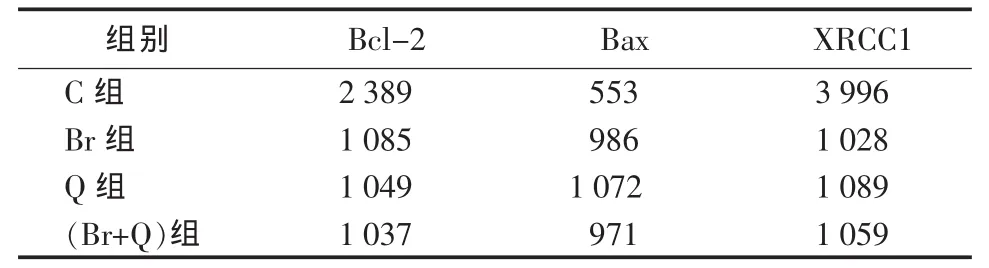
表2 各组免疫斑点印迹扫描数值
2.5 各组Eca-109细胞的POLB-IR、MRP-IR表达及积分POLB-IR呈棕黄色颗粒,多位于胞核,也可见到有些细胞的整个细胞呈阳性反应。MRP-IR呈棕黄色颗粒主要位于细胞质。四个实验组的免疫组化信号强弱的积分值见表3;MRP与POLB呈显著正相关,r=0.983 8,P<0.01。

表3 各组细胞POLB、MRP-IR积分值
2.6 各组免疫斑点印迹薄层色谱扫描数值 POLB C组免疫斑点印迹薄层色谱扫描数值为109,Br组为72,Q组为25,(Br+Q)组为34;MRP C组免疫斑点印迹薄层色谱扫描数值为111,Br组为37,Q组为30,(Br+Q)组为54。
3 讨 论
Bcl-2位于线粒体膜内层,可防止线粒体膜的非特异性渗透而提高ADP/ATP的交换[1]。前凋亡(pro-apoptotic)的Bax蛋白是Bcl-2家族成员之一,通过同源或异源二聚体调控线粒体功能和调控细胞凋亡。Bax·Bcl-2异二聚体抑制细胞凋亡,而Bax·Bax同源二聚体则促进细胞凋亡[2-5]。有报道Bcl-2/Bax的比例可预示急性髓性白血病(AML)预后的结果[2]。本实验观察到Eca-109对照组细胞Bcl-2-IR/Bax-IR的比值高约为4.3,在应用Br、Q或(Br+Q)处理后其比值下降分别为1.1、1.0和1.1,表明Bcl-2-IR/Bax-IR比值下降的改变可导致细胞凋亡。XRCC1是DNA修复蛋白,是DNA polβ聚合酶的异二聚体蛋白,对DNA单链断裂损伤具有修复作用,修复蛋白覆盖于DNA损伤处,可防止核酸酶的消化而具有抗细胞凋亡作用。本实验中XRCC1-IR与Bcl-2-IR呈显著正相关,二者与Bax-IR皆呈显著负相关,这结果进一步表明XRCC1具有抗细胞凋亡作用,与Guo等[5]检测正常肝和肝癌细胞的bax、bcl-2、bcl-XL的表达水平和相关性研究及这些凋亡相关蛋白对细胞凋亡的调节作用相似。本实验应用Br和Q联合诱导Eca-109细胞凋亡后bcl-2及XRCC1表达的下调,Bax表达的上调对该细胞凋亡起着调节作用;而且Br及Q的单独和联合用药对Bcl-2-IR、Bax-IR或XRCC1-IR的影响无统计学差异,但细胞凋亡率,有统计学差异。该结果提示植物类黄酮的中药与西药联合应用可能更具有临床应用意义。
药物耐药性在临床疗效上是一个重要因素,已知wtp53与细胞凋亡和耐药性密切相关,此外,调控蛋白如:Bcl-2和Bax等可能参与药物耐药性机制。有报道乳腺癌细胞系的凋亡与Bcl-2蛋白表达和Caspase-3活性有关,但与Bax和Bcl-Xs无关[6]。研究结果表明多药耐药性相关蛋白免疫反应性与Bcl-2-IR呈正相关,与Bax-IR呈负相关。提示:一方面Bcl-2与Bax可能皆参与Eca-109细胞的凋亡,另一方面前凋亡蛋白的Bax可能对8-Br-cAMP及槲皮素诱导凋亡药物的敏感性较高,细胞的MRP表达减低。相反,Bcl-2可能对促凋亡诱导药物的敏感性较低,有一定程度的耐药性而提高MRP的表达。POLB主要是DNA损伤中最常见的DNA单核苷酸的切除修复酶,当高表达时,则对基因毒性药物,如顺铂,敏感性降低而药物耐药性增高。有报道人卵巢癌细胞对顺铂耐药的细胞比不耐药的细胞POLB表达水平高3倍[7];结肠癌细胞对顺铂等药物耐药性比对照的POLB表达高2.5倍[8];类似报道也见于乳腺癌细胞[9]。本文结果表明 8-BrcAMP及槲皮素的联合用药可显著降低不加药的Eca-109细胞的POLB表达,同时也下调MDR表达。两者之间呈显著正相关,r=0.983 8,P<0.01。即降低了该细胞的药物耐药性,逆转肿瘤恶性。槲皮素和8-Br-cAMP可抑制癌细胞周期进展和增殖,提高药物敏感性,诱导食管癌细胞分化及凋亡,呈现不同信号转导途径的互补效应,提示其下调Eca-109细胞的增变基因表型。
[1]Belzacg AS,Vieira HL,Verrier F,et al.Bcl22 and Bax modulate adenine nucleotide translocase activity[J].Cancer Res,2003,63(2):541.
[2]Kanauchi H,Wada N,Clark OH,et al.Apoptosis regulatinggenes,bcl22 and bax,and human telomerase reverse transcriptase messenger RNA expression in adrenal tumors:possible and prognostic importance[J].Surgery,2002,132(6):1021.
[3]Thomas D,Yang H,Boffa DJ,et al.Proapoptotic Bax is hyperexpressed in isolated human islets compared with antiapoptotic Bcl22[J].Transplantation,2002,74(11):1489.
[4]Del Poeta G,Vendlttl A,Del Principe MI,et al.The amount of spontaneous apoptosis detected by bax/bcl22 ratio predicts outcome in acute myeloid leukemia(AML)[J].Blood,2003,102(2):2125.
[5]Guo XZ,Shao XD,Liu MP,et al.Effect of bax,bcl22 and bclxl on regulating apoptosis in tissues of normal liver and hepatocellular carcinoma.World J Gastroenterol,2002,8(6):1059.
[6]yang XK,Zheng F Chen JH,et al.Relationship between expression of apoptosis-associated proteins and caspase-3 activity in cisplatin-resistant human ovarian cancer cell line[J].Ai Zheng,2002,21(12):1288.
[7]Valentinis B,Zaffaroni N,Sturani E,et al.Detection of DNA polymerase beta gene expression by competitive polymerasechain reaction in human ovarian carcinoma cells[J].Anticancer Res,1993,13(1):125.
[8]Funato T,Tone T,Miyachi,et al.Detection of drug resistant genes cisplatin-resistant colon carcinoma cells[J].Rinsho Byori,1993,41(1):95.
[9]Raaphorst GP,Cybulski SE,Sobel R,et al.The response of human breast tumor cell line with altered polymerase beta levels to cisplatin and radiation[J].Anticancer Res,2001,21(3B):2079.

