颅内原发性恶性淋巴瘤18F-FDG PET/CT显像3例
刘 羽,尹吉林,王欣璐,欧阳习,周 峥,李金山
(中国人民解放军广州军区广州总医院核医学科,广东 广州 510010)
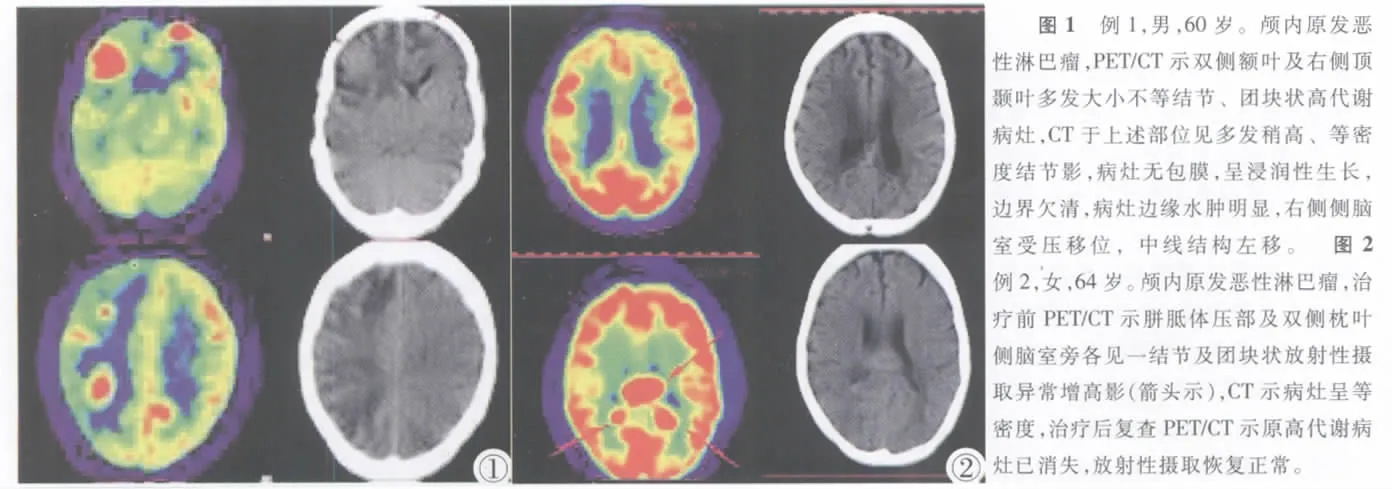
病例 例1,男,60岁。因头痛、言语不清3周余为主诉入院。间断性发热,抗炎后好转。血沉40.0s(0~15s),鳞状上皮细胞癌抗原升高2.3ug/L(0~1.5ug/L);细胞角蛋白抗原32.61(0~3.6)。胸片示双侧胸腔积液,以左侧明显。胸水穿刺未找到癌细胞及抗酸杆菌。曾行抗结核治疗两周余。18F-FDG PET/ CT显像:双侧额叶、右侧顶颞叶多发大小不等结节、团块状放射性摄取异常增高影,最大约5.8cm×4.2cm,SUV最大值为20.7,平均值为18.3,CT于上述部位见稍高密度结节影,CT值约35.6HU,边缘可见明显水肿带,右侧侧脑室受压移位,中线结构左移(图1)。手术:行脑内病灶全切术,术后病理诊断为原发性脑非霍奇金淋巴瘤(弥漫大B细胞型)。肺部及胸膜病灶穿刺活检病理:细菌性感染。近期随访情况:检查后经多疗程放化疗治疗,效果欠佳。
例2,女,64岁。以记忆力减退、失眠1个月为主诉入院。无头痛、呕吐,四肢活动正常。既往有系统性红斑狼疮病史数年,长期服用激素,症状基本控制;腰痛数年,2006年因“胸椎压缩性骨折”行椎体成形术。18F-FDG PET/CT显像:胼胝体压部及双侧枕叶侧脑室旁见多个结节及团块状放射性摄取增高影,最大约 1.9cm×3.3cmx2.0cm (压部),SUV最大值为21.0,平均值为16.4,CT于上述部位见软组织肿块影,CT值为 33.6HU。双侧顶叶脑白质见片状密度减低区,CT值18.1HU,放射性摄取未见异常增高。多处胸腰椎椎体变扁,部分胸椎放射性摄取增高,SUV最大值4.6,平均值2.4,余全身骨质密度普遍减低,透明度增大,骨皮质变薄,骨小梁减少变细,局部呈栅状排列,尤以脊柱各椎体及骨盆明显,放射性摄取未见明显异常(图2)。手术:行胼胝体肿物大部分切除,术后病理诊断为原发性脑非霍奇金氏淋巴瘤 (弥漫大B细胞型)。随后患者行放疗20次、化疗5程及脑部伽玛刀治疗。治疗16个月后18F-FDG PET/CT复查示原胼胝体压部及双侧枕叶侧脑室旁高代谢病灶已消失。近期情况随访:行腰椎椎管肿物切除,术后病理诊断为椎管非霍奇金弥漫大B细胞恶性淋巴瘤。现一直行中医药治疗,一般情况可。
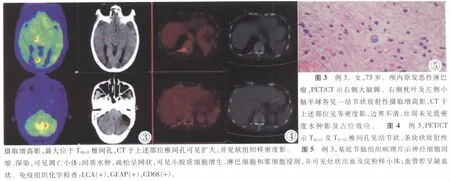
例3,女,73岁。以头晕、意识丧失20天为主诉入院。患者不规则发热,体温38°C~39°C(早期无发热,后期有发热)。脑脊液检查:压力360mmH2O,糖1.6,蛋白0.61;脑脊液细菌培养、墨汁染色查隐球菌及涂片查细菌均呈(-)。血常规:白细胞增高15×109/L,中性粒细胞正常55%,淋巴细胞偏低0.68×109/L。曾有激素治疗,但效果不佳,随后治疗1周后停用,改行抗痨治疗2周,病情仍未见好转。18F-FDG PET/CT显像:右侧大脑脚、右侧枕叶及左侧小脑半球各见一结节状放射性摄取增高影,最大位于右侧枕叶,大小约1.2cm×1.3cm× 1.2cm,SUV最大值为6.9,平均值为6.0,CT于上述部位见等密度影,边界不清,CT值为42.4HU,周围未见低密度水肿影及占位效应(图3);余脑部脑白质区密度弥漫减低,CT值为31.5HU,代谢弥漫性减低。脑沟、脑裂缩小、消失,脑回扩大;双侧基底节及丘脑肿胀,中线结构居中。另T10~11及T11~12椎间孔见结节状、条块状放射性摄取增高影,最大位于T10~11椎间孔,大小约0.9cm×2.0cm,SUV最大值为5.3,平均值为3.6,CT于上述部位椎间孔可见扩大,并见软组织样密度影 (图4),CT值为92.7HU;余未见明显异常。行立体定向颅内病变活检术,术后病理及免疫组化示:中枢神经系统非霍奇金(B细胞型)恶性淋巴瘤(图5),患者活检术后3天出现中枢性呼吸衰竭而死亡。
讨论 颅内原发恶性淋巴瘤(Intracranial primary malignant lymphoma,IPML)在颅内原发肿瘤中发病率低于2%[1],多认为IPML是原发于颅内血管周围的未分化多潜能间叶细胞。确切病因尚不清楚,绝大多数为B细胞源性非霍奇金淋巴瘤[2-4],大致可分为3种类型:脑实质型、脑膜型和脑室壁弥漫浸润型[5]。本瘤可以发生于颅内任何部位,有作者认为幕上多见,多见于大脑深部和中线结构[6-7],好发于基底神经节、胼胝体、脑室周围白质和小脑蚓部。IPML除在正常人群中散发外,尤其在免疫缺陷患者中更易发生。本病临床表现无特异性,依肿瘤所在部位而异,多以颅内高压征和局灶性体征首发。本病病程短(数天到半年左右),进展快,预后差,五年生存率低于10%。IPML有多发倾向,占“16%~44%”[8];其生长形式特点为多中心生长,即使是单发病灶也是多中心生长病灶的融合,导致与脑转移病灶在诊断上鉴别困难[9-10]。
本组3个病例共同的特点:①发病:以颅内病变为首发症状,且表现各异,无特殊性,均无癫痫发作史。②年龄及既往病史:发病年龄偏大(均60岁以上),其中例2伴有自身免疫性疾病(系统性红斑狼疮)。③部位:颅内病灶均为多发,分布无明显规律,范围广泛,自皮层至皮层下、脑室周围白质、胼胝体、大脑脚和小脑半球,以幕上多见;其中例2,3伴发椎管病变。④转移情况:原发病灶为颅内或伴发椎管病变,未见远处转移灶,有文献[10]提到颅内、椎管淋巴瘤极少向颅外转移,但对此现象尚无明确解释。⑤CT表现:颅内多发大小不一类圆形或不规则形等或稍高密度结节占位,密度致密,无明显囊变坏死,无钙化,呈浸润性生长,边缘欠清,病灶周围水肿程度不一,可有明显占位效应。⑥18F-FDG PET显像:颅内病灶代谢明显增高,其SUV最大值是正常脑皮质区的约1.5~3倍。高代谢灶周围皮质因脑水肿呈现代谢减低,其中例3 PET显示双侧大脑白质密度弥漫减低,代谢普遍不均匀下降,考虑为全脑水肿伴有脑白质弥漫性脱髓鞘改变。本病对糖皮质激素治疗非常敏感,单用其痊愈率为40%~80%,一般认为糖皮质激素有直接的细胞毒作用,可诱导淋巴瘤病灶痊愈,但使用激素治疗颅内淋巴瘤会导致脑水肿,造成诊断延误,所以应在激素治疗前进行病理学诊断[11-12]。
本组3例IPML患者均为原发性中枢神经系统非霍奇金恶性淋巴瘤,其中2例为弥漫大B细胞型,1例为B细胞型,其恶性程度较高,病灶对18F-FDG的摄取明显高于正常脑皮层,因此具有特征性;有文献分析认为[13]IPML病灶对18FFDG摄取程度明显高于胶质母细胞瘤和脑转移瘤,但同时病灶周围皮质脑水肿范围及代谢减低程度低于胶质母细胞瘤和脑转移瘤,本组3例与文献报道相符合。另外我们还观察到病灶周围是否水肿与发病的部位有关系,位于基底节、丘脑区域的淋巴瘤病灶的周围组织未见明显水肿,而位于皮质区病灶周围可出现脑水肿,呈现轻度或中度代谢减低。
鉴别诊断要考虑以下病变:①转移瘤:一般能找到原发肿瘤灶,肿瘤通常为血行转移,常发生于皮层下大脑前、中、后动脉皮质的远端,而淋巴瘤则以深部和大脑皮层的大脑前、中、后动脉皮质入脑后的近端最为常见[14];大多数颅内转移瘤位于灰白质交界处,CT平扫多为低密度,有明显的瘤周水肿及占位效应,常为“小结节大水肿”表现,部分病灶因中心坏死增强后扫描呈环形或不均匀强化,代谢增高程度不及IPML。②胶质瘤:恶性胶质瘤密度多不均匀,肿瘤常见坏死囊变,囊变区通常较大,不规则,肿瘤边界不清,呈分叶状非均质性,占位征象多较严重,瘤周水肿明显;某些类型胶质瘤如少枝胶质细胞瘤可有钙化斑,胶质母细胞瘤强化多不规则,而淋巴瘤密度多均匀致密,囊变坏死及钙化少见且瘤周水肿及占位效应较轻,强化多较均匀,而且易侵犯室管膜,对18FFDG摄取程度明显高于恶性胶质瘤。③位于脑表面的颅内原发恶性淋巴瘤须与脑膜瘤相鉴别,脑膜瘤以广基底与脑膜相连,多位于脑表面或颅底近脑膜处,有皮质受压,出现脑白质移位征和脑膜尾征,相邻颅板增厚,肿瘤有假包膜征;典型脑膜瘤的MRI表现为等T1、等T2信号;脑膜瘤血管造影可见肿瘤染色,而淋巴瘤侵及脑膜时也可出现脑膜尾征,但无脑皮质受压征,血管造影多表现为乏血管特征;良性脑膜瘤对18FFDG基本无或轻度摄取,而淋巴瘤则呈明显高代谢。④感染性病变:如脑脓肿可出现环状强化,呈环状18F-FDG高摄取,根据感染病史和典型脓肿形成的期龄相鉴别,发病年龄相对年轻,部分有发热病史,抗炎治疗有效。⑤多发性硬化。好发于成年女性,临床症状和体征多样,常有缓解和复发交替出现,病灶多位于侧脑室周围、深部白质区,呈长T1长T2信号,急性期病灶可完全强化。矢状面可见病灶垂直于侧脑室,即“直角脱髓鞘征”,较具有特征性。
总之,虽然IPML的临床及影像学表现复杂多样,缺乏特异性,与胶质母细胞瘤、转移瘤等鉴别困难,诊断准确性不高,但仍可根据上述的一些临床及影像特点,尤其是从18FFDG代谢明显增高的特点来分析考虑,提供对IPML进行定性诊断和鉴别诊断的可能性。
[1]Bataille B,Delwall V,Menet E,et al.Primary intracerebral malignant lymphoma:report of 248 cases[J].J Neruosurg,2000,92: 161-166.
[2]朴京虎,张建宁,杨树原.原发性颅内恶性淋巴瘤[J].实用医学杂志,1999,15:423-424.
[3]耿承军,陈君坤,卢光明,等.原发性中枢神经系统淋巴瘤的CT、MRI表现与病理对照研究 [J].中华放射学杂志,2003,37:246-250.
[4]成克伦.脑原发性恶性淋巴瘤临床病理分析[J].肿瘤研究与临床,2004,16:163-165.
[5]刘复生,刘彤华.肿瘤病理学[M].北京:北京医科大学中国协和医科大学联合出版社,1997.1979-1980.
[6]陈长青,陈晨,陈常勇,等.原发性脑内恶性淋巴瘤的CT、MRI诊断[J].临床放射学杂志,2004,23:283-286.
[7]杨天和,林建中,王月琴.颅内原发恶性淋巴瘤的MRI诊断(附12例报告)[J].实用放射学杂志,2004,20:972-974.
[8]Gumerlock MK.Recognition and management of centralnervous system lymphoma[J].Contemporary Neurosurgery,1990,12:1-7.
[9]刘一平,易自生,郭文彬.原发性颅内淋巴瘤的MRI诊断[J].东南国防医学,2006,8:93-94.
[10]李明洙,罗力,高乃康,等.原发性颅内淋巴瘤分型及治疗[J].中华神经外科杂志,2006,22:259-260.
[11]耿少梅,焦保华,孙晓枫.原发性颅内恶性淋巴瘤的临床特点及影像学诊断[J].中华神经医学杂志,2004,3(3):188-190.
[12]李兆元,黄秋华,方珊珊,等.原发性颅内淋巴瘤13例分析[J].中国误诊学杂志,2007,7(3):612.
[13]李德鹏,马云川,苏玉盛,等.10例颅内原发性恶性淋巴瘤18FFDG PET显像及与MRI比较 [J].中华核医学杂志,2007,27:257-259.
[14]石木兰.肿瘤影像学[M].北京:科学出版社,2003.1;33.

