黑龙江省和吉林省马铃薯晚疫病菌multi-locus基因型分析
张铉哲,徐生军
(东北农业大学农学院,黑龙江 哈尔滨 150030)
由卵菌致病疫霉[Phytophthora infestans(Mont.) de Bary]引起的马铃薯晚疫病是马铃薯生产中最严重的病害之一[1],在我国各地均有发生。到 1980年为止,只有墨西哥中部同时存在A1和A2两种交配型[2],除墨西哥以外的其它地区只发生A1交配型,因此世界各地的病菌群体组成比较单一。然而1984年在瑞士首次发现A2交配型后[3],在世界各地陆续出现了A2交配型。在国内,1996年张志铭等[4]首次报道了在内蒙发现A2交配型,之后在我国各马铃薯主产区陆续报道了A2交配型的存在。据Goodwin等[5]的报道,由于有性生殖的出现,太平洋沿岸晚疫病菌的种群发生了显著变异。因为P.infestans的线粒体DNA多态性是容易测定而且单亲本遗传的,所以它广泛利用于鉴定病原菌群体的遗传多态性研究[6]。Ghimire等[7]在尼泊尔通过交配型、RG57指纹和mtDNA单倍型的分析发现了11种新基因型。在韩国,Zhang等[8]利用3种分子标记测定了P.infestans的遗传多样性,并发现了4种同工酶基因型,一种线粒体DNA单倍型(Ⅱa)和8个RAPD类群。Gotoh等[9]通过RG 57指纹,mtDNA单倍型,两种Allozyme基因型和交配型的分析,在日本发现了4种新的基因型。Zwankhuizen等[10]报道 1993~1996年在荷兰分离的1 048个菌株中发现了170个新遗传型,其中 138个是很罕见的。在中国,赵志坚等[11]利用线粒体DNA单倍型测定了 P.infestans菌株的遗传多样性。Zhu等[12]用筛选出的10个RAPD随机引物对1997~2001年间采自我国9省市的82株及3株来自日本的致病疫霉DNA进行了PCR扩增,得出RAPD组群与菌株的地理来源、交配型及对瑞毒霉的敏感性无明显相关性。
上述研究说明,在中国缺乏对晚疫病菌multilocus基因型的分析,因此本研究利用交配型、瑞毒霉敏感性、同工酶基因型和线粒体DNA单倍型系统分析黑龙江省和吉林省分离的马铃薯晚疫病菌的表现型和基因型。
1 材料与方法
1.1 供试培养基
番茄培养基:800 mL蒸馏水,200 mL番茄汁,20 g琼脂,4.5 g碳酸钙。
选择性培养基:番茄培养基+(氨苄青霉素500 mg·L-1,利福平50 mg·L-1,万古霉素200 mg·L-1,匹马霉素 100 mg·L-1,PCNB 35 mg·L-1,苯菌灵10 mg·L-1)。
1.2 病原菌分离
2006~2008年,在吉林省龙井市和黑龙江省的各马铃薯主产区采集具有单病斑的马铃薯病叶。为了病原菌分离,首先把病叶背面朝上放置在灭菌的培养皿,然后其上面再放0.5 cm厚的薯片。封盖后将培养皿放在22℃黑暗培养箱内,培养3~5d后将从薯片上长出来的菌丝转移到选择性培养基。
1.3 交配型和瑞毒霉敏感性分析
为了测定交配型的分布,利用已知交配型的标准菌株DN-3085(日本,A1)和BC-3(韩国,A2)。首先把未知交配型菌株的菌饼(直径为7 mm)放在番茄汁琼脂培养基中央,然后两边以3 cm距离放DN-3085(A1)和BC-3(A2)的菌饼(直径为7 mm)。封盖后将培养皿放在22℃,黑暗培养箱内,培养10~15 d。用显微镜检查两菌落交界处是否有卵孢子。本试验中利用Zhang等[13]的方法测定马铃薯晚疫病菌对瑞毒霉的敏感性。
1.4 同工酶基因型分析
为了分析2006~2008年分离的马铃薯晚疫病菌菌株的同工酶基因型,利用两个同工酶位点6-磷酸葡萄糖异构酶(Gpi)和肽酶(Pep)。利用纤维素醋酸盐电泳测定同工酶基因型[9]。同工酶分析的菌丝利用番茄培养基培养,菌丝装入1.5 mL微量离心管中,加入液氮冷冻后用研磨棒研碎,然后加入100μL灭菌去离子水,在4℃下13000rpm·min-1离心5 min,上清液就是酶液。利用 Goodwin等[5]报道的方法进行Gpi和Pep电泳。利用琼脂覆盖法完成同工酶Gpi和Pep的染色。
1.5 基因组DNA提取
利用番茄液体培养基培养2006~2008年分离的马铃薯晚疫病菌菌株获得菌丝,菌丝保存在-80℃冰箱。采用Goodwin等[14]报道的方法,微作改动,提取马铃薯晚疫病菌基因组DNA。
1.6 线粒体DNA(mtDNA)单倍型分析
利用Griffith和Shaw[15]报道的PCR-RFLP方法测定马铃薯晚疫病菌mtDNA单倍型,并设计4对引物组合(表1)。PCR扩增反应物由200 μM的各种dNTP,0.34 mM引物,1×缓冲液(20 mM KCl,20 mM Tris-HCl,pH 8.4,2 mM MgCl2,10 mM(NH4)2SO4,0.5 μL(1 U)的Taq DNA polymerase和20 ng的基因组DNA,最终把扩增反应物容量调至25 μL。PCR扩增程序为:94℃预变性90 s,94℃变性40 s,55℃退火60 s,72℃延伸90 s,40个循环,最终72℃下延伸120s。利用3种内切酶CfoⅠ、MspⅠ和EcoRⅠ把5 μL的扩增DNA切断4 h以上(37℃条件下)。

表1 试验中用于马铃薯晚疫病菌线粒体DNA单倍型测定的寡核苷酸引物Table 1 Oligonucleotide primers used to investigate mitochondrial DNA haplotypes of Phytophthors infestans
2 结果与分析
2.1 马铃薯晚疫病菌交配型和瑞毒霉抗药性的分析
从2006年到2008年在黑龙江省和吉林省共分离了99个马铃薯晚疫病菌,其中2006年和2008年在黑龙江省哈尔滨市、齐齐哈尔市、牡丹江市和佳木斯市共分离了83个菌株,2007年在吉林省龙井市分离了16个菌株(表2)。
为了表明本试验中使用的马铃薯晚疫病菌的生物学特性,分析了交配型和瑞毒霉敏感性。交配型的测定结果显示本试验中所使用的99个菌株是A1交配型,说明A1菌株是黑龙江省和吉林省存在的优势交配型。瑞毒霉敏感性测定结果显示14个菌株是敏感性菌株(14.1%),7个菌株是中抗菌株(7.1%),78个菌株是抗性菌株(78.8%)(表2)。其中黑龙江省分离的菌株,瑞毒霉敏感性测定结果显示11株(13.3%)敏感性菌株,2株(2.4%)中抗菌株,其余70株(84.3%)是抗性菌株,而吉林省分离菌株的瑞毒霉敏感性测定结果,敏感性菌株、中抗菌株和抗性菌株分别是3(18.8%)、5(31.2%)和8(50.0%)。以上结果显示,黑龙江省发生的马铃薯晚疫病菌的瑞毒霉抗性明显高于吉林省发生的菌株。
2.2 晚疫病菌同工酶基因型和mtDNA单倍型分析
为了分析马铃薯晚疫病菌的同工酶基因型,本研究使用了2006~2008年从不同地区分离的99个菌株。
同工酶基因型的测定结果显示99个致病疫霉菌株Gpi和Pep同工酶基因型谱带为100/100、96/96;100/100、96/100;100/100、100/100三种类型,分别占被测菌株的3.0%、1.0%和96.0%。在Gpi位点上只发现1种基因型,而Pep位点上发现多种基因型,说明在Gpi位点是纯合的。2006年在黑龙江省采集的马铃薯晚疫病菌株的Gpi和Pep同工酶基因型谱带为100/100、100/100;2007年在吉林省分离的马铃薯晚疫病菌株的Gpi和Pep同工酶基因型谱带为100/100、96/96和100/100、100/100,分别占2007年被测菌株的6.2%和93.8%;2008年在黑龙江省采集的马铃薯晚疫病菌株的Gpi和Pep同工酶基因型谱带为100/100、96/96,100/100、96/100和100/100、100/100,分别占2008年被测菌株的3.1%、1.6%和95.3%。在所有采集地区都发现了同工酶基因型100/100、100/100,表明该基因型是黑龙江省和吉林省普遍存在的优势同工酶基因型。通过比较2006年和2008年采自黑龙江省马铃薯晚疫病菌的Gpi和Pep同工酶基因型,基因型逐步增加,表明在黑龙江省出现了“新”的基因型(表3)。
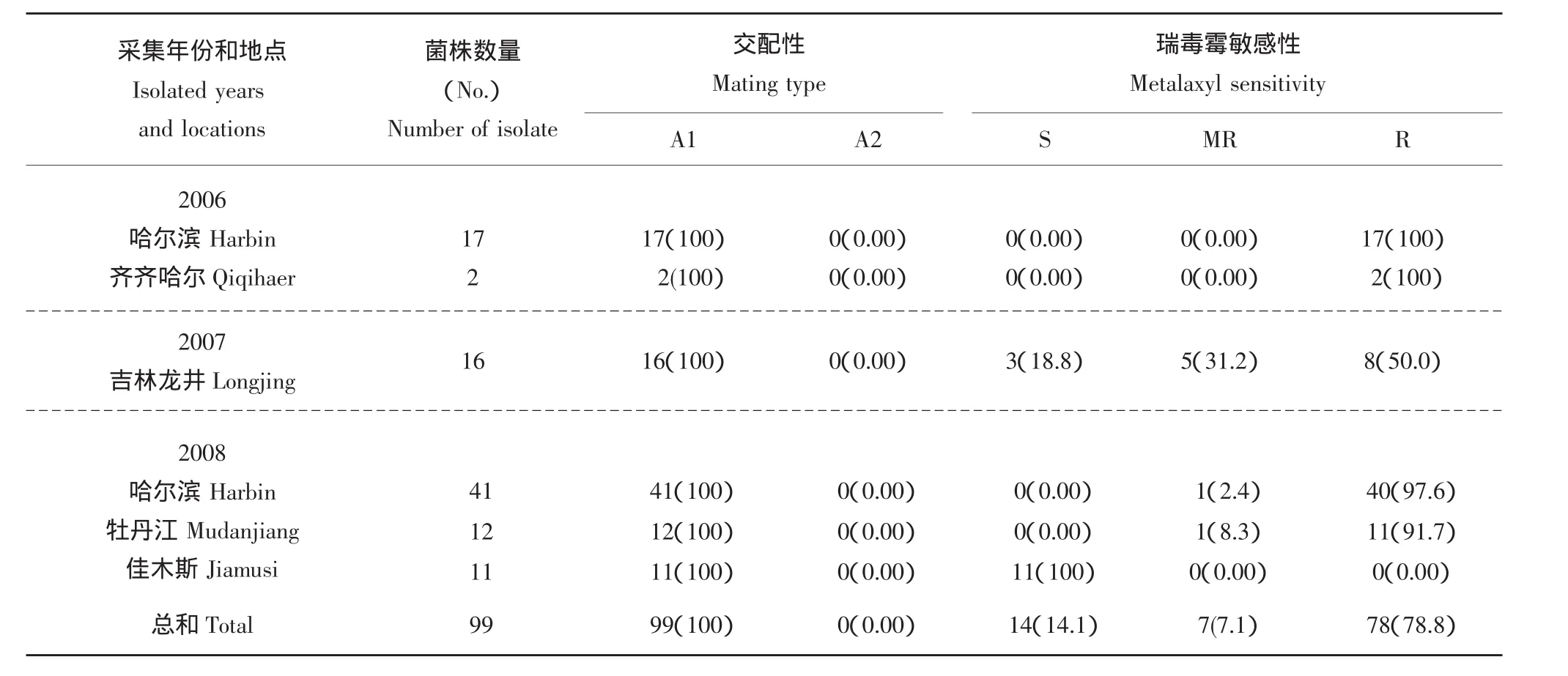
表2 2006~2008年在黑龙江省和吉林省分离的马铃薯晚疫病菌的交配型和瑞毒霉敏感性的分析Table 2 The analysis of mating types and metalaxyl sensitivity of Phytophthora infestans isolates collected in Heilongjiang and Jilin Provinces from 2006 to 2008.
本试验利用三种内切酶和四种引物组合分析了99个马铃薯晚疫病菌的线粒体DNA基因型(图1)。利用MspⅠ与P2引物组合和EcoRⅠ与P4引物组合分析了101个马铃薯晚疫病菌(包括2株标准菌株DN 3085的单游动孢子菌系:Ⅰb单倍型)的线粒体DNA单倍型。结果显示所测定的99个菌株中共发现2种mtDNA单倍型,其中佳木斯分离的11个菌株是Ⅰa单倍型,吉林省龙井市、黑龙江省的哈尔滨市、牡丹江市和齐齐哈尔市分离的马铃薯晚疫病菌都显示为Ⅱa单倍型(表3)。Ⅰa单倍型是在黑龙江省首次发现的新基因型。Ⅱa单倍型菌株是黑龙江省和吉林省存在的优势线粒体DNA单倍型。
2.3 马铃薯晚疫病菌的multi-locus基因型分析
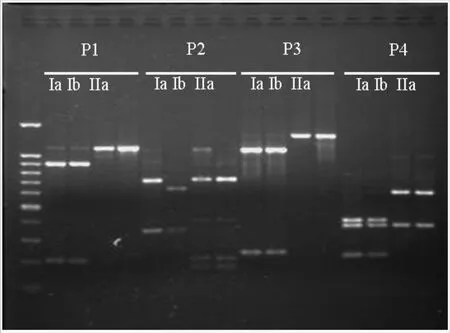
图1 利用3种内切酶(CfoⅠ,MspⅠ,EcoRⅠ)分别酶切由4种引物[F1-R1(P1),F2-R2(P2),F3-R3(P3),F4-R4(P4)]组合扩增后产生的线粒体DNA单倍型的图谱Figure 1 Restriction enzyme digestion patterns of PCR products amplified from the DNA of Phytophthora infestans with the primer pairs of F1-R1(P1,cut with Cfo I),F2-R2(P2, cut with Msp I),F3-R3(P3,cut with EcoR I)and F4-R4(P4, cut with EcoR I).Amplifications were conducted with DNA from isolates representing each of the three mitochondrial DNA haplotypes(Ⅰa,Ⅰb andⅡa).Among the mtDNA haplotypes produced with each primer pair,left isⅠa haplotype,middle isⅠb haplotype and right isⅡa haplotype.

表3 2006~2008年在黑龙江省和吉林省分离的马铃薯晚疫病菌的同工酶基因型和线粒体DNA单倍型的分析Table 3 The analysis of allozyme genotypes and mitochondrial DNA haplotypes of Phytophthora infestans isolates collected in Heilongjiang and Jilin Provinces from 2006 to 2008
根据交配型、同工酶基因型和mtDNA单倍型,2006~2008年分离的菌株中发现了7种基因型,其中优势基因型是A(84.9%)。而基因型C和D只发生在单一地区(表4)。2006年和2008年哈尔滨市分离的58个菌株中共出现了2种基因型,其中优势基因型是A(96.6%)。2008年牡丹江市分离的12个菌株中共出现了2种基因型,其中优势基因型是A(91.7%)。2006年齐齐哈尔市分离的2个菌株中出现了1种基因型(A)。2008年佳木斯市分离的11个菌株中共发现了1种基因型(D)。2007年吉林省龙井市分离的16个菌株中共发现了2种基因型,其中优势基因型是A(93.8%)。黑龙江省分离的83个菌株中共发现了4种基因型,其中哈尔滨市和牡丹江市分离了2种基因型,反而在齐齐哈尔市和佳木斯市只发现了1种基因型。
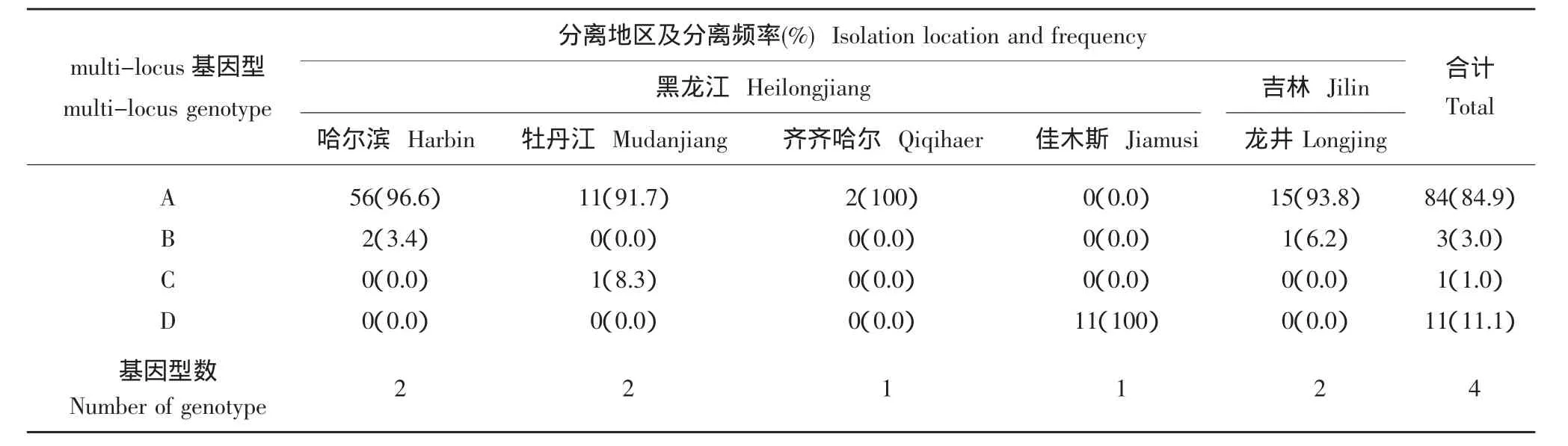
表4 2006~2008年在黑龙江省和吉林省分离的马铃薯晚疫病菌中基因型与分离地区之间相互关系Table 4 The correlation between multi-locus genotypes and isolated locations among the Phytophthora infestans isolates collected from Heilongjiang and Jilin Provinces from 2006 to 2008
3 讨论
3.1 马铃薯晚疫病菌的交配型分布和瑞毒霉敏感性
1996年张志铭等[4]首次报道了在内蒙发现A2交配型,之后朱杰华等[16]在黑龙江省发现了A2交配型。通过对黑龙江省和吉林省2006~2008年分离纯化出来的99个晚疫病菌株的交配型鉴定结果显示,黑龙江省和吉林省还未出现马铃薯晚疫病菌A2交配型,这与朱小琼等[17]和金光辉等[18]的报道一致。
瑞毒霉在我国马铃薯晚疫病防治方面用药历史较长,因用药水平、采样地点及年份的差异,目前在中国各省份均已检测到不同频率的瑞毒霉抗性菌株[19],表明中国马铃薯主产区的晚疫病菌对瑞毒霉产生了严重的抗药性。在黑龙江省和吉林省检测到78.8%的抗性菌株,因此瑞毒霉在这些地区继续使用只会对病菌群体造成药剂选择压力,导致瑞毒霉敏感群体越来越少,而抗性群体会急剧上升。
3.2 马铃薯晚疫病菌的同工酶基因型和线粒体DNA单倍型分析
目前为止,利用Gpi酶发现了14种马铃薯晚疫病菌的allozyme基因型[20]。本试验对2006~2008年黑龙江省和吉林省分离的马铃薯晚疫病菌同工酶基因型表明Gpi和Pep基因型逐渐多样化(表3)。在所有采集地区主要存在1种同工酶基因型(100/100,100/ 100),这说明Gpi:100/100基因型逐步代替了Gpi:86/100基因型。
Griffith和Shaw[15]的研究结果表明,当用MspⅠ酶切由P2引物组合扩增的基因组DNA时,Ⅰa和Ⅱb单倍型有相同的基因片段,不能区分Ⅰa和Ⅱb单倍型;但用EcoRⅠ酶切由P4引物组合扩增的基因组 DNA能区分Ⅰa和Ⅱb单倍型。因此,本试验为更好分析马铃薯晚疫病菌的线粒体DNA使用MspⅠ与P 2和EcoRⅠ与P 4引物组合(图1)。由于致病疫霉mtDNA是单亲本遗传,使得它成为研究致病疫霉起源进化以及系统发育的理想研究对象。一些研究认为,Ⅰb代表致病疫霉群体在第一次全球迁移之前广泛分布的与US-1无性繁殖谱系密切相关的“旧”群体,而Ⅰa、Ⅱa和Ⅱb则为第一次全球迁移发生后在墨西哥以外出现的“新”群体[1-2,14]。本试验中,除来自日本的标准菌株为Ⅰb线粒体DNA单倍型外,采自黑龙江省和吉林省马铃薯晚疫病菌的99个菌株分别是Ⅰa和Ⅱa。2006~2008年黑龙江省和吉林省占主导地位的Ⅱa基因型逐渐被Ⅰa基因型代替。这个结果类似于赵志坚等[11]介绍的云南省分离的马铃薯晚疫病菌中Ⅰa基因型逐渐代替Ⅱa基因型的结果,尽管两者在群体中的分布差异显著,但均属于“新”群体,表明致病疫霉“新”群体已成功地替代了“旧”群体,成为黑龙江省和吉林省马铃薯产区的主导者,这与Akino等[21]报道的中国甘肃和河北马铃薯致病疫霉mtDNA单倍型的结果一致。
3.3 马铃薯晚疫病菌的multi-locus基因型分析
马铃薯晚疫病菌的multi-locus基因型分析通常使用交配型、同工酶基因型、mtDNA单倍型和RG 57指纹图谱。Spielman等[22]报道无性繁殖系菌株的基因型聚类分析能区别“旧”和“新”的基因型。本试验利用交配型、同工酶基因型和mtDNA单倍型发现了4种multi-locus基因型,没有发现“旧”基因型US-1[20]。这些multi-locus基因型在交配型、同工酶基因型、mtDNA单倍型和RG 57指纹图谱特性上不同于波兰[23],美国[24]发现的基因型,但此结果在同工酶基因型和mtDNA单倍型上类似于与Sujkowski等[23]和Zhang等[8]报道的新基因型(Gpi:100/100, Pep:100/100,Ⅱa)逐步代替“旧”基因型(Gpi:86/ 100,Pep:92/100,Ⅰb)的结果。这说明马铃薯晚疫病菌“新”基因型已成功地替代了“旧”基因型,成为黑龙江省和吉林省马铃薯产区的主导者。
[1]Fry W E,Goodwin S B.Re-emergence of potato and tomato late blight in the United States[J].Plant Disease,1997,81(12)1349-1357.
[2] Fry W E,Goodwin S B,Dyer A T,et al.Historical and recent migration of Phytophthora infestans:chronology,pathway,and implications[J].Plant Disease,1993,77:653-661.
[3] Hohl H R,Iselin K.Strains of Phytophthora infestans from Switzerland with A2 mating type behaviour[J].Transactions of the British Mycological Society,1984,83:529-530.
[4]张志铭,李玉琴,田世民,等.中国发生马铃薯晚疫病菌A2交配型[J].河北农业大学学报,1996,19:62-66.
[5] Goodwin.S B,Schneider.R E,Fry W E.Use of cellulose acetate electrophoresis for rapid identification of allozyme genotypes of Phytophthora infestans[J].Plant Disease,1995,79:1181-1185.
[6]Avila-Adame C,Gomez-Alpizar L,Zismann V,et al.Mitochondrial genome sequences and molecular evolution of the Irish potato famine pathogen,Phytophthora infestans[J].Curr Genet, 2006,49:39-46.
[7] Ghimire S R,Hyde K D,Hodgkiss I J,et al.Variations in the Phytophthora infestans population in Nepal as revealed by nuclear and mitochondrial DNA polymorphisms[J].Phytopathology,2003,93 (2):236-243.
[8] Zhang X Z,Kim H Y,Kim B S.Analysis of genetic diversity of Phytophthora infestans in Korea by using molecular markers[J]. J Microbiol Biotechnol,2006,16:423-430.
[9] Gotoh K,Akino S,Kato M,et al.New multilocus genotypes of Phytophthora infestans in Japan[J].J Gen Plant Pathology,2007, 73(5):349-352.
[10] Zwankhuizen M J,Govers F,Zadoks J C.Inoculum sources and genotypic diversity of Phytophthora infestans in Southern Flevoland, The Netherlands[J].European Journal of Plant Pathology,2000, 106(7):667-680.
[11] 赵志坚,李先平,李成云,等.致病疫霉线粒体DNA单倍型分子鉴别[J].云南农业大学学报,2002,17:434-435.
[12] Zhu X Q,Wang Y H,Guo L Y.Genetic diversity revealed by RAPD analysis among isolates of Phytophthora infestans from different locations in China[J].Acta Phytopathologica Sinaca, 2006,36(3):249-258.
[13] Zhang X Z,Ryu K Y,Kim J S.Changes in the sensitivity to Metalaxyl,Dimethomorph and Ethaboxam ofPhytophthora infestans in Korea[J].Plant Pathol J,2005,21(1):33-38.
[14] Goodwin S B,Drenth B A,Fry W E.Cloning and genetic analysis of two highly polymorphic moderately repetitive nuclear DNAs from Phytophthora infestans[J].Curr Genet,1992,22:107-155.
[15] Griffith G W,Shaw D S.Polymorphism in Phytophthora infestans: four mitochondrial haplotypes are detected after PCR amplification of DNA from pure culture or from host lesions[J].Appl Environ Microbiol,1998,64:4007-4014.
[16] 朱杰华,张志铭,李玉琴.马铃薯晚疫病菌(Phytophthora infestans)A2交配型的分布[J].植物病理学报,2000,30:375.
[17]朱小琼,车兴璧,国立耘,等.六省市致病疫霉交配型及其对几种杀菌剂的敏感性[J].植物保护,2004,30(4):20-23
[18] 金光辉,白雅梅,孙秀梅,等.黑龙江省马铃薯晚疫病菌A2交配型的测定[J].中国马铃薯,2006,20(4):212-214
[19] 王英华,国立耘,梁德霖,等.马铃薯晚疫病菌在内蒙古和甘肃的交配型分布及对几种杀菌剂的敏感性[J].中国农业大学学报,2003,8(1):78-82
[20] Forbes G A,Goodwin S B,Drenth A,et al.A global marker database for Phytophthora infestans[J].Plant Disease,1998,82: 811-818.
[21] Akino S,Gotoh K,Nishimura R,et al.Comparison of Chinese and Japanese A1 isolates of Phvtophthora infestans[J].Journal of General Plant Pathology,2004,70:212-214.
[22] Spielman L J,Drenth A,Davidse L C,et al.A second worldwide migration and population displacement of Phytophthora infestans[J].Plant Pathology,1991,40:422-430.
[23] Sujkowski L S,Goodwin S B,Dyer A T,et al.Increased genotypic diversity via migration and possible occurrence of sexual reproduction of Phytophthora infestans in Poland[J]. Phytopathology,1994,84:201-207.
[24] Goodwin S B,Smart C D,Sandrock R W,et al.Genetic change within populations of Phytophthora infestans in the United States and Canada during 1994 to 1996:role of migration and recombination[J].Phyropathology,1998,88:939-949.

