牛乳中氨苄青霉素残留的受体分析法测定
孙永海,张 杰,韩 勇,李倬琳,李铁柱,*
(1.吉林大学生物与农业工程学院,吉林 长春 130025;2.吉林省农业科学院农产品加工研究中心,吉林 长春 130124;3.中国国际工程咨询公司,北京 100048)
牛乳中氨苄青霉素残留的受体分析法测定
孙永海1,张 杰2,韩 勇3,李倬琳2,李铁柱2,*
(1.吉林大学生物与农业工程学院,吉林 长春 130025;2.吉林省农业科学院农产品加工研究中心,吉林 长春 130124;3.中国国际工程咨询公司,北京 100048)
建立基于受体识别技术检测牛乳青霉素类抗生素残留的新方法。通过生物技术制备与青霉素类抗生素具有高度亲和力的受体蛋白质,进而以其为识别元件开发间接竞争氨苄青霉素残留检测方法。青霉素受体包被质量浓度5μg/mL,生物素化氨苄青霉素质量浓度500ng/mL条件下,对其残留量进行测定,检出限为2μg/kg,有较好的精密度及回收率。在样品中残留的青霉素种类已知的前题下(以氨苄青霉素为例),本方法可以作为定量筛选方法。
牛乳;氨苄青霉素;受体分析;生物素;亲和素
青霉素G、阿莫西林、氨苄青霉素、头孢菌素、邻氯青霉素等具有β-内酰胺环的抗生素在奶牛养殖业中常用于医治奶牛的乳腺炎,尤其是氨苄青霉素,由于其广谱并廉价因此被大量地使用,且被频繁地以超剂量使用,由此导致牛乳中含有高浓度氨苄青霉素的残留问题[1]。虽然青霉素类药物本身对机体没有很强的毒性,但是青霉素类药物会使一些个体产生十分剧烈的过敏反应[2-3]。如果长期摄入含有抗生素的牛乳会使人体肠道内的正常菌群受到抑制,从而导致致病菌、条件致病菌大量繁殖引起全身或局部的感染[4]。经常食用抗生素残留的食品还会使人体产生以抗生素为营养源的超级细菌,当这些细菌引起感染性疾病时,就会给临床治疗带来巨大的困难[5]。另外,从乳品加工的角度看,原料乳中抗生素残留物严重干扰发酵乳制品的生产,抗生素可严重影响干酪、黄油、发酵乳的起酵和后期风味的形成[6]。
因此,许多国家对牛乳中的青霉素类药物尤其是氨苄青霉素残留的管理十分严格,欧盟规定的氨苄青霉素在牛乳中的限量为4μg/kg[7]。我国对乳制品中的青霉素残留也日益重视,农业部新近出台的《生鲜牛乳收购标准》修订版也将青霉素残留列为强制性必测项目,最大残留限量规定为4μg/kg[8]。常用的青霉素残留检测筛选方法大体分为微生物生长抑制法和受体吸附法。微生物生长抑制法具有操作简便,低成本的优势,但是它也具有不能定量、特异性差、易假阳性的缺点,不能完全满足青霉素残留检测的需要[9-10]。受体吸附法却一种可以定量,专一性强,灵敏度高,自动化程度高的检测方法,但是在我国起步较晚,实际应用主要依赖进口试剂盒[11]。
将青霉素受体PBP 2x[12]包被于微孔板,首先加入待测乳样,使其中所含氨苄青霉素与PBP 2x的青霉素结合位点的非竞争性结合;然后加入生物素标记的氨苄青霉素与剩余的PBP 2x青霉素结合位点结合生成PBP 2x-生物素-氨苄青霉素复合物,进而应用辣根过氧化物酶标记的亲和素检测此复合物,旨在建立生物素-亲和素放大体系结合受体分析法检测牛乳中氨苄青霉素残留的新方法。
1 材料与方法
1.1 材料、试剂与仪器
肺炎链球菌D39由中山大学医学院吴忠道教授惠赠;pGEX-6P-1由吉林大学生命科学学院金英花教授惠赠;其余质粒及菌种均为本室保存。
各种限制性内切酶、连接酶 大连宝生物工程公司。Taq酶、dNTP、IPTG(异丙基-β-D-硫代半乳糖苷) 鼎国生物工程公司;PCR引物由鼎国生物工程公司合成并经PAGE纯化;Glutathione-Sepharose 4B亲和柱、Sephacryl S 100 Pharmacia公司;氨苄青霉素、四环素、DNA及蛋白质分子质量标准、四甲基联苯胺(TMB) Sigma公司;生物素、辣根过氧化物酶标记亲和素 北京博奥森公司;其他试剂为分析纯。
Multiskan Ascent V1.24 酶标仪 芬兰雷勃公司。
1.2 方法
1.2.1 表达质粒的构建
各种基因工程基本操作均参考文献[13]中有关章节,按常规方法进行。PCR扩增体系为50μL,包括:10× Taq plusI DNA 聚合酶缓冲液5μL,dNTP(10μmol/L) 1μL,5'端引物(10μmol/L)0.5μL,3'端引物(10μmol/L) 0.5μL,TaqDNA聚合酶(4U/μL)0.5μL,模板 cDNA 2μL,加水补充总体积至 50μL。PCR反应条件为:94℃变性1min,60℃退火45s,72℃延伸45s,30个循环后72℃保温10min。PCR反应产物以冻融法回收,首先被克隆进pGEM-T 载体,并且插入含有纠错DNA序列然后再进一步克隆进 pGEX-6P-1。DNA序列由上海生工生物工程技术服务有限公司测定。
1.2.2 青霉素受体的表达与纯化
本研究PBP2x重组融合蛋白表达纯化方法对Cacciatore等[14]报道的方法做部分改进。具体方法如下:原核表达载体质粒pGEX-tet-PBP 2x转化大肠杆菌BL 21,挑取转化的单菌落,接种10mL YTY培养基中(16g胰蛋白胨、10g酵母膏、5gNaCl和15mg四环素/L)于37℃ 220r/min培养过夜,过夜培养物转接100mL YTY培养液,37℃剧烈振荡培养 1~2h,加入IPTG诱导 4~6h,4℃、6000r/min离心15min收获菌体。菌体重悬于PBS(10mL/g)湿菌体,置冰浴中,温和超声破碎细胞。加入Triton X-100至体积分数1%,室温条件下缓慢搅拌30min,4℃、12000r/min 离心15min,收集上清液。过以10倍体积的PBS和10倍体积的含体积分数1% Triton X-100 的PBS平衡好的Glutathione-Sepharose 4B亲和柱,以20倍柱体积的PBS洗去杂蛋白,亲和柱中加入凝血酶,25℃反应12~16h,收集酶切反应液,上样于经过10mmol/L NH4HCO3溶液预平衡Sephacry S 100层析柱(2.6cm×80cm),以10mmol/L NH4HCO3溶液洗脱,收集洗脱峰,浓缩,纯化后的PBP 2x储存在-20℃体积分数10%甘油溶液中。
1.2.3 氨苄青霉素偶联生物素
生物素标记氨苄青霉素(B-AMPI)操作步骤如下[15]:4mg NHS修饰的Biotin(BNHS)和10mg 氨苄青霉素溶于200μL二甲基甲酰胺,随后在室温缓慢摇振反应4h。最后将反应后的溶液滴加到15mL冰水中,过滤沉淀, 并用冷水洗5次,真空干燥。 以CH2Cl2-MeOH (体积比9:1)为洗脱剂,用柱色谱提纯B-AMPI并用HPLC 检测纯度99%。
1.2.4 标准样品的制备
氨苄青霉素溶于PBS缓冲溶液配制成质量浓度为1μg/mL的标准使用溶液,向已知无抗奶中加入此溶液调配含氨苄青霉素质量浓度一定的标准样品。随后,标准样品置于摇床15min充分混匀。
1.2.5 受体吸附分析步骤
4℃条件下,一定量青霉素受体PBP 2x固定在微孔板表面(加盖)过夜。在使用0.01mol/L PBS缓冲溶液(1.47g/L Na2HPO4,0.43g/L KH2PO4和 6.79g/L NaCl;pH7.2)冲洗后,继续使用2%酪蛋白溶液封闭来避免非特异性吸附。然后使用PBS缓冲溶液冲洗3次,加100μL脱脂后的待测样品(做3个平行样)。如果样品中含有青霉素类抗生素,青霉素将被青霉素受体PBP 2x所吸附并依据含量部分或全部占据其青霉素结合靶点。在恒温条件下培养30min后,加入100μL生物素化氨苄青霉素以占据余下的青霉素结合位点。经过30min培养后,使用清洗溶液(8.55g/L NaCl 和0.25mL/L Tween-20)及PBS缓冲溶液清洗两次,加入100μL辣根过氧化物酶标记的亲和素(1:1500)培养30min以特异性吸附PBP 2x与生物素化氨苄青霉素复合体。使用清洗溶液和PBS缓冲溶液冲洗微孔板之后,加入100μL酶底物溶液。在反应进行10min后加入100μL 1mol/L HCl(H2SO4)以终止酶反应。若样品中含有青霉素残留,PBP 2x与生物素化氨苄青霉素复合物的生成量也就会少些,则复合物所能吸附的酶标亲和素的量相应的也会少些,最终导致酶解液的吸光度变小。即样品中的青霉素浓度与微孔中酶解液的吸光度呈反比。
2 结果与分析
2.1 分析条件的优化
2.1.1 青霉素受体PBP 2x包被质量浓度的选择
在样品氨苄青霉素残留量为零,生物素化氨苄青霉素质量浓度为1000ng/mL条件下,做青霉素受体包被质量浓度单因素试验,结果见图1。当青霉素受体包被质量浓度低于5μg/mL时,在450nm波长处所测得的吸光度(每次测量前摇振15s)随包被质量浓度的增加而增加;当青霉素受体包被质量浓度高于5μg/mL时,吸光度随包被质量浓度的增加而减小;因此确定最佳青霉素受体包被质量浓度为5μg/mL。

图1 PBP 2x包被质量浓度单因素试验Fig.1 Screening of PBP 2x concentration in single factor experiments
2.1.2 生物素化氨苄青霉素质量浓度的选择
在样品氨苄青霉素残留量为零,青霉素受体PBP 2x包被质量浓度5μg/mL条件下,做生物素化氨苄青霉素浓度单因素试验,试验结果见图2。当生物素化氨苄青霉素质量浓度低于500ng/mL时,在450nm波长处所测得的吸光度随生物素化氨苄青霉素质量浓度的增加而增加且幅度较大,而当生物素化氨苄青霉素质量浓度高于500ng/mL时,吸光度随生物素化氨苄青霉素质量浓度增加幅度逐渐变缓,确定最佳生物素化氨苄青霉素质量浓度为500ng/mL。
2.2 牛乳中氨苄青霉素的测定
2.2.1 标准曲线的建立及灵敏度
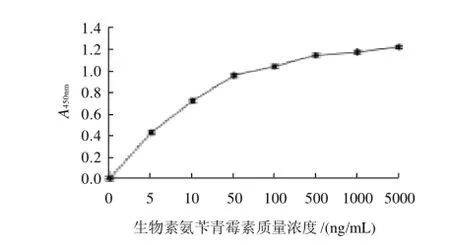
图2 生物素化氨苄青霉素质量浓度单因素试验Fig.2 Screening of B-AMPI concentration in single factor experiments
在最优化条件下做牛乳中氨苄青霉素残留质量浓度与响应率(A/A0)关系的标准曲线,并计算了各个数据的标准偏差,结果见图3。
响应率/%=A/A0= A样品/A阴性对照×100
标准曲线用标准四参数公式:y=(A1-A2)/[1+(x/x0)p]+A2;
标准曲线方程:y=(101.87-4.29)/[1+(x/13.89)1.263]+ 4.29(R=0.98)。
同时测定了10个空白样品值,平均值y值为94.51,s=0.058,y-2s=94.39,带入拟合曲线,得该方法的检出限为2μg/kg。
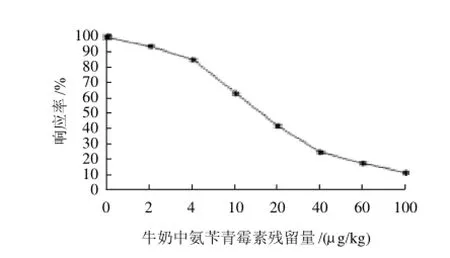
图3 牛乳中氨苄青霉素残留标准曲线Fig.3 Standard curve of ampicillin residues in milk
2.2.2 精密度及回收率实验
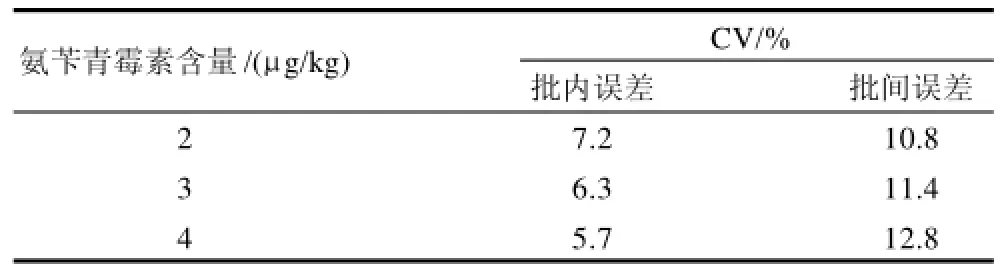
表1 精密度实验结果(n=18)Table 1 Precision of the experiments for the determination of ampicillin residues (n=18)
为测定批内误差,本实验测定了3 个不同含量的标准样品(n=6);为了测定批间误差,连续3d对不同批次的3 个不同浓度的标准样品分别进行测定(n=18),结果见表1。表2为测定3个不同含量的标准样品的回收率(n=6)。测定结果表明:此方法具有很好的精密度及回收率,适合于定量分析牛乳中的氨苄青霉素残留。
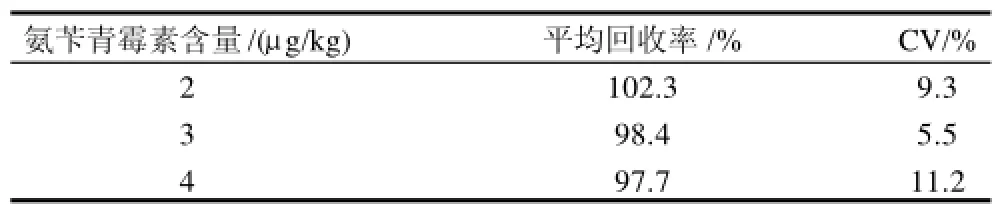
表2 回收率实验结果(n=6)Table 2 Results of recovery experiments for the determination of ampicillin residues (n=6)
3 结 论
本实验建立了受体分析结合生物素亲和素放大体系快速检测牛乳中氨苄青霉素残留的新方法,并通过单因素试验进一步优化得到青霉素受体最佳包被质量浓度为5μg/mL,最佳生物素化青霉素质量浓度为500ng/mL。更进一步建立了标准曲线,实验结果表明,此方法专一性强,灵敏度高,自动化程度高,同时具有很好的稳定性和重现性, 对于氨苄青霉素检出限可达2μg/kg,批内误差低于10%,批间误差在10.8%~12.8%之间,在3个质量浓度水平所做回收率在97.7%~102.3%之间。作为一种快速筛选方法,完全可以满足乳品工业对牛乳中氨苄青霉素残留检测的要求。
[1]BOATTO G, CERRI R, PAU A, et al. Monitoring of benzylpenicillin in ovine milk by HPLC[J]. Journal of Pharmaceutical and Biomedical Analysis, 1998, 17(4/5): 733-738.
[2]SICHERER S H, LEUNG D Y. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects [J]. Journal of Allergy and Clinical Immunology, 2006, 118(1): 170-177.
[3]KIRKWOOD E, MCSHARRY C. Anaphylactic reactions during anaesthesia[J]. Anaesthesia and Intensive Care Medicine, 2006, 7(6): 208-211.
[4]DEWDNEY J M, MAES L, RAYNAUD J P, et al. Risk assessment of antibiotic residues of-lactams and macrolides in food products with regard to their immunoallergic potential[J]. Food and Chemical Toxicology, 1991, 29(7): 477-483.
[5]李先斌, 尤灿, 黄彩芝, 等. 新生儿肺炎革兰阴性病原菌耐药性及与临床抗生素应用相关性研究[J]. 实用预防医学, 2005,12(2): 258-260.
[6]GRUNWALD L, PETZ M. Food processing effects on residues: penicillins in milk and yoghurt[J]. Analytica Chimica Acta, 2003, 483(1/2): 73-79.
[7]Commission regulations (EEC) No. 2377/90[S]. Official Journal Eur Commun, 1990, L224: 1-8.,,,,
[8]姚艳霞, 张晓芬. 乳品行业向 无抗 又迈一步[J]. 山西农业, 2006 (20): 42.
[9]NOUWS J, van EGMOND H, SMULDERS I, et al. A microbiological assay system for assessment of raw milk exceeding EU maximum residue levels[J]. International Dairy Journal, 1999, 9(2): 85-90.
[10]AURELI P, FERRINI A M, MANNONI V. Presumptive identification of sulphonamide and antibiotic residues in milk by microbial inhibitor tests[J]. Food Control, 1996, 7(3): 165-168.
[11]GUSTAVSSON E, BJURLING P, STERNESJO A. Biosensor analysis of penicillin G in milk based on the inhibition of carboxypeptidase activity[J]. Analytica Chimica Acta, 2002, 468(1): 153-159.
[12]JAMIN M, HAKENBECK M, FRERE J M. Penicillin binding protein 2x as a major contributor to intrinsicβ-lactam resistance of Streptococcus pneumoniae[J]. FEBS Letters, 1993, 331(1/2): 101-104.
[13]萨姆布鲁克J, 拉塞尔 D W. 分子克隆实验指南[M]. 黄培堂, 王嘉玺, 朱厚础, 等, 译. 3版. 北京: 科学出版社, 2002.
[14]CACCIATORE G, PETZ M, RACHID S, et al. Development of an optical biosensor assay for detection ofβ-lactam antibiotics in milk using the penicillin-binding protein 2x[J]. Analytica Chimica Acta, 2004, 520(1/2): 105-115.
[15]杨延彬, 尹学念. 实用免疫学[M]. 长春: 长春出版社, 1994: 503-514.
Determination of Ampicillin Residues in Milk by Receptor-binding Assay
SUN Yong-hai1,ZHANG Jie2,HAN Yong3,LI Zhuo-lin2,LI Tie-zhu2,*
(1. College of Biological and Agricultural Engineering, Jilin University, Changchun 130025, China;2. Center of Agro-Food Technology, Jilin Academy of Agricultural Sciences, Changchun 130124, China;3. China International Engineering Consulting Corporation, Beijing 100048, China)
The receptor has been utilized to develop a novel microplate assay for the determination of ampicillin with intact beta-lactam structure in milk. The receptor with high affinity to penicillin is produced by biotechnology. Then the receptor is employed as an identification unit to develop an indirect competitive receptor-binding assay. The detection limit of ampicillin was 2 μg/kg in milk. The assay has been developed as screening test with the option for a quantitative assay, when the identity of the residual beta-lactam is known.
milk;ampicillin;receptor binding assays;biotin;avidin
S859. 84
A
1002-6630(2010)24-0255-04
2010-01-11
国家现代农业产业技术体系建设专项(nycytx-0502);国家公益性行业(农业)科研专项(200903043);中国博士后科学基金项目(20100471246);吉林省博士后科研项目(04006)
孙永海(1956—),男,教授,博士,主要从事农产品品质智能检测与评价研究。E-mail:sunyh@jlu.edu.cn
*通信作者:李铁柱(1978—),男,副研究员,博士,主要从事食品有害残留检测的研究。E-mail:ltzjlu@126.com

