纤维素酶酶解醇葛根素研究
王星敏,殷钟意,李 鑫,张渝文
(1.重庆工商大学环境与生物工程学院,重庆 400067;2.重庆大学资源及环境科学学院,重庆 400033;3.重庆工商大学 废油资源化技术与装备教育部工程中心,重庆 400067)
纤维素酶酶解醇葛根素研究
王星敏1,2,3,殷钟意1,3,李 鑫1,张渝文1
(1.重庆工商大学环境与生物工程学院,重庆 400067;2.重庆大学资源及环境科学学院,重庆 400033;3.重庆工商大学 废油资源化技术与装备教育部工程中心,重庆 400067)
以提取葛粉后的葛根废渣为研究对象,采用微生物和代谢物酶解提制葛根素,通过高效液相色谱法分析葛根素含量,考察影响葛根素溶出的酶解时间、酶量、pH值、固液比等参数,探索微生物与底物葛渣间的生物交互作用。实验结果表明:葛根废渣5g,纤维素酶量为底物40%,葛根废渣与水的质量比为1:10,pH值为5,在30℃酶解36h后,经乙醇浸提3h,可提取葛根素33.54mg,为葛根废渣的资源化再利用提供实验基础。
纤维素酶;葛根素;葛根废渣;酶解;交互作用
生物交互作用[1]指一因子因另一因子的不同水准具有不同的效果。鲜葛根主要以有异黄酮类化合物(约1.3%)、淀粉(约40.0%)和膳食纤维(40.0%)为主,作为医药和保健食品的原料或添加剂[2]的葛根素多附着在纤维等植物组织壁上。随着葛根素在医药和保健行业[3]的深入开发和广泛食用,异黄酮类化合物的提取越来越其引起科研者和开发商的关注;而纤维素酶具有降解植物纤维原料的作用,常被应用于天然产物的提取[4]或功能食品的开发[5],逐渐有代替提取葛根素的四大传统工艺[6]之势。但在微生物酶解提制葛根素的体系中,微生物及依存空间均以开放形式存在于化学因子和物理因子的环境因素中,微生物菌种不可避免地与各因素发生交互作用;影响纤维素酶产量和活力的因素除菌种外,还有pH值、培养温度、水分、基质等;这些因素不是孤立存在的,而是相互联系的。为实现葛渣资源综合利用,本实验以提取葛粉后的葛根废渣为研究对象,采用生物酶解法降解葛渣植物组织,减少葛根素提取传质阻力[4],通过测定葛根素含量,探索酶与植物组织间生物交互作用的影响因素,为葛产业集约化发展而囤积的葛根废渣消减及资源综合利用提供依据。
1 材料与方法
1.1 材料与试剂
葛根废渣(提取葛根淀粉)取自重庆北碚农户。
葛根素(标品)、乙醇(分析纯)、硫酸(分析纯)、氢氧化钠(分析纯)和甲醇(分析纯)。
1.2 仪器与设备
GOLD 166P高效液相色谱仪 美国System公司;DELTA 320-5 pH计 梅普勒-托利多仪器厂;RE-2000旋转蒸发器 上海亚荣生化仪器厂;SHZ-B往返水浴恒温振荡器 上海跃进医疗器械厂;FA2004电子分析天平 上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 菌种培养方法
选用白腐真菌等微生物,分别经过斜面培养、种子液体培养后,按一定比例接种入摇瓶培养;接入量为5%,29℃、180r/min条件下,混合培养48h。
1.3.2 酶解提制方法
称取粉碎后20目的葛根废渣5.00g至0.25L干净的锥形瓶中,设定固液比、温度、pH值,按比例接入培养好的菌种接种液或纤维素酶,发酵处理一定时间后,过滤,测定酶解液中的葛根素含量;根据葛根素溶于水中微溶的性质,用乙醇浸提滤渣,测定醇提液中的葛根素含量,二者之和为葛渣中葛根素的含量;合并测定液,经大孔树脂富集、纯化,蒸馏后得产品。
1.3.3 提取工艺参数
葛根废渣与水质量比为1:10,微生物(纤维素)接种量5%~40%,酶解温度20~40℃,pH4~8,在水浴恒温振荡器中连续酶解36h,进间歇通过无菌空气(平均10min/h);乙醇与葛渣固液比为1:15,醇提时间3h。1.3.4分析方法
采用色谱分析方法[8-9]测定葛根素标品。绘制葛根素标准曲线,可得到葛根素质量浓度(x,g/L)与峰面积(y)的关系方程:y=35415x-14502,R2=0.9993;色谱条件为:色谱柱:C18;柱温:30℃;流动相:甲醇-水(25:75);检测波长:250nm;流速:1.0mL/min;进样体积:10μL。
2 结果与分析
2.1 纤维素酶酶解活力比较
2.1.1 酶解法与常规化学醇提法的比较
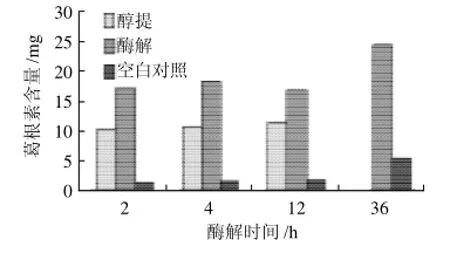
图1 生物酶解法与常规醇提法的比较Fig.1 Comparison of extraction method with biological enzymes and conventional ethanol extraction
纤维素酶是一种复合酶,主要包含外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等[10],还有很高活力的木聚糖酶活力,易催化水解破坏葛根细胞壁的纤维结构。对比酶解生物效应和化学醇提效应,选用相同量乙醇分别浸提相同质量的葛根废渣。由图1可知,在任一时间,经酶解后的葛根素溶出量均高于常规化学醇提法,且经4h后常规醇提法提取葛根素变化趋于平缓约11.05mg;而酶解法在36h有最大值为24.71mg,明显高于常规化学醇提法。
2.1.2 微生物与纤维素酶酶解作用对比
纤维素酶只是微生物代谢酶的一种,为比较微生物和代谢物酶之间的酶解优势,在相同条件下,选择管囊酵母、白腐真菌和纤维素酶处理相同质量的原料,由图2可知,纤维素酶解出葛根素含量高于管囊酵母和白腐真菌,表现较强的酶解性能,且在36h时,获得葛根素量为23.42mg。原因在于:在酶解初期,微生物能代谢出不同酶,催化降解植物组织能力较强,释放葛根素量较强,但随着时间的进行,微生物菌种易退化而降低产酶力[11],降低降解植物组织能力,葛根素的有效释放能力明显低于纤维素酶。

图2 微生物与纤维素酶的酶解作用对比Fig.2 Comparison on enzymatic hydrolysis effect of cellulose and microorganisms
2.2 不同纤维素酶量对葛根素含量的影响
设定加酶量(纤维素酶投入量与底物质量)比为5%、10%、20%、30%、40%。由图3可知,投入量为40%时,葛根素的含量最高,质量浓度为0.485mg/mL,含量为24.24mg。原因在于:纤维素酶在分解纤维素时起生物催化作用[12-13],投入量适中有助于催化葛根植物组织降解,葛根素得以充分释放。
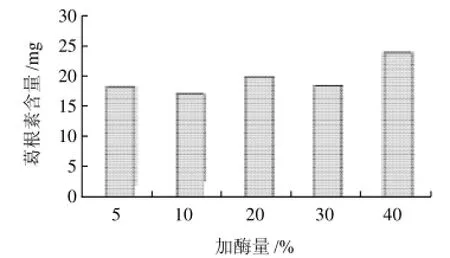
图3 不同加酶量对葛根素含量的影响Fig.3 Effect of cellulose content on extraction rate of puerarin
2.3 酶解环境因素对葛根素浸出的影响
2.3.1 不同固液比对葛根素含量的影响
对比图4酶提液和醇提液中葛根素含量可知,纤维素酶解活力受酶解体系固液比的影响,相同量的葛根废渣释放出不同量的葛根素;当酶解固液比为1:10,葛根素酶解量明显高于醇提量,溶出量高达17.837mg,葛根素总量为28.590mg。这是由于当培养基含水量过低,物料疏松,纤维素酶无法完全吸附底物,酶活力不够,降解能力变低;培养基含水量过大,物料过于黏稠,供氧及散热条件恶化,酶催化效率降低,导致葛根素得率也随之降低。
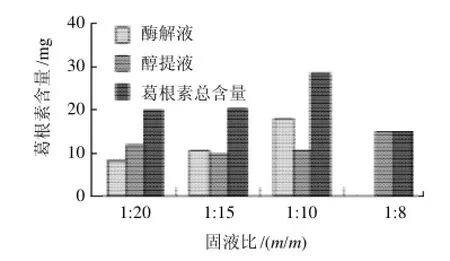
图4 固液比对葛根素含量的影响Fig.4 Effect of material-liquid ratio on extraction rate of puerarin
2.3.2 不同pH值对葛根素含量的影响

图5 不同pH值对葛根素含量的影响Fig.5 Effect of enzymatic hydrolysis pH value on extraction rate of puerarin
大多数酶作用于底物有最适pH值[14],一般为4.0~6.0。从图5可以看出,纤维素酶在酸性条件影响较小,且在pH5时,纤维素酶表现出最适应,其葛根素质量浓度分别为0.397mg/mL和0.347mg/mL;但在pH8时,纤维素酶的催化水解能力明显下降,葛根素得率最低。
2.3.3 不同酶解温度对葛根素含量的影响
酶类属于蛋白质类物质[15],大多数纤维素酶都具有较高稳定性;但对温度较敏感,而适宜温度一般可增大酶活性,促进植物纤维的降解。由图6可以看出,发酵温度的变化对酶解获取葛根素影响较大,当温度为30℃时,酶解活力充分,葛根素提取量达到最高为14.719mg。
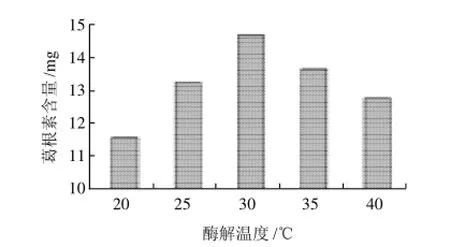
图6 不同酶解温度对葛根素含量的影响Fig.6 Effect of enzymatic hydrolysis temperature on extraction rate of puerarin
2.4 葛根素液相成分分析

图7 葛根素样品与标准品液相色谱图对比Fig.7 Comparison on liquid chromatographs of samples and standard product
通过以上纤维素酶作用及单因素试验,确立了酶解提制葛根素的交互作用效应的影响因素及最佳条件。将5g葛根废渣在各个最佳条件下酶解36h后,经一定量乙醇浸提3h,能提取葛根素33.54mg,高于单因素试验值,是常规化学醇提法(11.05mg)的3倍。由图7可知,样品中酶解所得产物均为葛根素。
3 结 论
3.1 生物酶解法优于常规化学醇提法,且纤维素酶的酶解效果优于微生物。
3.2 影响生物酶解提制葛根素的交互作用效应的因素为:投入底物质量的40%的纤维素酶,设置固液比为1:10,pH5,在30℃酶解36h,经一定量的乙醇醇提3h,5g葛根废渣能获得葛根素33.54mg,是常规化学醇提法的3倍。
[1]秦文弟. 复合污染对土壤生物的交互作用[J]. 河南科学, 2008, 26(6): 730-733.
[2]张雁, 池建伟, 张名位, 等. 新鲜葛根中总黄酮和淀粉的提取工艺研究[J]. 中国食品学报, 2008(3): 73-77.
[3]李悦, 李艳菊. 国内外葛根功能食品研究进展[J]. 食品研究与开发, 2007(12): 174-177.
[4]施英英, 薛培俭, 夏黎明. 酶法提取葛根渣中异黄酮的研究[J]. 林产化学与工业, 2006, 26(3): 62-64.
[5]李积华, 刘成梅, 李明. 功能性葛根天然饮料工艺研究[J].江西食品工业, 2004(1): 20-22.
[6]赵浩如, 郜凤香. 葛根总黄酮的提取方法研究[J].中成药, 2000, 22 (11): 756-757.
[7]KRIAKOSYAN A, KAUFMAN P B, WARBER S, et a1.Quantification of major isoflavones and L-canavanine in several organs of kudzu vine(Pueraria montana)and in starch samples derived from kudzu roots [J]. Plant Science, 2003, 164: 883-888.
[8]PRASAIN J K, KENNETH J, MARION K, et a1. Profiling and quantification of isoflavones in kudzu dietary supplements by hish: performance liquid chromatography and eleetmspmy ionization tandem mgss spectrometry[J]. Agricultral and Food Chemistry, 2003, 51: 4213-4218.
[9]刘逢芹, 刘田云, 李贵海, 等. 分光光度法和HPLC法测定野葛藤总黄酮及葛根素含量[J]. 中药材, 2005(10): 895-896.
[10]邵学良,刘志伟. 纤维素酶的性质及其在食品工业中的应用[J]. 中国食物与营养, 2009(8): 34-36.
[11]RABINOVICH M L, MELINK M S, BOLOBOVA A V. Cellulases from microorganisms[J].Prikl Biokhim Microbiol, 2002, 38(4): 355-373.
[12]KAZUHIRO H, MAKOTO M, KAORU N, et al. Phenolic glucosides from the root of Pueraria lobata[J]. Phytocchemistry, 1997, 46(5): 921-928.
[13]DAS S. Enzyme application in textiles[J]. The Indian Textile Journal, 2000, 29: 27-31.
[14]曾青兰. 纤维素酶及其应用[J]. 河北农业科学, 2008(8): 171-172.
[15]张晓勇, 陈秀霞. 纤维素酶的蛋白质工程. 纤维素科学与技术, 2006, 14(2): 56-58.
Ethanol Extraction of Puerarin by Cellulase Hydrolysis
WANG Xing-min1,2,3,YIN Zhong-yi1,3,LI Xin1,ZHANG Yu-wen1
(1. School of Environmental and Biological Engineering, Chongqing Technology and Business University, Chongqing 400067, China;2. School of Resources and Environmental Science; Chongqing University, Chongqing 400033, China;3. Engineering Research Centre for Waste Oil Recovery Technology and Equipment, Ministry of Education, Chongqing Technology and Business University, Chongqing 400067, China)
Puerarin was extracted by enzymatic hydrolysis with microbe and cellulase from waste pueraria. High performance liquid chromatography was used to determine puerarin content for exploring the effects of enzymatic hydrolysis time, enzyme addition amount, pH and material-liquid ratio as well as cross-interaction on extraction rate of puerarin. Results indicated that pueraria amount of 5 g, cellulose concentration of 40% compared with pueraria weight, pueraria-water ratio of 1:10, enzymatic hydrolysis pH of 5, enzymatic hydrolysis temperature of 30 ℃, enzymatic hydrolysis time of 36 h and ethanol extraction time of 3 h. Under the optimal enzymatic hydrolysis and extraction conditions, the yield of puerarin was up to 33.54 mg. These investigations will provide a theoretical reference for the exploration and utilization of pueraria.
cellulase;puerarin;pueraria waste;enzymolysis;biological interaction
TQ 028.8
A
1002-6630(2010)24-0046-04
2010-09-21
重庆市科技攻关项目(cstc,2010AC1061);重庆市教委科技项目(cqjwKJ100708)
王星敏(1975—),女,副教授,博士研究生,主要从事固体废弃物资源化开发与资源化利用研究。E-mail:wxm0826@ctbu.edu.cn

