Fenton深度处理渗滤液时DOM结构变化
赵庆良,张 静,卜 琳
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨150090; 2.哈尔滨工业大学市政环境工程学院,哈尔滨150090,zhql1962@163.com)
垃圾渗滤液中有机物含量高,难降解,因而对环境造成严重污染.溶解性有机物(DOM)是垃圾渗滤液中最重要的活跃成分,当渗滤液进入介质后,DOM对介质中的有机及无机污染物在环境中的迁移均会产生重要影响.因此,利用波谱手段对深度处理过程中的垃圾渗滤液DOM组成和性质进行分析,从物质结构的方面了解DOM的转化,对于防止渗滤液二次污染及其在介质中形成的复杂污染具有重要意义[1].近年来,国外部分研究者,如Kang等[2]和Fan等[3]开始将应用于天然水体、土壤中腐殖酸、富里酸和亲水性物质的分析手段应用于分析垃圾渗滤液溶解性有机物化学结构和官能团特征[4],以进一步掌握渗滤液的化学性质,应用最多的是紫外-可见光谱和红外光谱,国内对有机质进行研究的报道则较少[5].本文利用非离子吸附树脂将DOM分级,通过红外光谱确定了DOM各分级组分在Fenton深度氧化处理过程中的结构变化,通过荧光光谱确定了Fenton反应过程中不同组分转化及去除,为更有效地去除垃圾渗滤液中DOM提供依据.
1 实验
1.1 水质分析
实验用水从SBR反应器取样,反应器中水力停留时间(HRT)为21 h,污水组分主要为溶解性有机物,悬浮颗粒物,氨氮和重金属等,水样取回后用棕色瓶盛装,4℃的条件下保存备用.SBR出水的水质参数平均值如表1所示.
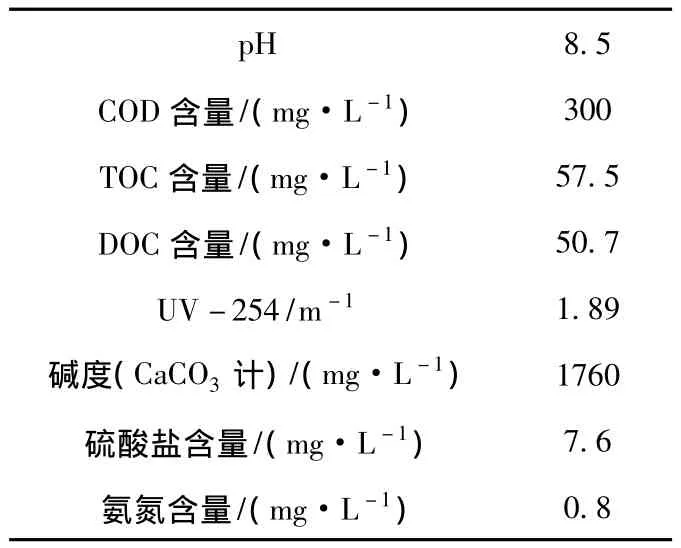
表1 SBR出水的水质参数
1.2 Fenton实验装置
Fenton深度氧化过程在前期确定的最优反应条件下进行,即 H2O2和 Fe2+的物质的量比n(H2O2)∶n(Fe2+)=2.7∶1,pH=3.5,水样中H2O2的投加量为1.2 mL/L水样,反应时间120 min.取500 mL原水置于1 000 mL烧杯中,用质量分数98%的浓H2SO4溶液调节pH=3.5后,边搅拌边依次加入FeSO4·7H2O固体和质量分数为30%的H2O2,置于六联搅拌器搅拌,反应120 min后,用固体Ca(OH)2调节pH=8,静置沉淀0.5 h,经过0.45 μm微孔膜过滤,取滤过液测定分析.
1.3 溶解性有机物分级分离
根据Aiken等[6]提出的DOM在XAD-8和XAD-4树脂上的吸附特性,将DOM分为5级:疏水性有机酸(HPO-A)、疏水性有机中性物质(HPO-N)、过渡亲水性有机酸(TPI-A)、过渡性亲水性中性物质(TPI-N)和亲水性有机物(HPI).本实验中树脂柱的清洗方法采用改进的索氏提取法[7].
有机物具体分级步骤如下:1)将待实验的5 L水样用0.45 μm滤膜过滤后,用盐酸酸化至pH=2,然后以每小时15床体积流速依次通过串联的XAD-8和XAD-4树脂柱,此时不能被串联树脂柱吸附,XAD-4树脂柱出水中所含的物质为HPI;2)待所有的水样通过树脂柱后,用0.1 mol/L的NaOH溶液以每小时2床体积的速度对XAD-8和XAD-4树脂柱分别进行反冲洗,从XAD-8和XAD-4树脂柱反冲洗所得的组分分别为HPO-A和TPI-A;3)反冲洗完成后,依然吸附在XAD-8和XAD-4树脂上的组分分别为HPO-N和TPI-N,其通过由乙腈和水组成的混合溶液(体积比为3∶1)对树脂柱进行冲洗得到.所得水样通过旋转蒸发及真空冷冻干燥,便可得到实验样品.由于HPI溶解在较大体积的出水中难于蒸发,未对其进行提取.分级完成后,所有的样品存储在4℃的冰箱中.具体步骤如文献[8-9]所述.
1.4 分析方法
DOC和UV-254分别采用岛津公司生产的TOC-5000型总有机碳分析仪和UV-2550型紫外-可见分光光度计测定.SUVA计算方法定义为(UV-254/DOC)×100.荧光光谱分析采用JASCO FP-6500进行测定,水样稀释到DOC含量为1 mg/L,激发波长为220~500 nm,检测波长为220~500 nm.将2~5 mg的HPO-A、HPO-N、TPI-A和TPI-N提取物分别加溴化钾晶体共同研碎压片进行红外光谱分析.红外光谱仪为Perkin-Elmer Spectrum One B型,波谱扫描范围为4 000~400 cm-1.为了便于比较,所得光谱用基线校正并标准化到1.0.
2 结果与讨论
2.1 Fenton深度处理对DOM各组分的去除
SBR二级出水和Fenton反应出水的DOC及其去除率如表2所示.从表2中可以看出,HPOA、HPO-N、TPI-A和 TPI-N四个组分伴随着DOM的去除同步去除,但是HPI基本未被去除,其原因可以用Fox等[10]的试验结果解释,HPI的有效去除主要是通过生物降解作用表现.HPO-A和HPO-N为SBR出水DOM中最主要组分,占到其DOC总含量的67%,因此,对这2种组分的有效去除关系到整个系统的DOC去除效果.

表2 Fenton出水DOC去除率
根据Aiken等[6]和Maurice等[11]提出的HPO-A和HPO-N比TPI-A、TPI-N和HPI包含有更多的大分子物质的结论,结合Fenton对DOM的去除特性,可以得出Fenton对DOM组分的有效去除主要表现为Fenton对DOM中大分子物质HPO-A、HPO-N和TPI-A的优先氧化降解.通过Fenton作用,SBR出水DOM各组分DOC去除率由大到小依次为:TPI-A,HPO-N,TPI-N,HPO-A,HPI.
2.2 SUVA的变化
相对紫外吸光率(SUVA)可以用来表征有机物的相对芳香性强度,其计算方法为(UV-254/ DOC)×100.如图1所示,SBR出水中HPO-A、HPO-N、TPI-A、TPI-N、HPI的SUVA分别为2.45、0.82、1.22、0.70、0.65 L/(mg·m),说明HPO-A的芳香结构含量多,HPI则以脂肪烃为主.Fenton反应出水中,DOM五个组分的SUVA均有所上升,说明在氧化过程中,有机物中的不饱和键增多,符合氧化过程中的规律,同时也说明,在氧化过程中存在非芳香性化合物去除或者芳香性化合物生成.
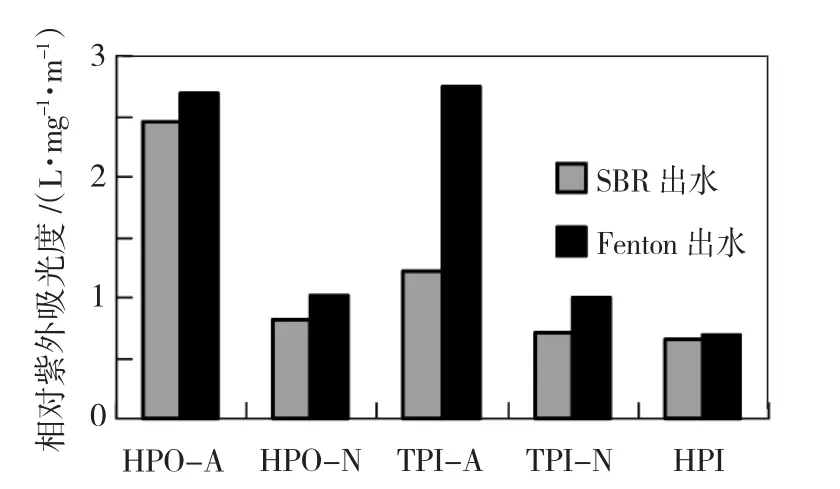
图1 分级组分SUVA变化
2.3 DOM五个组分的转化
FRI分析法[12-13]是一种将荧光图谱分为5个独立区域的定量分析方法,它利用全部波长范围内的激发波长/发射波长相对的荧光强度对样品的性质进行分析.根据Chen等[12]的研究,荧光图谱中表示的溶解性有机物分为5类:芳香性蛋白质I,λ激发/λ发射=(220~250)/(280~330);芳香性蛋白质 II,(λ激发/λ发射=(220~250)/ (330~380);富里酸类物质,(λ激发/λ发射=(220~250)/(380~480);微生物沥出物,(λ激发/λ发射= (250~280)/(290~380);腐殖酸类物质,λ激发/ λ发射≥250/(380~480).
图2为SBR出水和Fenton出水三维荧光光谱图,从图2(a)可知,SBR出水DOM的EEM图谱中出现很强的腐殖酸荧光特征峰,强度接近了1 000 au,说明腐殖酸是垃圾渗滤液SBR出水的主要成分,富里酸的特征峰因靠近腐殖酸的特征峰,虽然强度也比较大,但仍以肩峰形式存在,同时图中也出现了芳香性蛋白质中等强度的特征峰和微生物沥出物的特征峰.

图2 SBR出水和Fenton出水三维荧光光谱图
从图2(b)可知,λ激发/λ发射=(250~260)/ (380~480)处的腐殖酸的特征峰基本消失,而λ激发/λ发射=(220~250)/(380~480)处的富里酸特征峰仍然存在,说明在Fenton氧化过程中腐殖酸相对富里酸更易去除.λ激发/λ发射=(320~ 350)/(400~480)处的腐殖酸特征峰和芳香性蛋白质的特征峰强度都大大减弱,说明在Fenton氧化过程中腐殖酸和芳香性蛋白质被部分去除,或者转化成为了不发射荧光的物质.微生物沥出物的特征峰经过Fenton深度氧化后仍然明显存在.
2.4 傅立叶红外光谱分析
红外光谱已经普遍应用于DOM的结构和官能团检测,并且可以提供大量准确信息.Davis等[14],Lin等[15],Kim,Yu和Kanokkantapong等[16-17]提到的各个官能团特征吸收峰对应的波数参见表3.

表3 不同波数对应的官能团特征吸收峰
如图3所示,在SBR出水HPO-A和TPI-A的红外光谱中,1730~1710 cm-1处有很强的C==O吸收,1 400 cm-1处有O—H的吸收,1 250~1 150 cm-1处有C—O吸收,可见HPO-A中有很强的羧基基团的吸收峰.与HPO-A相比较,TPI-A在3 100~3 000 cm-1之间处的吸收弱,说明有TPI-A中脂肪烃的含量少.虽然TPI-A谱图中也有C==C吸收峰,但是基本上可以看做是1-酰胺的肩峰.HPO-N和TPI-N的谱图比较接近,相比其他几个组分,脂肪烃含量较高,而且基本没有羧酸基团的吸收,在1 670 cm-1处有1-酰胺吸收峰,说明这2个组分主要是微生物体降解得到的糖蛋白等产物.
如图3所示,Fenton反应后,HPO-A的结构发生了明显的变化,1 730~1 710 cm-1和1 250~1 150 cm-1处羧基的C==O吸收明显减弱,说明在Fenton反应中有效地减少了C==O.TPI-A在3 100~3000 cm-1和1600 cm-1处的强吸收,说明TPI-A芳香性增强.HPO-N经过Fenton反应并没有发生明显变化,仍含有大量脂肪链烃.TPIN在1 600 cm-1处的吸收,表明出现了新的结构2-酰胺.

图3 SBR出水和Fenton出水的红外光谱
3 结论
1)Fenton对DOM中大分子物质HPO-A、HPO-N和TPI-A优先氧化降解.通过Fenton作用,SBR出水DOM各组分DOC去除率由大到小依次为:TPI-A,HPO-N,TPI-N,HPO-A,HPI.
2)Fenton反应出水中,DOM五个组分的SUVA均有所上升,表明在氧化过程中,有机物中的不饱和键增多,符合氧化过程中的规律,同时在氧化过程中存在非芳香性化合物去除或者芳香性化合物生成.
3)通过荧光光谱分析,腐殖酸和富里酸是垃圾渗滤液SBR出水中的主要物质,在去除过程中腐殖酸相对富里酸更易去除,芳香性蛋白质和微生物沥出物也相应被部分去除.
4)HPO-A和TPI-A均显示很强的羧酸基团吸收峰,而HPO-N和TPI-N有较强的脂肪烃吸收峰.Fenton反应后,HPO-A和TPI-A中的O—H、—COOH的含量降低,而苯环、C—O和含量升高.
[1]席北斗,魏自民,赵越,等.垃圾渗滤液水溶性有机物荧光谱特性研究[J].光谱学与光谱分析,2008,28 (11):2605-2608.
[2]KANG K H,SHINB H S,PARK H.Characterization of humic substances present in landfill laechates with different landfill ages and its implication[J].Water Researh,2002,36:4023-4032.
[3]FAN H J,SHU H Y,YANG H S,et al.Characteristics of landfill leachates in central Taiwan[J].Science of the Total Environment,2006,36:25-37.
[4]FUKUSHIMA T,ISHIBASHI T,IMAI A.Chemical characterization of dissolved organic matter in Hiroshima Bay,Japan[J].Estuarine,Coastal and Shelf Scienca,2001(53):51-62.
[5]方芳,刘国强,郭劲松,等.垃圾渗滤液中溶解性有机质研究进展[J].水处理技术,2009,35(4):4-8.
[6]AIKEN G L,MCKNIGHT D M,THORN K A,et al.Isolation of hydrophilic organic acids from water using nonionic macroporous resins[J].Organic Geochemistry,1992,18(4):567-573.
[7]LEENHEER J A.Comprehensive approach to preparative isolation and fractionation of dissolved organic carbon from natural waters and wastewaters[J].Environmental Science and Technology,1981,15:578-587.
[8]LI W H,SHENG G P,LIU X W,et al.Characterizing the extracellular and intracellular fluorescent products of activated sludge in a sequencing batch reactor[J].Water Research,2008,42:3173-3181.
[9]BAKER A.Fluorescence properties of some farm wastes:implications for water quality monitoring[J]. Water Research,2002,36:189-195.
[10]FOX P,ABOSHANPW,ALSAMADI W.Analysis of soils to demonstrate sustained organic carbon removal during soil aquifer treatment[J].Environmental Quality,2005.34(1),156-163.
[11]MAURICE P A,PULLIN M J,CABANISS S E.A comparison of surface water natural organic matter in raw filtered water samples,XAD,and reverse osmosis isolates[J].Water Research,2002,36(9):2357-2371.
[12]CHEN W,WESTERHOFF P,LEENHEER J A,et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science and Technology,2003,37:5701-5710.
[13]HOLBROOK R D,RREIDENICH J,DEROSE P A. Impact of reclaimed water on select organic matter properties of a receiving streams fluorescence and perylene sorption behavior[J]. Environmental Science and Technology,2005,39:6453-6460.
[14]DAVIS W M,ERICKSON C L,JOHNSTON C T,et al. Quantitative Fourier transform infrared spectroscopic investigation of humic substance functional group composition[J].Chemosphere,1999,38(12):2913-2928.
[15]LIN C F,LIU S H,HAO O J.Effect of functional groups of humic substances on UF performance[J]. Water Research,2001,35(10):2395-2402.
[16]KIM H C,YU M J.Characterization of natural organic matter in conventional water treatment processes for selection of treatment process focused on DBPs control[J].Water Research,2005,39(19):4779-4789.
[17]KANOKKANTAPONG V,MARHABA T F,PANYAPINYOPHOL B.FTIR evaluation of functional groups involved in the formation of haloacetic acids during the chlorination of raw water[J].Journal of Hazardous Material,2006,136(2),188-196.

