β-葡萄糖苷酶以及益生菌生物转化大豆异黄酮糖苷的研究进展
韩 婷,程 钢,刘 莹,黄 文,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.中南民族大学生命科学学院,湖北 武汉 430074)
β-葡萄糖苷酶以及益生菌生物转化大豆异黄酮糖苷的研究进展
韩 婷1,程 钢2,刘 莹1,黄 文1,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.中南民族大学生命科学学院,湖北 武汉 430074)
大豆及其加工制品中以糖苷形式存在的大豆异黄酮不利于人体的消化吸收,难以发挥其生物保健作用。本文综述了利用β-葡萄糖苷酶生物转化大豆异黄酮糖苷以提高生物利用率的国内外研究进展情况,重点介绍了外源性β-葡萄糖苷酶和产β-葡萄糖苷酶益生菌对大豆异黄酮糖苷的转化作用。
大豆异黄酮;β-葡萄糖苷酶;水解;益生菌
大豆及其加工制品是人类健康食谱中不可或缺的组成部分,近年来,大豆中的主要活性物质大豆异黄酮由于具备多种生物活性,受了到国内外消费者的普遍关注。大豆异黄酮是大豆等豆科植物在生长过程中产生的一种次级代谢产物,在干大豆中的含量为0.5~0.7mg/g[1],其结构与雌激素相似,摄入体内后能与雌激素受体结合,调节人体内雌激素水平。西方国家居民的异黄酮每日平均摄入量较低,少于1mg/d,而亚洲国家居民的大豆异黄酮每日平均摄入量相对较高,大约为50~70mg/d[2]。研究发现,摄入足够量的大豆异黄酮可以有效降低患骨质疏松症、妇女更年期综合症、高胆固醇症、以及心血管疾病和癌症的风险[3]。
大豆中天然存在的异黄酮主要成分有3类,即染料木素(genistein)类、大豆苷元(daidzein)类和黄豆黄素(glycitein)类,各自又主要以4种形式存在:丙二酰基葡萄糖苷型、乙酰基葡萄糖苷型、β-葡萄糖苷型和糖苷配基型(苷元)[4],大豆异黄酮的化学成分组成见表1,其中结合型的糖苷占到了总异黄酮含量的80%~95%[5]。研究发现,糖苷形式的大豆异黄酮不能直接被小肠壁吸收,必须经水解去除糖基转化为游离型的苷元才可被小肠吸收[6],水解过程如图1所示,因而发挥生物活性的主体是游离型的苷元。如何有效的将糖苷型的大豆异黄酮通过水解转化成游离型的苷元以增强大豆异黄酮的生物活性已成为近年来世界各国科学家研究的热点。
常用的糖苷水解方法主要有酸解法和酶解法。由于酸水解存在一定的不安全因素,而酶水解反应条件温和,因而具有独特的优势。水解大豆异黄酮糖苷的酶有β-葡萄糖苷酶、β-半乳糖苷酶和α-半乳糖苷酶等[7]。目前,国内外研究最多的是β-葡萄糖苷酶。本文就利用β-葡萄糖苷酶生物转化大豆异黄酮糖苷的国内外研究进展情况进行综述。
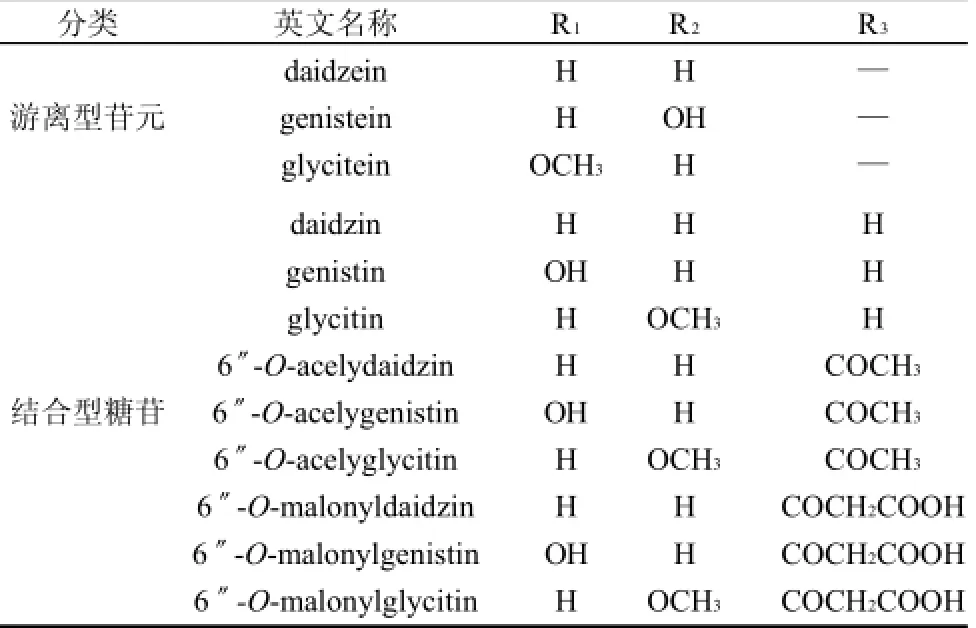
表1 大豆异黄酮的分类Table 1 The classification of soybean isoflavones

图1 大豆异黄酮糖苷的水解Fig.1 Hydrolysis of soybean isoflavone glycosides
1 β-葡萄糖苷酶简介
β-葡萄糖苷酶属于纤维素酶类,于1 8 3 7年被Liebig和Wohler首次在苦杏仁中发现,后来发现该酶在自然界分布广泛,普遍存在于植物、动物和微生物中。β-葡萄糖苷酶的特性是可水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-葡萄糖和相应的配基。因此,β-葡萄糖苷酶在制备大豆异黄酮活性苷元方面显示出极大的应用前景。
大豆自身含有内源性的β-葡萄糖苷酶,Hsieh[8]和Suzuki等[9]分别从大豆和大豆幼苗根中对β-葡萄糖苷酶进行了提取纯化,并用于共轭型异黄酮结合物的水解,但水解活性不强,水解效率只有22%~29%。目前获得β-葡萄糖苷酶的方法主要是从其他植物中提取和微生物液体发酵,杏仁是β-葡萄糖苷酶的最经典的来源。但是植物来源的β-葡萄糖苷酶的活性远比微生物来源的活性低[10]。对微生物中的β-葡萄糖苷酶的研究主要集中在酵母、曲霉、木霉以及细菌内,其中,曲霉被普遍认为是产β-葡萄糖苷酶的优良菌种,尤以黑曲霉的效率最高[11]。近年来的研究发现,双歧杆菌[4]和乳酸杆菌[12]具有产β-葡萄糖苷酶能力,在发酵豆奶的过程中可以将大豆异黄酮转化成活性苷元,受到国内外研究学者的关注。
从微生物发酵液中提取β-葡萄糖苷酶,一般采用先经硫酸铵、乙醇或丙酮沉淀等进行初步分离,再经离子交换柱层析、凝胶过滤柱层析、等电聚焦等进行进一步的分离纯化的方法[13-16]。
国内外检测β-葡萄糖苷酶活力通常以ρ-NPG(对硝基苯酚-β-D-吡喃葡萄糖苷)作为底物,在β-葡萄糖苷酶作用下ρ-NPG糖苷键断裂生成ρ-硝基酚,反应生成的ρ-硝基酚的总量可以在400~420nm波长处通过紫外分光光度法检测,吸光度越高,就说明酶活越强[17-19]。
2 外源性β-葡萄糖苷酶对大豆异黄酮糖苷的转化
目前,利用外源性β-葡萄糖苷酶转化大豆异黄酮糖苷的研究仍处于实验阶段,还没有进行工业化。国内外许多学者研究了直接利用外源性β-葡萄糖苷酶对大豆异黄酮糖苷的水解作用。
徐茂军[20]以豆奶和豆奶粉为实验材料,研究了不同浓度的商业β-葡萄糖苷酶对大豆异黄酮糖苷的生物转化作用。结果表明,在β-葡萄糖苷酶浓度1.5U/mL、pH5.5、45℃保温1h的条件下,能够将豆奶及豆奶粉中生物有效性较低的染料木苷、乙酰染料木苷、丙二酰染料木苷等异黄酮糖苷化合物转化为大豆苷元等相应的异黄酮糖苷配基化合物,转化率分别为91.6%、97.7%和94.1%。且利用β-葡萄糖苷酶可以在不影响产品色泽、口味等感官品质的情况下,提高豆奶及豆奶粉中异黄酮的生物有效性。
汪海波等[21]以低纯度的商品大豆异黄酮为原料,研究了采用β-葡萄糖苷酶制备大豆异黄酮苷元的最佳工艺参数。实验结果表明,在酶的使用量为1.575U/10mg总黄酮、酶水解反应时间2h、体系pH5、异黄酮底物质量浓度400~600μg/mL、反应温度50℃的水解条件下可达到理想的水解效果。
Otieno等[22]对比了外源性β-葡萄糖苷酶(杏仁中提取)和产β-葡萄糖苷酶菌株(双歧杆菌和乳酸菌菌属)对豆奶中大豆异黄酮糖苷的转化作用。在37℃发酵开始4h后,3个不同浓度(0.288、O.359、0.575U/mL)的外源性酶分别使总苷元浓度增加了5.87、5.92、5.77倍,而Bifidobacterium animalis ssp.lactis Bb12、Lactobacillus casei 2607、Lactobacillus acidophilus ATCC 4461分别使总苷元浓度增加了3.43、2.72、3.04倍,说明外源性β-葡萄糖苷酶的水解效果较好,且在外源性β-葡萄糖苷酶作用下苷元浓度达到最大值所需的时间约为2h,而双歧杆菌和乳酸杆菌则至少需要15h。
可见,直接利用外源性β-葡萄糖苷酶转化大豆异黄酮糖苷,具有转化率高、耗时短、反应体系简单、条件温和等优点。但是,由于商业β-葡萄糖苷酶价格昂贵,而且不能回收利用,直接用于大豆异黄酮糖苷的生物转化成本高,在应用过程中受到很大限制。
采用固定化酶技术将β-葡萄糖苷酶固定在载体上
反复使用可以达到降低成本的目的。潘利华等[23]研究了以海藻酸钠为载体,戊二醛为交联剂固定化β-葡萄糖苷酶的条件及其在制备染料木素中的应用,该固定化酶重复使用6次后其活力可以保持在90.94%,但染料木苷的转化率为仅为60.02%。吴定等[24]用中空球形壳聚糖固定化β-葡萄糖苷酶,固定化后的β-葡萄糖苷酶活力降低了12.1%,再用固定化后的β-葡萄糖苷酶水解大豆异黄酮糖苷,经超滤、固定化酵母细胞等处理,可制备纯度达94%的大豆异黄酮苷元,但是该方法操作较为复杂,也不易工业化。
因此,外源性β-葡萄糖苷酶对大豆异黄酮糖苷的生物转化存在着诸多弊端,在应用中受到很大限制,不利于工业化,目前,世界上不少研究者已经将目光转向了利用产β-葡萄糖苷酶益生菌菌株发酵豆奶转化大豆异黄酮糖苷的研究。
3 产β-葡萄糖苷酶益生菌菌株的筛选
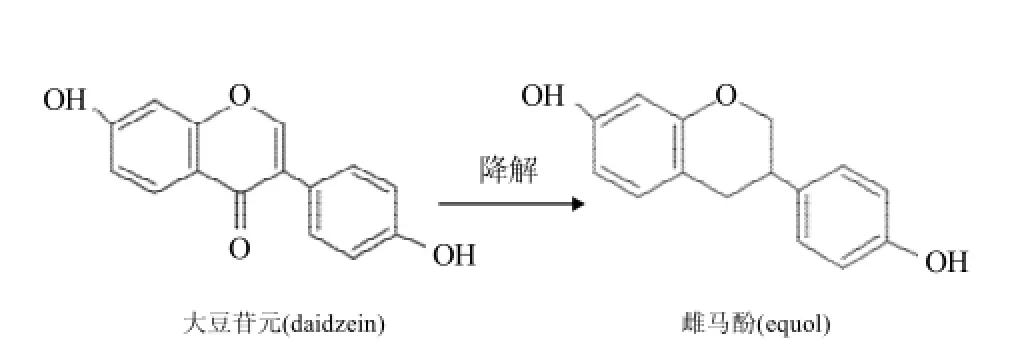
图2 大豆苷元的降解Fig.2 Degradation of daidzein
肠道细菌尤其是益生菌在异黄酮的代谢中起到了关键的作用[25],部分益生菌还可以将大豆苷元进一步代谢为雌马酚(图2),与苷元相比它与雌激素受体的结合力更强[26]。然而,人体内的益生菌的种类和数量因人而异,并且受到年龄、疾病、膳食等因素的影响,这就导致并不是每个个体都可以将摄入体内的大豆异黄酮类化合物较好的吸收。与其他可以分泌β-葡萄糖苷酶的微生物如酵母、曲霉、木霉等相比,益生菌可以直接添加到大豆发酵产品中,在发酵过程中释放出β-葡萄糖苷酶水解异黄酮糖苷为活性苷元形式使小肠吸收,促进异黄酮生物功能的发挥。因此,研究益生菌对大豆异黄酮的降解机制,筛选高效的产β-葡萄糖苷酶益生菌菌株,不仅可以提高大豆异黄酮在人体内的吸收率,充分发挥大豆异黄酮的生物保健作用,还可以促进肠道内有益菌群的生长,有益人体健康。
3.1 双歧杆菌属
双歧杆菌属是肠道菌群中的主要益生菌菌群之一,目前报道的产β-葡萄糖苷酶能力较强的双歧杆菌有:Bifidobacteriu long um、B.bifidum、B.adolescentis、B.breve、B.infantis、B.lactis、 B.pseudocatenulatum、B.animalis、B.longum、B.pseudolongum、B.thermophilum[4,19,22,27]等。
Raimondi等[27]研究了双歧杆菌属8个不同菌种下的22个菌株在含大豆苷(20mg/L)的MRS培养基内对大豆苷的生物转化作用,发现在7d的培养时间内,除B.longum MB220和B.longum MB224以外,其他菌株均可以水解大豆苷,其中 B.adolescentis MB116在生长稳定期早期表现了最高的酶活,为0.92U/mg。Tsangalis等[4]对双歧杆菌属B. pseudolongum、B. longum-a、B. longum-b、B. animalis和B. infantis 5个菌种在不同培养基中的产β-葡萄糖苷酶能力进行了比较,实验发现B.longum-b在MRS-glu中培养24h时呈现了最高的酶活(4.625U/mg)。但该菌种对培养基的要求很高,在其他培养基如MRS-lac、MRS-raf中不能产β-葡萄糖苷酶,在豆奶中生长48h后,产β-葡萄糖苷酶量仍然很少,对大豆异黄酮糖苷的转化率较低,且该菌种不能将大豆苷元代谢为雌马酚。最近,Avila等[28]报道了双歧杆菌中产β-葡萄糖苷酶能力较强的菌株B.lactis BB-12,该菌株在MRS培养基中37℃培养18h后酶活高达20.10U/mg。
双歧杆菌菌株水解大豆异黄酮糖苷的能力是普遍存在的,其产β-葡萄糖苷酶能力因菌株而异,表现出一定的种间差异性。Otieno等[7]对双歧杆菌等发酵豆奶后在储藏期内不同温度下β-葡萄糖苷酶的酶活稳定性进行了研究。但是对于该菌属产酶的生化表征尚未见报道,有待进一步研究。
3.2 乳酸杆菌属
乳酸杆菌属是另外一类主要的益生菌,同时与双歧杆菌一样,也是公认的具产β-葡萄糖苷酶能力的菌群。目前报道的产β-葡萄糖苷酶能力较强的乳酸杆菌有:Lactobacillus paraca sei subsp.paraca sei、L.gasseri、L.acidophilus、L.casei、L.rhamnosus、L.reuteri、L.plantarum、L.delbrueckii[29-32]等。
Marazza等[32]从乳酸杆菌属下63个菌株中筛选出了产酶能力较强的L.rhamnosus CRL981,该菌株在MRS培养基中培养18h后,检测到β-葡萄糖苷酶的酶活为22.93U/mg。该菌株在豆奶培养基中生长12h后,能够将豆奶中的大豆异黄酮糖苷基本水解完全。由此说明该菌株不论是在MRS培养基中还是在豆奶培养基中的,生长代谢速度都很快,对培养基种类的依赖性较小。该作者同时对该菌株产β-葡萄糖苷酶的最佳条件和储藏稳定性进行了研究,发现该菌株产酶的最佳pH值为6.4,最适温度为42℃,在4℃和-20℃条件下储藏25d后,仍然可以保留72%的酶活。
L.rhamnosus CRL981产酶能力强,生长代谢速度快,对培养基的依赖性小,且在较低温度(4℃和-20℃)下保持了较好的酶活稳定性,将其用于发酵豆奶生物转
化大豆异黄酮糖苷可以大大提高产品的营养价值,有着很好的应用前景。
双歧杆菌和乳酸杆菌属菌株产酶能力大小往往与菌种、培养基种类、培养温度、发酵时间等相关。Donkor等[33]比较了L.acidophilus L10、B.lactis B94和L.casei L26在37℃发酵豆奶48h的产酶能力,发现3个菌株的产酶能力大小顺序为L.acidophilus L10>B.lactis B94>L.casei L26,这与Otieno等[31]得到的结论一致。Pyo等[34]研究了37℃条件下L.plantarum 00144、L.delbrueckii 01181、B.breve K-101和B.thermophilum 00748在豆奶培养基中48h内的生长情况,发现24h后,乳酸杆菌L.plantarum 00144和L.delbrueckii 01181进入生长稳定期,此时酶活最高,而双歧杆菌B.breve K-101和B.thermophilum 00748生长相对滞后,且24h时未达到最高酶活。在豆奶培养基中,双歧杆菌生长速率低于乳酸杆菌的原因是前者以豆奶中的α-半乳糖基低聚糖(包括水苏糖和棉子糖)作为生长底物,而后者的生长底物是多聚或低聚糖。另外,双歧杆菌与乳酸杆菌的产β-葡萄糖苷酶的特性也不相同,大多数的双歧杆菌主要产胞内酶,而乳酸杆菌主要产胞外酶。双歧杆菌与乳酸杆菌的比较见表2。

表2 双歧杆菌与乳酸杆菌的比较Table 2 Comparison betweenBifidobacteriaandLactobacilia
对于单一菌株来说,在培养基内生长越好,酶活越高,但其对大豆异黄酮糖苷的水解效果还取决于酶水解的条件,这就要求筛选出的菌株的最适生长条件要与酶水解的最适条件相吻合。因此,产酶能力高低是衡量菌株水解大豆异黄酮糖苷的一个重要指标,但产酶能力最高的菌株不一定是最佳的发酵豆奶菌株,对综合影响因素的评价仍有待进一步研究。
4 展 望
随着大豆异黄酮苷元具有的诸多有益生物活性正逐渐被人们认识,富含大豆异黄酮活性苷元的保健食品有着很好的市场前景。利用产β-葡萄糖苷酶能力强的益生菌菌株发酵豆奶转化豆奶中的大豆异黄酮糖苷为活性苷元,该发酵过程简单,利于工业化,而益生菌本身有益人体肠道健康,应用于豆奶产品中丰富了发酵豆制品的种类,提高了豆奶的营养保健价值。另外,发酵豆奶与发酵牛奶相比,风味独特,价格低廉,胆固醇和饱和脂肪含量低,且适宜“乳糖不耐症”人群饮用,因而,富含益生菌的发酵豆奶作为一种新型发酵产品必将受到广大消费者的欢迎。
[1]高荣海, 张春红, 赵秀红, 等. 大豆异黄酮研究进展[J]. 粮食与油脂, 2009(5)∶ 1-4.
[2]NAGATA C, TAKATSUKA N, KURISU Y, et al. Decreased serum total cholesterol concentration is associated with high intake of soy products in Japanese men and women[J]. Journal of Nutrition, 1998, 128(2)∶ 209-213.
[3]SETCHELL K D R, CASSID A. Dietary isoflavones∶ biological effects and relevance to human health[J]. Journal of Nutrition, 1999, 129(3)∶758S-767S.
[4]TSANGALIS D, ASHTON J F, MCGILL A E, et al. Enzymic transformation of isoavone phytoestrogens in soymilk byβ-glucosidase producing bidobacteria[J]. Journal of Food Science, 2002, 67∶ 3104-3113.
[5]KING R A, BIGNELL C M. Concentrations of isoflavone phytoestrogens and their glucosides in Australian soya beans and soya foods[J]. Australian Journal of Nutrition and Dietetics, 2000, 57(2)∶ 70-78.
[6]张逊, 姚文, 朱伟云. 肠道大豆异黄酮降解菌研究进展[J]. 世界华人消化杂志, 2006, 14(10)∶ 973-978.
[7]OTIENO D O, ASHTON J F, SHAH NP. Stability ofβ-glucosidase activity produced by Bifidobacterium and Lactobacillus spp. in fermented soymilk during processing and storage[J]. Journal of Food Science, 2005, 70(4)∶ 236-241.
[8]HSIEH M C, GRAHAM T L. Partial purification and characterization of soybeanβ-glucosidase with high specificity towards isoflavone conjugates [J]. Phytochemistry, 2001, 5∶ 995-1005.
[9]SUZUKI H, WATANABE R, FUKUSHIMA Y, et al. An isoflavone conjugate-hydrolyzingβ-glucosidase from the roots of soybean (Glycine max) seedlings[J]. Journal of Biological Chemistry, 2006, 281(40)∶30251-30259.
[10]李远华. β-葡萄糖苷酶的研究进展[J]. 安徽农业大学学报, 2002, 29(4)∶ 421-425.
[11]谢爽. β-葡萄糖苷酶在食品增香中的应用[J]. 中外食品, 2004(12)∶44-45.
[12]CHOI Y B, KIM K S, RHEE J S. Hydrolysis of soybean isoflavone glucosides by lactic acid bacteria[J]. Bitechnology Letters, 2003, 24∶2113-2116.
[13]王云, 曾沃坦. 黑曲霉 Aspergillus niger S菌株所产β-葡萄糖苷酶的纯化和酶学性质[J]. 中国科学院研究生院学报, 2009, 26(2)∶ 274-279.
[14]赵林果, 夏文静, 游丽金, 等. 黑曲霉胞内β-葡萄糖苷酶分离纯化及其性质的研究[J]. 现代化工, 2008(10)∶ 38-41.
[15]谢宇, 尚晓娴, 胡金刚. β-葡萄糖苷酶纯化及酶学性质研究[J]. 江西农业大学学报, 2008, 30(3)∶ 521-524.
[16]陈红漫, 赵璐. 芽孢杆菌β-葡萄糖苷酶的分离纯化及特性研究[J].河北农业大学学报, 2009, 32(3)∶ 39-45.
[17]YIN Lijun, LI Lite, LIU Huan, et al. Effects of fermentation temperature on the content and composition of isoflavones andβ-glucosidase activity in sufu[J]. Biosci Biotechnol Biochem, 2005, 69(2)∶ 267-272.
[18]KAYA M, ITO J, KOTAKA A, et al. Isoflavone aglycones production from isoflavone glycosides by display ofβ-glucosidase from Aspergil-
lus oryzae on yeast cell surface[J]. Appl Microbiol Biotechnol, 2008, 79∶ 51-60.
[19]CHUN J, JEONG W J, KIM J S, et al. Hydrolysis of isoflavone glucosides in soymilk fermented with single or mixed cultures of Lactobacillus paraplantarum K M, Weissella sp. 33, and Enterococcus faecium 35 isolated from humans[J]. Journal of Microbilogy and Biotechnology, 2008, 18(3)∶ 573-578.
[20]徐茂军. β-葡萄糖苷酶对豆奶及豆奶粉中大豆异黄酮糖苷化合物的转化作用研究[J]. 中国食品学报, 2005(12)∶ 28-32.
[21]汪海波, 磺爱妮, 李飞, 等. β-葡萄糖苷酶水解、分离纯化大豆异黄酮苷元工艺研究[J]. 食品科技, 2008(4)∶ 114-120.
[22]OTIENO D O, SHAH N P. A comparison of changes in the transformation of isoflavones in soymilk using varying concentrations of exogenous and probiotic-derived endogenousβ-glucosidases[J]. Journal of Applied Microbiology, 2007, 103∶ 601-612.
[23]潘利华, 罗建平, 查学强, 等. 海藻酸钠固定化β-葡萄糖苷酶的制备及其性质研究[J]. 合肥工业大学学报, 2007, 30(10)∶ 1332-1335.
[24]吴定, 鞠兴荣, 刘长鹏, 等. β-葡萄糖苷酶的固定化及其用于制备大豆异黄酮的研究[J]. 食品科学, 2009, 30(8)∶ 25-28.
[25]TSUNCHIHASHI R, SAKAMOTO S, KODERA M, et al. Microbial metabolism of soy isoflavones by human intestinal bacterial strains[J]. Journal of Natural Medicines, 2008, 62∶ 456-460.
[26]TSANGALIS D, WILCOX G, SHAH N P, et al. Urinary excretion of equol by postmenopausal women consuming soymilk fermented by probiotic bifidobacteria[J]. European Journal of Clinical Nutrition, 2007, 61(3)∶ 438-441.
[27]RAIMONDI S, RONCAGLIA L, LUCIA D M, et al. Bioconversion of soy isoflavones daidzin and daidzein by Bifidobacterium strains[J]. Appl Microbiol Biotechnol, 2009, 81∶ 943-950.
[28]AVILA M, HIDALGO M, MORENO C S, et al.Bioconversion of anthocyanin glysides by Bifidobacteria and Lactobacillus[J]. Food Research International, 2009, 42∶ 1453-1461.
[29]TSUCHIHASHI R, SAKAMOTO S, KODERA M, et al. Microbial metabolism of soy isoavones by human intestinal bacterial strains[J]. Journal of Natural Medicine, 2008, 62∶ 456-460.
[30]OTIENO D O, ASHTON J F, SHAH N P. Evaluation of enzymic potential for biotransformation of isoflavone phytoestrogen in soymilk by Bifidobacterium animalis, Lactobacillus acidophilus and Lactobacillus casei[J]. Food Research International, 2006, 39∶ 394-407.
[31]CHOI Y B, KIM K S, RHEE J S. Hydrolysis of soybean isoflavone glucosides by lactic acid bacteria[J]. Biotechnology Letters, 2002, 24∶2113-2116.
[32]MARAZZA J A, GARRO M S, GIORI G S. Aglycone production by Lactobacillus rhamnosus CRL981 during soymilk fermentation[J]. Food Microbiology, 2009, 26∶ 333-339.
[33]DONKOR O N, SHAH N P. Production ofβ-glucosidase and hydrolysis of isoflavone phytoestrogens by Lactobacillus acidophilus, Bifidobacterium lactis, and Lactobacillus casei in soymilk[J]. Food Microbiology and Safety, 2008, 73(1)∶ 15-20.
[34]PYO Y H, LEE T C, LEE Y C. Enrichment of bioactive isoflavones in soymilk fermented withβ-glucosidase-producing lactic acid bacteria [J]. Food Research International, 2005, 38∶ 551-559.
Research Progress in Biotransformation of Soybean Isoflavone Glycosides by β- Glucosidase and Probiotics
HAN Ting1,CHENG Gang2,LIU Ying1,HUANG Wen1,*
(1. College of Food Science and Technology, Huazhong Agricultural University,Wuhan 430070, China;2. College of Life Science, South-Central University for Nationalities, Wuhan 430074, China)
The isoflavone glycosides in soybeans and their prepared products are difficult to digest and absorb in human body. In current paper, research progress in biotransformation of soybean isoflavone glycosides to improve bioavailability through β-glucosidase at home and aboard has been reviewed. The transformation of isoflavone glucosides by exogenous β-glucosidase and β-glucosidase-producing probiotics has been discussed in detail.
soybean isoflavone;β-glucosidase;hydrolysis;probiotics
TS201.2
A
1002-6630(2010)09-0333-05
2009-12-15
韩婷(1986—),女,硕士研究生,研究方向为天然产物化学。E-mail:hanting11623@163.com
*通信作者:黄文(1968—),女,副教授,研究方向为天然产物化学。E-mail:huangwen@mail.hzau.edu.cn

