HP-20大孔吸附树脂分离纯化儿茶素EGCg的效果
龚志华,黄甜,庞月兰,肖文军*
(湖南农业大学 a.园艺园林学院;b.茶学教育部重点实验室,湖南 长沙 410128)
茶多酚对茶叶品质的影响最显著[1].自20世纪90年代后,随着“绿色化学”口号的提出,越来越多的学者致力于对茶多酚生产过程的精细化,其研究多集中于茶多酚的主体部分儿茶素(占茶多酚总量的70%~80%),尤其是儿茶素中的表没食子儿茶素没食子酸酯(EGCg).
EGCg是茶叶中的主要儿茶素之一,占茶多酚总量的40%~50%,作为天然抗氧化剂和自由基清除剂,具有明显的抗衰老、抗突变、防癌抗癌、预防心血管疾病、防辐射等多种生物学活性,广泛运用于食品加工、医药保健和日用化工领域[2-5].是酯型儿茶素单体EGCg的分离纯化,成为儿茶素分离、纯化与临床应用研究的焦点.
分离儿茶素单体的过程[6]主要为:提取茶多酚粗品(TP)→分离儿茶素→纯化儿茶素单体.目前分离制备儿茶素单体的方法主要有柱色谱法[7]、柱色谱预分离-制备型 HPLC纯化法[8]、有机溶剂富集-柱色谱纯化、高效液相色谱法[9]、高速逆流色谱法(HSCCC)[10]、沉淀-吸附法[11]、有机溶剂萃取法[12]等,但在降低成本、提高得率、保持产物的天然活性以及实现工业化等方面依然存在技术瓶颈.
笔者以EGCg含量为35.52%的儿茶素粗提物为原料,应用近年出现的新型大孔吸附树脂HP-20对EGCg进行分离纯化试验,并对相关技术参数进行了优化筛选,以期为工业化生产制备高纯EGCg提供新途径.
1 材料与方法
1.1 材 料
70%小叶儿茶素(EGCg含量为31.52%,湖南金农生物资源股份有限公司产品);HP-20、D202、XDA-1、D201、D900、LSA-7大孔吸附树脂(长沙市化学试剂玻璃仪器有限公司产品).
1.2 方 法
(1) 树脂预处理.大孔吸附树脂上柱前,分别清洗干净,即采用95%乙醇浸泡充分溶胀→95 %乙醇洗至洗出液加适量水无白色浑浊现象→去离子水洗尽乙醇后,以4倍体积3%NaOH溶液浸泡4 h→去离子水洗至pH值为中性→4倍体积3%HCl溶液浸泡4 h→去离子水洗至pH值中性.
(2) 原料液制备.按照每次试验的上样量将儿茶素粗提物溶于蒸馏水,配制成质量分数为20%的水溶液.
(3) 不同大孔吸附树脂的静态吸附与解吸效果比较.将经预处理的6种大孔吸附树脂去表面水,各精密称取1 g,置于具塞磨口锥形瓶中,分别加入50 mL的原料液,摇床振荡24 h,过滤,检测滤液中EGCg的含量,计算单位质量树脂对EGCg的吸附量,并将吸附饱和的树脂再各用50 mL 95%乙醇解吸24 h,检测解吸液中EGCg的含量,计算其解吸率,筛选对EGCg吸附与解吸具有最佳效果的树脂.
(4) 最佳吸附与解吸效果树脂的等梯度洗脱条件优化.以乙醇为洗脱剂,设计乙醇体积分数(20%、40%、60%等3个水平)、洗脱流速(0.5、1.0、2.0 BV/h等3个水平)、上样量(0.2、0.6、1.8 g等3个水平)、洗脱体积(2、4、6等3个水平)的正交试验[13-15],优化筛选最佳树脂的等梯度洗脱参数.
(5) 最佳吸附与解吸效果树脂的连续梯度洗脱条件优化.以EGCg得率与纯度为考察指标,以上述试验中最佳等梯度洗脱技术参数为基础,保持流速、上样量、洗脱体积不变,分别以30%、35%、40%、45%、50%乙醇进行连续梯度洗脱,分段收集洗脱液至流出液无色时,换下一梯度进行洗脱,筛选连续梯度洗脱的最佳乙醇体积分数.以最佳乙醇体积分数、洗脱流速、上样量、洗脱体积为操作参数,将原料液重新上柱进行洗脱,每收集0.5 BV洗脱液作为一个样品,筛选EGCg得率、纯度综合效果较好的收集段.
EGCg含量采用高效液相色谱法测定.色谱柱:Nova-Pak C18(3.9 mm×150 mm);流速:1.0 mL/min;柱温:35 ℃;检测波长:278 nm;进样量:10 μL;流动相:采用二元梯度洗脱,A相为超纯水,B相为有机相(N,N-二甲基甲酰胺∶甲醇∶冰醋酸 = 80∶4∶3);梯度条件:B相,0.01 min时17%、15 min时20%、28 min时32%、34 min时32%、36 min时17%、40 min时17%.
水浸出物含量测定采用全量法[16].
EGCg纯度、EGCg得率计算参照文献[15]方法.
数据统计与分析采用正交设计助手IIV3.1.1软件进行.
2 结果与分析
2.1 不同大孔吸附树脂对 EGCg的静态吸附与解吸效果
HP-20、D202、XDA-1、D201、D900、LSA-7等6种大孔吸附树脂对EGCg的吸附量和洗脱率如表1所示.由表1可知,单位质量的HP-20大孔吸附树脂对EGCg具有较好的吸附与解吸效果,其静态解吸量达46.47 mg/g,在6种树脂中效果最佳.

表1 不同树脂对EGCg的静态吸附量与静态洗脱率Table 1 The static adsorption capacity and the static desorption percentage of EGCg by different resins
2.2 HP-20树脂的等梯度洗脱条件优化
HP-20对EGCg的等梯度洗脱正交试验结果如表2所示.结果表明,以EGCg的得率和纯度作为考察指标,对EGCg洗脱得率影响的显著程度大小依次为乙醇体积分数、上样量、洗脱流速、洗脱体积,并以1.8 g上样量、2 BV/h流速、40%乙醇、洗脱体积2 BV为最佳组合,在此工艺条件下,EGCg的得率与纯度分别为95.22 %和55.92 %.
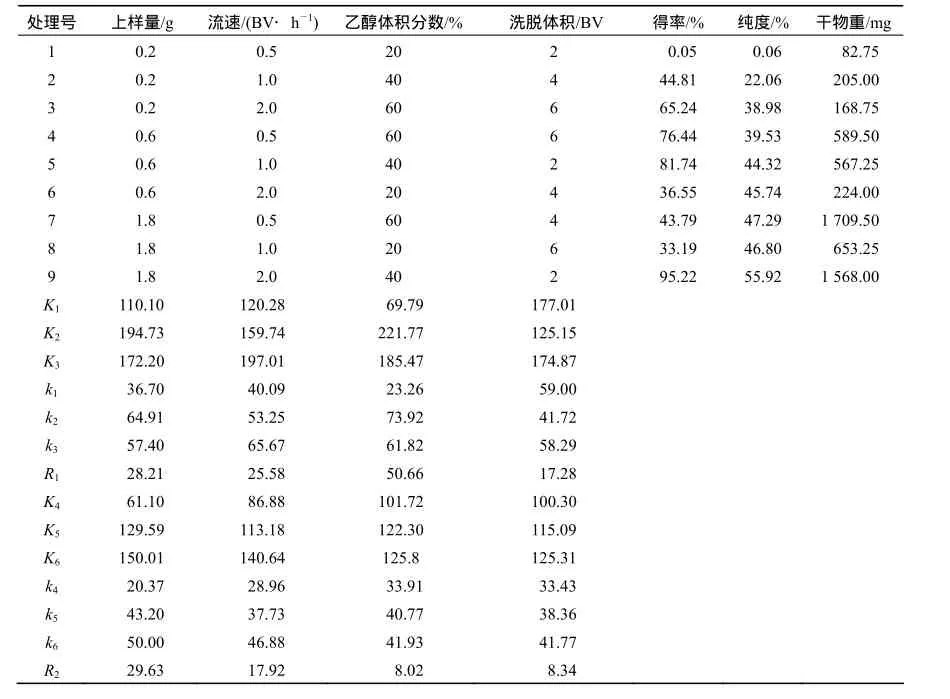
表2 正交试验中EGCg得率与纯度的极差分析Table 2 The poor analysis of EGCg yield rate and purity in orthogonal experiment
2.3 HP-20树脂的连续梯度洗脱条件优化
2.3.1 乙醇体积分数的筛选
结果(表3)表明,采用30%乙醇洗脱并收集1~5号样,几乎可以把EGCg完全洗脱下来,其中3号样的纯度和得率最高,可达68.28%和45.71%.同时,EGCg主要集中在0.6~2.5 BV段(图1),其后的洗脱液中 EGCg纯度及得率均较低,因此收集30%乙醇洗脱液中的0.6~2.5 BV体积段,可得到较高纯度及含量的EGCg.

表3 不同体积分数乙醇洗脱EGCg得率和纯度Table 3 Effect of different ethanol concentration on the yield rate and purity of EGCg

图1 30%乙醇梯度洗脱EGCg纯度及得率Fig.1 The curve of EGCg’s yield rate and purity in gradient elution by 30% ethanol
2.3.2 EGCg得率、纯度综合效果较好收集段筛选
表4结果表明,在30%乙醇,125 mL树脂上样1.8 g,2 BV/h流速的条件下,收集的第3个样液,,EGCg纯度最高,可达71.55%,得率为28.14%.第2个收集样液的EGCg纯度与得率分别为65.09 %和43.94%,因此合并两个收集段的样液,EGCg的纯度与得率分别为68.32%和72.08%.将所得合并液浓缩、结晶,可得到相应的EGCg高纯品,符合工业化高效生产高纯EGCg的技术要求.
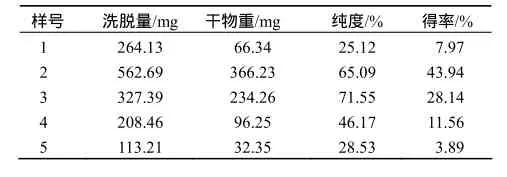
表4 30%乙醇洗脱分步收集EGCg的得率与纯度Table 4 The extraction yield and purity of EGCg collected step by step by 30% ethanol
3 结 论
HP-20大孔树脂具有较好的分离纯化 EGCg的性能,其最优工艺技术参数为:柱体积为125 mL分离纯化EGCg时,上样量1.8 g、30%乙醇、流速2 BV/h、洗脱体积2 BV,收集1~2 BV体积段的洗脱液,EGCg的纯度和得率分别达 68.32%和72.08%,具有较好的工业化应用价值.
[1] 宛晓春,王泽农,汪琢成,等.茶叶生物化学[M].北京:中国农业出版社,2003.
[2] 梅全喜,毕焕新.现代中药药理手册[K].北京:中国中医药出版社,1998.
[3] Sakata R,Ueno T,Nakamttra T,et a1.Green tea polyphenol epigal catechin-3-gallate inhibits platelet derived growth factor induced proliferation of human hepatic stellate cell line LI90[J].J Hepatol, 2004,40(1):52-59.
[4] Frei B,Higdon J.Antioxidant activity of tea polyphenols invivo:Evidence from animal studies[J].J Nutr,2003,133:3275-3284.
[5] 方芳,崔志清,韩永晶.茶儿茶素的药效研究概况[J].中草药,2000,16(6):124-125.
[6] 汪茂田,谢培山,王忠东,等.天然有机化合物提取分离与结构鉴定[M]. 北京:化学工业出版社, 2002.
[7] 陶容达.茶多酚的制备和应用进展[J].化学世界,1994,12(2):64-67.
[8] 于海宁,沈生荣,臧荣春,等.茶多酚中儿茶素类的HPLC分析方法学考察[J].茶叶科学, 2001, 21(1):61-66.
[9] Zhong S A,Zhou C S,Yang J Y.Separation and preparation of ester catechins by high performance liquid chromatography[J].Chem World,2003,34(5):237-240.
[10] 杜琪珍,李名君,陈启坤.高速逆流色谱法分离茶叶中的儿茶素[J].色谱,1996,14(4):20-21.
[11] 葛宜掌,金红.茶多酚的离子沉淀提取法[J].应用化学,1995,12 (2):107-109.
[12] 董文宾,胡英,周玲.有机溶剂法制备茶多酚的工艺研究[J].食品工业科技,2002,9(23):44-47.
[13] 王霞,高丽娟,林炳昌.表没食子儿茶素没食子酸酯EGCg的分离与制备[J].食品科学,2005,26(9): 242-245.
[14] 张盛,刘仲华,黄建安,等.吸附树脂法制备高纯儿茶素的研究[J].茶叶科学,2002,22(2 ):125-130.
[15] 龚雨顺,刘仲华,黄建安,等.大孔吸附树脂分离茶儿茶素和咖啡因的研究[J].湖南农业大学学报:自然科学版,2005,31(1):50-51.
[16] GB/T8305─87 茶水浸出物测定[S].
英文编辑:胡东平

