驱铅益智口服液的安全性毒理学评价
韩长城 牛秀丽 宋波 张慧博
由于工农业生产和日常生活中含铅物质的广泛应用,铅污染已经成为危害人类健康的严重社会问题[1]。铅是一种有毒的重金属,当体内铅含量超过一定水平时,就会造成肝脏、肾脏、神经系统、生殖系统等多脏器损害。统计学资料显示我国铅中毒的发生率已经超过 30%[2]。值得注意的是,低浓度血铅水平可严重婴影响婴幼儿和儿童的神经和智力发育[3],铅中毒已成为危害儿童健康的头号杀手。开发安全有效的驱铅产品,减少铅中毒的危害已成为国内外学者研究的热门课题。本研究的主要目的在于通过一系列急性毒性和遗传毒性试验,探讨驱铅益智口服液(以下简称口服液)的安全性。
1 材料与方法
1.1 实验动物 清洁级昆明小鼠(合格证号:医动字第 04056号)和SD大鼠(合格证号:医动字第 04057号)由河北医科大学实验动物中心提供。环境温度 20~25℃,相对湿度范围60%~70%,适应性饲养 7 d。
1.2 主要试剂 口服液由河北医科大学营养教研室提供。其主要成分为葵胶、阿胶、乳酸钙和 NaFeEDTA等。9-芴酮(9-Flu)、叠氮钠(NaN3)、丝裂霉素 C(MMC)、2-乙酰氨基芴(2-AF)、1,8-二羟基蒽醌(1,8-HAQ)均为国产分析纯。
1.3 主要仪器 上海精密科学仪器有限公司 JY 10001型电子天平;梅特勒-托利多仪器(上海)公司 AB204-N型电子分析天平。Abacus全自动血液分析仪。日立 7600全自动生化分析。德国 LEICA公司 AO切片机。日本Olympus光学显微镜。
1.4 急性毒性试验 健康昆明种小鼠 48只,雌雄各半,体重18~22 g。随机分为 3组,每组雌、雄各 8只。采用霍恩氏法,试验前禁食过夜,不限制饮水。给药剂量分别为 2.15、4.16和10 g/kg,以 0.4ml/20 g容量空腹灌胃,观察 14 d。记录动物一般状况、中毒症状和死亡情况。
1.5 遗传毒性试验
1.5.1 Ames试验:选用四株组氨酸营养缺陷型鼠伤寒沙门氏菌菌株,分别为 TA 97a、TA 98、TA 100、TA 102。 采用平板掺入法。用 TA 100菌株的非代谢活化系统进行预试验,5 000μg/皿剂量时未出现明显的增菌和抑菌现象,故正式试验时选择试验浓度分别为 8、40、200、1 000、5 000 μg/皿 5个剂量组,同时设蒸馏水阴性对照组和 9-Flu、NaN3、MMC、2-AF、1,8-HAQ阳性对照组,在加和不加 S9条件下进行试验。相同实验条件重复 1次。
1.5.2 小鼠骨髓嗜多染红细胞微核试验:健康昆明种小鼠 80只,体重 25~28 g,随机分为 5组,每组雌、雄各 8只:阴性对照组(蒸馏水)、口服液低剂量 (1 250 mg/kg)、中剂量(2 500mg/kg)、高剂量(5 000mg/kg)组、阳性对照组 [环磷酰胺(CTX 50 mg/kg)],以 0.4 ml/20 g容量灌胃 2次(间隔24 h),第 2次灌胃后 6 h取胸骨制片镜检。
1.5.3 小鼠精子畸形试验:雄性昆明种小鼠 40只,体重25~28 g。随机分为 5组,每组 8只:分组和给药途径同骨髓嗜多染红细胞微核试验。连续 5 d,1次/d,于首次灌胃后第 35天取双侧副睾制片镜检,计数精子畸形率。
1.6 大鼠 30 d喂养试验 选健康 SD大鼠 80只,雌雄各半,体重 180~200g。随机分为 4组,每组雌、雄各 10只:正常对照组和低(1 250mg/kg)、中(2 500mg/kg)、高 (5 000mg/kg)剂量口服液组。正常对照组喂基础饲料,实验组连续 30 d喂饲含受试物的饲料,自由进食、饮水。每天观察并记录动物的一般表现、行为、中毒症状和死亡情况,每周记录体重和进食量并计算食物利用率 (food utilization ratio,FUR),实验期末禁食 16h。眼球取血进行血象、血生化指标检测。断头处死,观察脏器大体形态,取肝、脾、肾、睾丸、卵巢称重并计算脏体比,同时留取肝、肾、脾、胃、肠、睾丸、卵巢组织,4%甲醛固定,石蜡包埋,HE染色,病理组织学观察。
1.7 统计学分析 应用 SPSS 11.5统计软件,计量资料以±s表示,两样本均数的比较采用Kruskal-Wallis Test进行非参数检验,计数资料采用 χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 急性毒性试验 小鼠经口给予不同剂量口服液后(最高剂量为 10g/kg),动物活动、进食、行为等未见异常,未出现中毒或死亡,得小鼠经口 LD50>10.0g/kg。见表 1。

表 1 驱铅口服液急性毒性试验结果 n=8
2.2 遗传毒性试验
2.2.1 Ames试验结果:在本实验的各浓度下,无论加与不加S9的混合液试验,口服液各剂量水平的平均回变菌落数均未超过阴性对照组 2倍,呈阴性反应;阳性对照组的平均回变菌落数均为阴性对照的 2倍以上,呈明显阳性反应。见表 2。
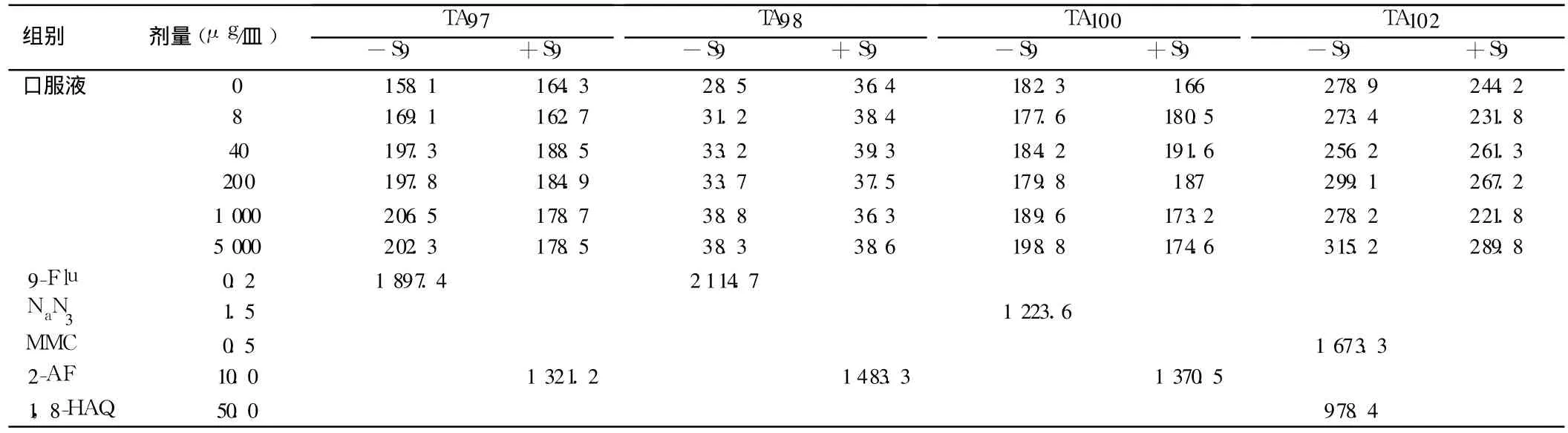
表 2 驱铅益智口服液 Ames实验结果
2.2.2 小鼠骨髓嗜多染红细胞微核率变化:口服液各剂量组雄性、雌性小鼠的骨髓嗜多染红细胞微核率与阴性对照相比差异均无统计学意义;阳性对照组微核率显著高于 3种剂量口服液组和阴性对照组(P<0.01)。见表 3。
2.2.3 小鼠精子畸形率的变化:口服液各剂量组雄性小鼠的精子畸形发生率与阴性对照相比差异均无统计学意义(P>0.05);阳性对照组畸形率显著高于 3种剂量口服液组和阴性对照组(P<0.01)。见表 4。

表 4 小鼠精子畸形率变化比较 n=8
2.3 大鼠30 d喂养试验结果
2.3.1 大鼠一般状况的变化:观察期内大鼠活动、进食、行为等未见异常,均未出现中毒症状和死亡情况。口服液各剂量组的体重和 FUR变化与正常对照组比较差异无统计学意义(P>0.05)。见表 5。
表5 口服液对大鼠体重和食物利用率的影响n=10,±s

表5 口服液对大鼠体重和食物利用率的影响n=10,±s
组别 初始体重(g) 第 1周体重(g) 第 2周体重(g) 第 3周体重(g) 第 4周体重(g) 食物利用率(%)雄正常对照组 112±10 146±10 198±15 248±29 323±30 26.6±6.2低剂量组 116±10 152±18 191±22 239±35 319±36 27.0±7.5中剂量组 114±11 151±22 190±22 234±31 308±33 25.4±6.6高剂量组 117±10 159±17 193±24 246±30 313±31 25.1±4.3雌正常对照组 105±8 133±12 169±14 204±20 268±20 22.5±2.3低剂量组 104±8 130±12 162±19 196±26 256±27 23.2±4.4中剂量组 104±7 135±12 163±13 202±28 277±32 21.8±2.9高剂量组 102±10 130±15 157±13 184±23 246±33 22.0±2.2
2.3.2 口服液对大鼠血液学指标的影响:口服液各剂量组大鼠外周血血红蛋白(Hb)、红细胞计数(RBC)、白细胞计数(WBC)与正常对照组比较差异无统计学意义 (P>0.05)。见表 6。
表 6 口服液对大鼠外周血常规指标的影响 n=10,±s
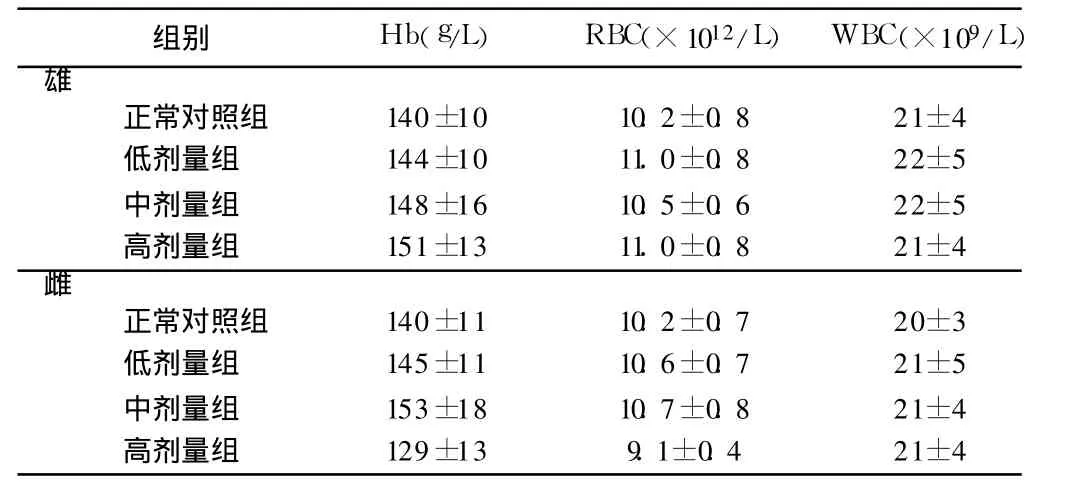
表 6 口服液对大鼠外周血常规指标的影响 n=10,±s
组别 Hb(g/L) RBC(×1012/L) WBC(×109/L)雄正常对照组 140±10 10.2±0.8 21±4低剂量组 144±10 11.0±0.8 22±5中剂量组 148±16 10.5±0.6 22±5高剂量组 151±13 11.0±0.8 21±4雌正常对照组 140±11 10.2±0.7 20±3低剂量组 145±11 10.6±0.7 21±5中剂量组 153±18 10.7±0.8 21±4高剂量组 129±13 9.1±0.4 21±4
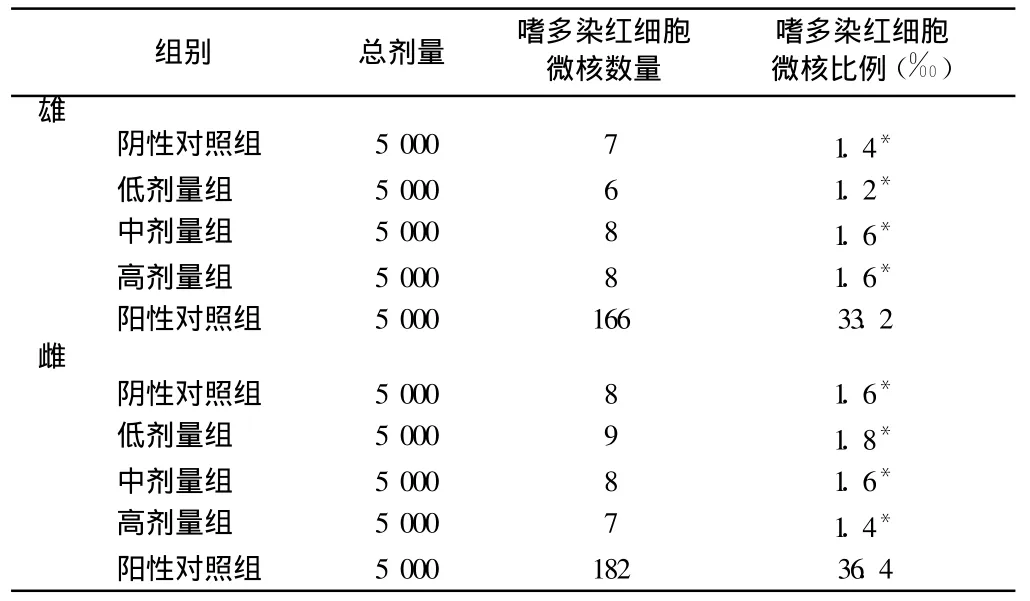
表 3 小鼠骨髓嗜多染红细胞微核率变化比较 n=8
表7 口服液对大鼠试验末期血液生化指标的影响n=10,±s

表7 口服液对大鼠试验末期血液生化指标的影响n=10,±s
组别 ALT(U/L) BUN(mmoL/L)Cr(mmoL/L) TC(mmoL/L) TG(mmoL/L) BG(mmoL/L) TP(g/L) A lb(g/L)雄正常对照组 29±5 4.3±0.3 57±6 2.2±0.2 0.71±0.15 5.2±0.3 71±4 40.3±3.7低剂量组 30±4 4.2±0.4 57±6 2.1±0.4 0.70±0.16 5.1±0.4 72±5 40.5±3.2中剂量组 29±4 4.4±0.4 57±4 2.1±0.3 0.71±0.15 5.0±0.5 70±4 40.1±2.8高剂量组 30±5 4.3±0.5 58±4 2.3±0.3 0.70±0.16 5.2±0.4 72±5 41.2±3.6雌正常对照组 28±4 4.2±0.4 58±5 2.3±0.3 0.69±0.14 5.2±0.3 73±4 41.7±3.1低剂量组 28±4 4.3±0.3 58±4 2.2±0.4 0.70±0.15 5.0±0.4 71±4 41.6±2.2中剂量组 29±3 4.3±0.4 60±4 2.3±0.4 0.73±0.12 4.9±0.6 71±5 42.1±3.5高剂量组 29±5 4.5±0.4 59±5 2.2±0.3 0.72±0.14 5.1±0.3 73±4 41.4±3.5
2.3.3 口服液对血液生化指标的影响:实验末期,口服液各剂量组大鼠的谷丙转氨酶(ALT)、尿素氮(BUN)、肌酐(Cr)、总胆固醇(TC)、三酰甘油(TG)、血糖(BG)、总蛋白(TP)、白蛋白(Alb)等生化指标与正常对照组相比差异无统计学意义(P>0.05)。见表 7。
2.3.4 口服液对大鼠脏体比的影响:口服液各剂量组大鼠肝脏、脾脏、肾脏、睾丸和卵巢的脏体比与正常对照组相比差异无统计学意义 (P>0.05)。见表 8。
2.3.5 大鼠病理组织学观察结果:大鼠脏器大体形态学观察
表 8 驱铅益智口服液对大鼠脏体比的影响n=10,±s

表 8 驱铅益智口服液对大鼠脏体比的影响n=10,±s
组别 肝脏 脾脏 肾脏 睾丸卵巢脏体比雄正常对照组 4.56±0.45 0.39±0.07 0.87±0.05 0.11±0.09低剂量组 4.63±0.63* 0.42±0.09* 0.88±0.06* 1.08±0.11*中剂量组 4.39±0.51* 0.38±0.05* 0.85±0.07* 1.04±0.15*高剂量组 4.38±0.74* 0.35±0.08* 0.89±0.08* 1.09±0.08*雌正常对照组 4.41±0.74 0.35±0.08* 0.86±0.07 0.05±0.01低剂量组 4.52±0.45* 0.41±0.12* 0.86±0.09* 0.07±0.01*中剂量组 4.43±0.39* 0.37±0.06* 0.87±0.05* 0.06±0.02*高剂量组 4.52±0.31* 0.38±0.09* 0.88±0.06* 0.06±0.02*
均未发现异常改变。HE染色光镜下观察:正常对照组和中剂量组各有 1只雄性大鼠肝细胞轻度肿胀,肝血窦轻度充血及少数炎细胞浸润,未见肝细胞变性坏死和结构紊乱。其余组织光镜下显示:组织结构清晰,各种细胞形态正常,无异常病理学变化。见图 1。
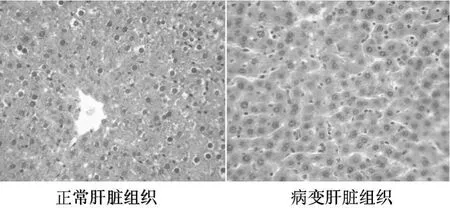
图 1 大鼠肝脏病理学改变(HE×400)
3 讨论
铅是一种不可降解的环境污染物,在环境中可长期蓄积,借助于空气、土壤、水和食物通过呼吸道和消化道两条途径被机体吸收。当铅在体内的蓄积量超过一定水平时,就会对人体的健康产生极大危害,导致多种脏器代谢功能障碍[4]。目前临床上应用的驱铅药物主要是金属络合剂,虽有快速、显著的驱铅效果,但有不宜口服、肝肾毒性以及络合剂与铁、锌等非特异结合致使多种微量元素丢失等诸多不良反应[5]。因此,尽早研究开发安全有效的驱铅产品具有重要的实用价值和社会价值。
QYHOL是天然植物提取物,主要成分为葵胶、阿胶、乳酸钙和 NaFeEDTA等。葵胶属于低酯果胶[6],可选择性与铅结合,避免了传统驱铅药物非选择性络合作用导致的微量元素丢失的弊端。研究表明,铅与钙、铁、锌等在肠道有共同蛋白结合位点,具有竞争性抑制作用,铅暴露可导致多种微量元素吸收减少[7]。阿胶含有多种微量元素和氨基酸,对细胞功能具有支持和保护作用,并可拮抗铅中毒导致的微量元素丢失。本口服液通过增加钙和 NaFeEDTA(一种国际公认的新型的铁强化剂)营养强化[8],竞争性抑制了肠道铅的吸收,提高了驱铅效果。本研究依据《食品安全性毒理学评价程序和方法》(GB 15193.1-2003)的要求,对驱铅益智口服液的安全性和不良反应从以下 3个方面进行了初步评价。
第 1阶段急性毒性试验中,雌雄两性小鼠LD50结果均大于10 g◦kg-1◦bw-1,故不再进行蓄积性试验。根据 LD50剂量分级标准,该口服液属实际无毒级。
第 2阶段进行了遗传毒性试验的研究,由于单项短期诱变试验有各自的局限性,本研究选用了反映基因突变的 Ames试验、反映染色体损害的小鼠骨髓细胞微核试验、反映生殖细胞突变的小鼠精子畸形试验,从多方面探讨被测样品的致突变性。3种试验结果均显示:各剂量水平口服液组试验结果与阴性对照相比差异均无统计学意义,提示在该试验浓度下,口服液无致基因、染色体和生殖细胞突变的作用,说明口服液无遗传毒性作用。
第 3阶段进行了大鼠 30 d喂养试验。本试验采用的低、中、高 3个剂量(分别相当于人体实际摄入量的 100、200、400倍)连续喂养大鼠 30 d,各剂量下大鼠活动、进食、行为等未见异常,均未出现中毒症状和死亡情况,体重和食物利用率正常,说明该口服液对大鼠的正常发育和食物的吸收代谢无显著影响。进一步分析外周血常规及生化指标表明,驱铅益智口服液不影响红细胞、白细胞、肝脏、肾脏、血脂的正常代谢过程,各项观察指标不随剂量的增大和受试时间的延长出现剂量-反应关系。大鼠重要脏器的大体形态学和光镜下组织病理学均未见异常改变。
综上所述,从食品毒理学角度出发,可以认为驱铅益智口服液对人体无毒、无致突变作用,长期应用无脏器不良反应。但需进一步试验研究证实,其是否具有对机体血液、肝脏、神经系统等脏器铅毒性的拮抗作用。
1 Hwang L.Environmental stressorsand violence:lead and polychlorinated biphenyls.Rev Environ Health,2007,22:313-328.
2 Ye X,Wong O.Lead exposure,lead poisoning,and lead regulatory standards in China,1990-2005.Regul Toxicol Pharmacol,2006,46:157-162.
3 Murata K,Iwata T,DakeishiM,etal.Lead toxicity:does the critical level of lead resulting in adverse effects differ between adults and children?J Occup Health,2009,51:1-12.
4 朱传芳,陈津,马洁,等.我国儿童铅中毒的研究现状.职业与健康,2007,23:749-751.
5 肖平,张阳德,方平飞.吸附剂驱铅及对染铅大鼠体内微量元素的影响.中国现代医学杂志,2006,16:1779-1780.
6 Khotimchenko MY,Kolenchenko EA.Efficiency of low-esterified pectin in toxic damage to the liver inflicted by lead treatment.Bull Exp Biol Med,2007,144:60-62.
7 麦剑平,韦拔雄,许启荣.铅对体内其他元素的影响.中国工业医学杂志,2006,19:233-234.
8 陈亚非,罗绮珊,莫启武.NaFeEDTA的络合作用对体内营养素吸收代谢的影响.中国食品添加剂,2006,17:121-123.

