金磁微粒介导的抗六聚组氨酸多克隆抗体的纯化
李淑娟, 牛育鸿
(延安大学西安创新学院, 陕西 西安 710100)
0 前言
六聚组氨酸是一种融合蛋白纯化和检测的常用标签[1-3], Ni2+螯合树脂已被广泛用于六聚组氨酸融合蛋白纯化[4].然而,由于免疫亲和纯化和检测的高选择性,通过抗6×His抗体纯化和检测六聚组氨酸融合蛋白的方法受到很大关注,目前已有商品化的特异性针对6×His的单克隆抗体,但价格都比较昂贵.
金磁微粒是一种新型磁性复合微粒[5], 具有超顺磁性的金磁微粒,含有Fe3O4的核以及金的壳层, 该材料集胶体金对生物分子的快速固定化和磁性颗粒在外磁场中的可分离性能于一体, 在免疫学研究领域显示了巨大的优势.目前,高分子包覆的磁性微粒表面固定蛋白质或抗体已被用于亲和层析研究[6], 但将磁性复合微粒用于小分子融合标签的多克隆抗体制备中载体蛋白抗体去除的研究未见报道.为此,本实验制备了六聚组氨酸多克隆抗体,利用表面固定有KLH的金磁微粒对多克隆抗体中抗载体蛋白KLH抗体进行去除,得到了高纯度的抗小分子6×His的抗体,为研究6×His融合蛋白纯化检测奠定了基础.
1 材料与方法
1.1 材料
动物: 新西兰兔,购于西安交通大学医学院,六聚组氨酸(6×Histidine, 6×His)由西安华辰生物科技有限公司合成,匙孔血蓝蛋白(Keyhole Limpet Hemocyanin, KLH)购自德国MERCK公司,牛血清白蛋白(BSA)、HRP标记的羊抗兔二抗、弗氏不完全佐剂、弗氏完全佐剂等均购自北京鼎国生物技术有限责任公司,1-(3-二甲氨基丙基)-3-亚胺盐酸盐(EDC.HCl)购自美国PIERCE公司,2-(N-吗啉代)乙磺酸(MES)购自美国Sigma公司,金磁微粒(5 mg /mL)购自陕西北美基因股份有限公司.
1.2 方法
1.2.1 抗原的合成
采用EDC法[7]制备偶联物6×His-KLH和6×His-BSA,分别作为免疫原和包被抗原.合成过程为:取2 mg的KLH (BSA)溶于200 μL偶联缓冲液(含0.9 mol/L NaCl的 0.1 mol/L MES,pH 4.5~5)中,接着取2 mg的6×His溶于500 μL偶联缓冲液中,然后将两者混合,在混合液中迅速加入10 mg/mL的EDC 100 μL (偶联BSA和6×His时,加入10 mg /mL的EDC 50 μL),室温反应2 h.
1.2.2 动物免疫
取500 μg 6×His-KLH用生理盐水稀释至0.2 mL,与等体积完全弗氏佐剂混合,于兔颈部皮下多点注射;两周后改用不完全弗氏佐剂进行加强免疫,剂量同前;此后每隔3周加强免疫一次,并于加强免疫后10~12 d从兔耳缘静脉抽血测定其效价,达到要求后,心脏采血收集抗血清.
1.2.3 抗六聚组氨酸多克隆抗体效价测定
抗血清经饱和硫酸铵沉淀法初步纯化后,以6×His-BSA和KLH分别作为包被抗原,采用间接EL ISA法测定效价[8].
1.2.4 金磁微粒介导的多克隆抗体中抗载体蛋白KLH抗体的去除
1.2.4.1 金磁微粒表面KLH的固定化容量测定
取200 μL (5 mg/mL)金磁微粒九等份,经预处理,分别与1 mg/mL KLH溶液100、200、300、400、500、600、700、1 000、2 000 μL混合,置摇床室温反应30 min,在280 nm处测定KLH固定前后的吸光度值,则KLH的固定化效率可表示为:OD280固定前-OD280固定后/OD280固定前.通过上述公式计算KLH的固定化效率,再乘以KLH加入质量,得到其固定化容量.
1.2.4.2 金磁微粒-KLH与多克隆抗体最佳结合比例的确定
取固定有KLH的金磁微粒,分别按KLH与多克隆抗体的质量比为50∶3、50∶6、50∶11、50∶16的比例加入初步纯化的多克隆抗体,置摇床室温反应30 min,磁性分离,收集上清液.用间接ELISA法测定反应前后多克隆抗体中抗KLH抗体的效价,确定多克隆抗体中抗KLH抗体完全去除时金磁微粒-KLH与多克隆抗体的最佳比例.
1.2.4.3 金磁微粒-KLH去除抗KLH抗体效果的检测
按上述确定的最佳比例对多克隆抗体中抗KLH抗体进行去除,并利用间接ELISA法分别测定去除前后抗KLH抗体和抗6×His抗体的效价,以检测金磁微粒的去除效果.
2 结果与讨论
2.1 多克隆抗体的效价测定
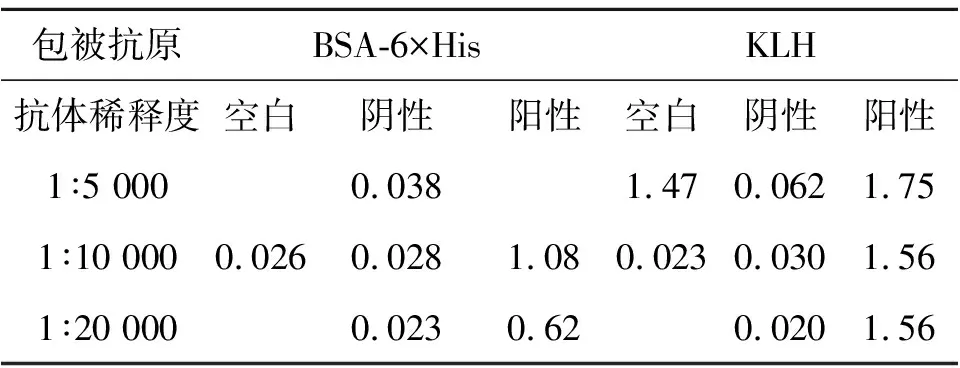
表1 抗6×His多克隆抗体效价测定
选用BSA-6×His偶联物包被酶标板测定抗6×His抗体效价,KLH包被酶标板测定抗KLH抗体的效价.由表1可见,产生的多克隆抗体是针对KLH-6×His偶联物的特异性抗体,抗6×His抗体效价大于20 000.随着抗体稀释度的增加,以BSA-6×His为包被抗原的阳性值明显下降,而以KLH为包被抗原的阳性值无明显变化,说明抗体中含有大量的抗KLH抗体,上述抗血清经饱和硫酸铵沉淀法初步纯化后只能去除抗血清中的白蛋白等组分,抗6×His和KLH的抗体依然共存.
2.2 金磁微粒介导的多克隆抗体中抗载体蛋白KLH抗体的去除
2.2.1 金磁微粒表面KLH的最大固定化量
取1 mg的金磁微粒,通过对一系列不同质量的KLH进行固定,计算得1 mg金磁微粒表面最多可固定KLH量为700 μg.
2.2.2 金磁微粒-KLH和多克隆抗体最佳结合比例的确定
固定化KLH量与待去除抗体的量达到一定比例时,才能保证多克隆抗体中抗KLH抗体较完全地与金磁微粒表面的KLH发生免疫反应而被去除.本研究对金磁微粒-KLH和多克隆抗体的最佳结合比例进行了探讨,结果如图1所示.由图1可知,当金磁微粒-KLH与多克隆抗体的质量比为50∶3、50∶6、50∶11、50∶16时,去除前后抗KLH抗体效价都大幅度下降,但是比例为50∶3时下降幅度最大,而且随着抗体稀释比例的增大,OD450的值基本保持不变.可见,比例大于50∶3时即可稳定地完全地去除多克隆抗体中抗KLH抗体,比例为50∶6、50∶11、50∶16时去除后抗体中仍残留部分抗KLH抗体,达不到完全去除多克隆抗体中抗KLH抗体的目的.

图1 KLH-金磁微粒去除多克隆抗体中抗KLH抗体后抗KLH抗体效价测定 图2 去除前后抗6×His抗体和抗KLH抗体的效价比较
2.2.3 金磁微粒去除抗KLH抗体效果的检测
在优化条件下对多克隆抗体中抗KLH抗体进行去除,并检测其去除效果,结果如图2所示.由图2可知,去除后,KLH抗体效价明显下降,而6×His抗体效价则无大的变化,表明金磁微粒对抗KLH抗体的去除非常有效.
3 结束语
六聚组氨酸为六肽,相对分子质量较小,单独作用时不具有免疫原性或抗原性弱,必须与载体蛋白偶联后才能产生针对6×His的抗体.在本实验中选用KLH作为载体蛋白,KLH相对分子质量非常大,为多亚基蛋白质,具有强的免疫原性.然而以6×His和KLH合成的抗原免疫动物,得到的多克隆抗体除含有针对6×His的抗体,还含有大量针对KLH的抗体,这些抗KLH的无关抗体会影响6×His多克隆抗体的应用.基于此,作者利用表面固定有KLH的金磁微粒对多克隆抗体中抗KLH抗体进行去除实验,得到了高纯度的抗小分子6×His的抗体,为研究6×His融合蛋白纯化检测奠定了基础,同时证明核壳型金磁微粒可作为抗体亲和纯化的良好载体,在其表面包被不同蛋白可方便地用于不同抗体的吸收除杂,特别是在小分子药物多克隆抗体的纯化方面具有非常重要的应用前景.
参考文献
[1] Mathur D, Garg L C. Functional phosphoglucose isomerase from mycobacterium tuberculosis H37Rv: Rapid purification with high yield and purity[J].Protein Expression and Purification, 2007, 52(2): 373-378.
[2] Terpe K. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems[J]. Applied microbiology and biotechnology, 2003,60(5): 523-533.
[3] Chiang Y W, Wu J C, Wang K C,etal. Efficient expression of histidine-tagged large hepatitis delta antigen in baculovirus-transduced baby hamster kidney cells[J]. World journal of Gastroenterology, 2006, 12(10):1 551-1 557.
[4] 潘 飞,邱雁临. 还原型谷胱甘肽的金属螯合亲和色谱纯化[J].中国医药工业杂志,2006,37(4):237-239.
[5] 崔亚丽,慧文利, 汪慧蓉,等. Fe3O4/Au的制备条件及性质研究[J].中国科学:B辑,2003,33(6):482-488.
[6] Ozkara S, Akgol S,Canak Y,etal. A novel magnetic absorbent for immuneoglobulin-G purification in a magnetically stabilized fluidized bed[J].Biotechnol Pro., 2004, 20(11):69-1 175.
[7] 闵玉涛,王云龙,李晨阳,等. 抗FLAG标签单克隆抗体的制备、鉴定及初步应用[J]. 中国生物工程杂志,2006,27(1):93-97.
[8] 朱正美. 简明免疫学技术[M]. 北京: 科学出版社, 2002:200-210.

