苦苣菜黄酮超声提取工艺的研究
秦俊哲, 杨汗伟
(陕西科技大学生命科学与工程学院, 陕西 西安,710021)
0 引言
苦苣菜(SonchusoleraceusL.)系菊科(Compositae)苦苣菜属(Sonchus) 1~2年生的草本植物[1],味苦,性寒,具有清热解毒、凉血止血等作用,主治肠炎、痢疾、黄疸、咽喉肿痛、吐血、尿血等症[2].其常生于路边及田野间,我国大部分地区均有分布,资源丰富.苦苣菜既是良好的的中药材又是营养丰富的优良野菜,主要含有木犀草素、芹菜素及其苷类等黄酮类化合物[3]及倍半萜类活性成分.黄酮类化合物具有抗氧化、抗癌、抑菌消炎和防动脉粥样硬化等许多生理活性[4,5],已有报道苦苣菜总黄酮对实验性肝损伤具有明显的保护作用[6],民间常将其用于治疗黄疸性肝炎,但对苦苣菜总黄酮的超声波提取工艺尚未见报道.为进一步开发利用该植物资源,本文采用正交试验设计对苦苣菜全草总黄酮超声波提取工艺进行了优化,以期为苦苣菜的合理开发和利用提供一定的科学依据.
1 材料与方法
1.1 材料、试剂与仪器
苦苣菜:4~5月份采集于西安市北郊.
芦丁标准品:陕西科技大学药物制剂实验室提供;氢氧化钠、浓盐酸、硝酸铝、亚硝酸钠均为分析纯试剂.
RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;UV-2450紫外分光光度计:日本岛津公司;SHZ-D(Ⅲ)循环水式真空泵:巩义市英峡予华仪器厂;KQ3200DE数控超声波清洗器:昆山市超声仪器有限公司.
1.2 方法
1.2.1 苦苣菜的前处理
将苦苣菜清洗干净,切丝,置于烘箱内(55 ℃)24 h,充分干燥,将干燥后的苦苣菜粉碎,过40目筛,取1份(以质量计)苦苣菜粉,加入10份(以体积计)石油醚,热水浴回流2 h,脱除脂溶性色素,通风橱内挥干石油醚,备用.
1.2.2 芦丁标准曲线的绘制[7]
标准曲线的制作:称取干燥至恒重的芦丁标准品10.00 mg,用30%的乙醇超声波下使其溶解,转移至100 mL容量瓶中定容,此溶液浓度为0.1 mg/mL,吸取0.1 mg/mL芦丁标准液0.0、1.0、2.0、3.0、4.0,5.0 mL分别置于10 mL的比色管中,30%乙醇补足至5 mL,各加入10%硝酸铝0.3 mL,静置5 min,加入5%亚硝酸钠0.3 mL,静置5 min,加入4%氢氧化钠3 mL,30%乙醇定容至10 mL,摇匀,静置15 min,以空白溶液作为对照,于510 nm测其吸光度.

表1 芦丁质量浓度-吸光度关系表
以吸光值(A)为纵坐标Y,芦丁质量浓度为横坐标X,绘制标准曲线(见图1).得到芦丁质量浓度X与吸光度Y关系曲线的回归方程为:
Y= 0.010X-0.001,R2= 0.999
(1)

图1 芦丁标准曲线 图2 乙醇浓度对黄酮提取率的影响
1.2.3 苦苣菜黄酮得率的测定
称取苦苣菜干粉1.000 g,提取完毕后,容量瓶定容至100 mL,取2 mL提取液测其吸光度,测定方法同1.2.2,根据公式(1)计算提取液中黄酮的浓度.
黄酮得率的计算公式为:
W=CX(10/2)×100×100%/1×106
(2)
式中:W-苦苣菜黄酮得率(%);C由标准曲线计算的黄酮浓度(μg/mL)
1.2.4 正交试验设计
根据正交试验的设计方法,选取乙醇浓度、提取温度、料液比和提取时间为考察因素,因素的水平设定见表2.
2 结果与分析
2.1 乙醇浓度对苦苣菜总黄酮提取率的影响
称取1.000 g样品若干份,加入40 mL浓度分别为30%、40%、50%、60%、70%、80%的乙醇溶液,60 ℃超声提取45 min,抽滤,定容,测其吸光度A值,计算相应的黄酮得率.
表2 因素水平表
由图2可见,随着乙醇浓度的增加,苦苣菜总黄酮的提取率逐渐增大,乙醇浓度达到60%后,随着乙醇浓度的增加,总黄酮提取率反而减小.乙醇浓度较低时,苦苣菜中的一些水溶性物质容易提取出来,影响黄酮的溶出.乙醇浓度为80%以上时,脂溶性物质的溶出量增加,给后面的纯化带来很大的干扰.
2.2 料液比对苦苣菜总黄酮提取率的影响
称取1.000 g样品若干份,分别加入60%的乙醇溶液10、20、30、40、50 mL,60 ℃超声提取45 min,抽滤,定容,测其吸光度A值,计算相应的黄酮得率.

图3 料液比对黄酮提取率的影响 图4 提取时间对总黄酮提取率的影响
由图3可见,随着料液比的增大,苦苣菜总黄酮的提取率逐渐升高,料液比达到1∶40后,随着乙醇浓度的增加,总黄酮提取率反而减小.
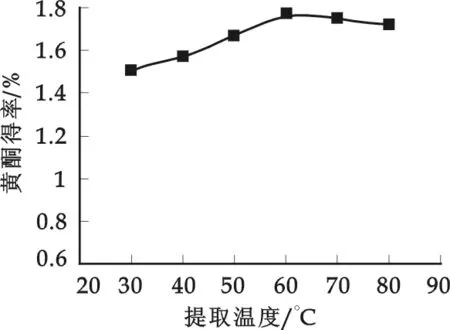
图5 提取温度对总黄酮 提取率的影响
2.3 提取时间对苦苣菜总黄酮提取率的影响
称取1.000 g样品若干份,加入60%的乙醇溶液40 mL,提取温度为60 ℃,超声波作用时间分别为15、30、45、60、75 min,抽滤,定容,测其吸光度A值,计算相应的黄酮得率.
由图4可见,随着提取时间的延长黄酮提取率先增大后减小.
2.4 提取温度对苦苣菜总黄酮提取率的影响
称取1.000 g样品若干份,加入60%的乙醇溶液40 mL,提取温度为30、40、50、60、70、80 ℃,超声波作用时间45 min,抽滤,定容,测其吸光度A值,计算相应的黄酮得率.
由图5可见,随提取温度的升高,黄酮提取率先增大,温度继续升高,黄酮提取率反而降低.升高温度,一方面可能使溶出的黄酮化合物结构遭到破坏,另一方面,可能加速其它物质的溶出,影响黄酮提取率.
2.5 正交试验
由上述各单因素试验确定的参数的适宜范围,进行四因素三水平的正交试验,正交试验结果如表3所示.
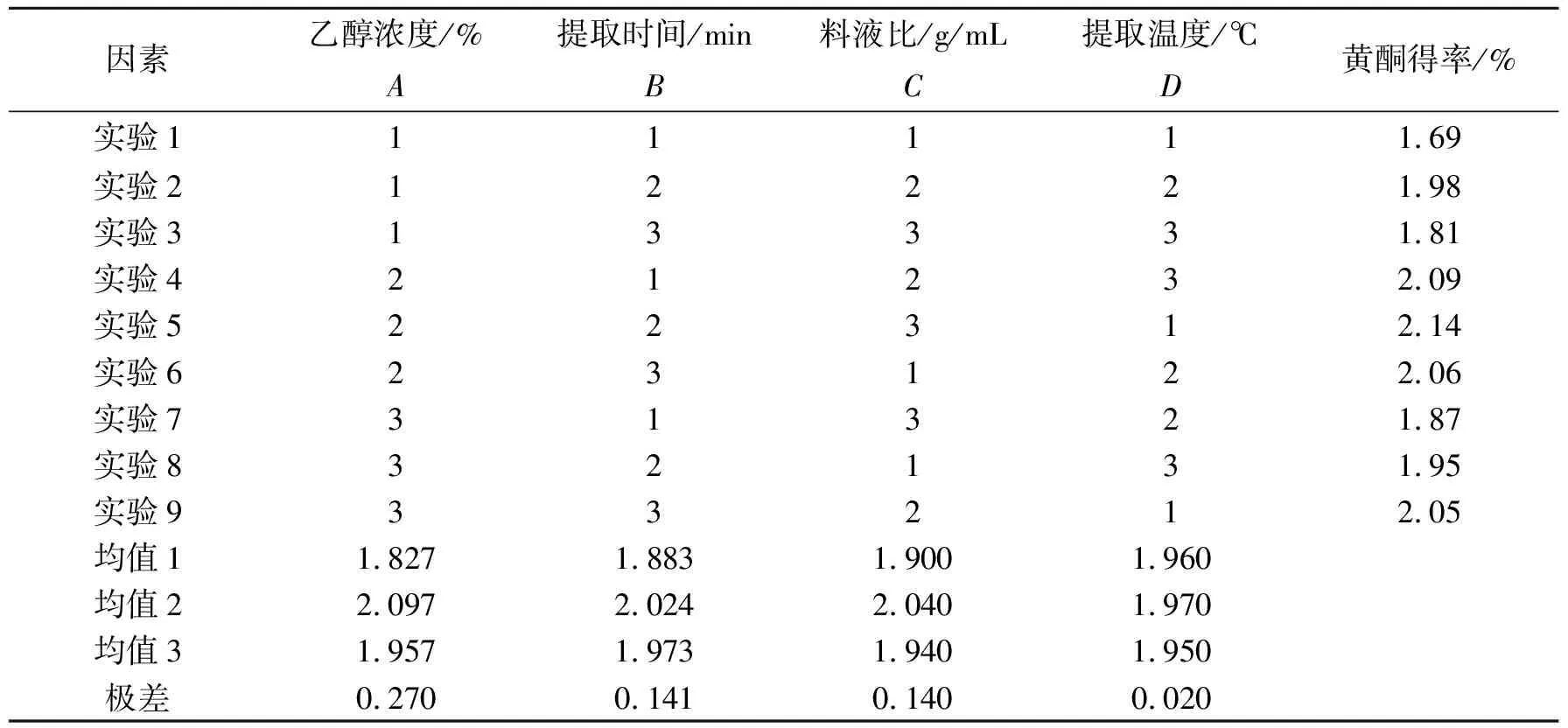
表3 正交试验结果
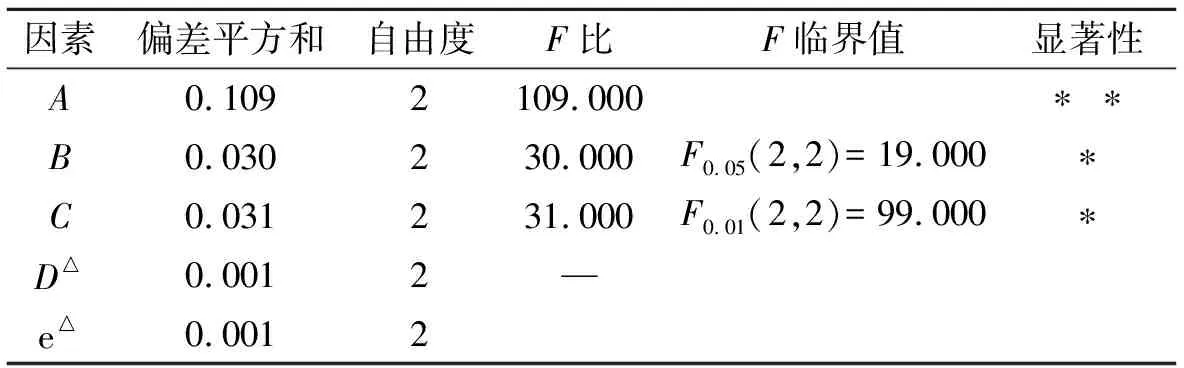
表4 方差分析
正交试验结果及极差分析见表3,影响苦苣菜总黄酮提取因素的顺序为:乙醇浓度>提取时间>料液比>提取温度.
2.6 方差分析
由方差分析表可知:A因素影响极显著,B、C因素影响显著,应选较优水平A2B2C2;D因素影响非常小,从成本角度考虑,选D1,但A2B2C2D1不包括在正交试验设计表内,因此通过验证试验证明该条件下的黄酮提取效果是否稳定且比试验号5更好.
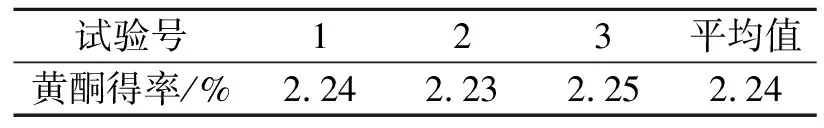
表5 验证试验
2.7 验证试验
在A2B2C2D1工艺条件下进行验证试验,结果见表5.
在A2B2C2D1工艺条件下,黄酮得率稳定,其平均值为2.24%,比试验号5提高了0.10%,进一步确定了苦苣菜黄酮超声波提取的最佳条件是A2B2C2D1,即60%乙醇,提取温度55 ℃,料液比l∶40,提取时间45 min.
3 结论
本试验首次通过正交设计对苦苣菜总黄酮的超声波提取工艺进行了初步探讨.结果表明,苦苣菜总黄酮的提取工艺条件:以60%乙醇,料液比(m∶v)1∶40,55 ℃超声提取45 min,黄酮提取率高达2.24%.经过极差和方差分析,影响苦苣菜总黄酮提取因素的顺序为:乙醇浓度>提取时间>料液比>提取温度,且乙醇浓度、料液比、提取时间差异显著,其中乙醇浓度极为显著.
参考文献
[1] 陈 辉,苏 娜. 苦菜的开发与利用[J].食品研究与开发,2004,25(2):89.
[2] 江苏新医学院. 中药大辞典(上册)[M]. 上海:上海科学技术出版社,1986: 1 286.
[3] 徐 燕,梁敬钰. 苦苣菜的化学成分[J]. 中国药科大学学报,2005, 36(5): 411-413.
[4] 霍碧姗,秦民坚. 苦苣菜属植物化学成分与药理作用[J]. 国外医药·植物药分册, 2008, 23(5): 203-207.
[5] 蒋 雷,王国荣,姚庆强. 苦苣菜属植物化学成分及药理活性研究进展[J]. 齐鲁药事, 2007,26(11): 670-672.
[6] 卢新华,唐伟军,谢应桂. 苦苣菜总黄酮对实验性肝损的保护作用[J]. 中国现代医学杂志, 2002, 2: 22-24.
[7] 周桂芬,张 涵,吕圭源. 苦苣菜中黄酮类化合物的含量测定[J]. 中华中医药学刊, 2008, 26(1):218-220.

