海藻酸钠包埋的酵母菌转化人参皂苷Rb1的研究
贾翠英,张玉辉,魏均玲
(河南科技学院生命科学技术学院,河南 新乡 453003)
人参皂苷(Ginsenoside)是人参的主要活性成分,目前已分离并鉴定的人参皂苷达60余种,各种人参皂苷都有其独特的生理活性。大量研究结果表明,人参皂苷具有抗疲劳、延缓衰老、调节中枢神经系统、提高机体免疫力、改善心脑血管供血不足、抑制肿瘤细胞生长等作用[1-4]。许多药代动力学证明人参皂苷具有在肠道内难以吸收、生物利用度低、肠内滞留时间较长,在人体内难以直接发挥药效作用的弊端,因此需经肠道细菌的酶分解为人参皂苷苷元而发挥疗效。要解决此问题,最有效的途径便是进行人参皂苷化学成分的结构转化。目前,人参皂苷糖基改造的方法有化学法和生物酶法[5]。化学法是指用化学催化水解皂苷糖基。该方法具有水解操作简单的优点,但也存在专一性差,同时易造成环境污染的弊端。生物酶法则具有反应条件温和,高专一性和高效性,无污染等优点,因此是一种行之有效的好方法[6]。
目前,国内有关人参皂苷生物转化的研究报道很多[7-12],然而有关利用固定化细胞进行人参皂苷生物转化的研究报道仍是空白。固定化技术利用活细胞或酶的高度密集,可以使普通游离状态的细胞成倍增长,具有加快反应速度,缩短反应周期,提高工作效率的优点。因此,通过使用该技术提高微生物发酵强度是一种切实可行的方法。包埋法是近年来发展迅速的一种新兴细胞固定化技术,具有操作简单,对细胞活性影响较小,效率高等优点。它是目前细胞固定化研究和应用最广泛的方法[13]。海藻酸钠具有价格低廉、容易固定、耐生物分解性好、无毒等优点。因此,它是一种极为理想的包埋剂[14-15]。利用固定化细胞进行微生物发酵生产的方法具有可重复利用微生物菌种及省去菌种活化、制备等繁琐步骤的优点,并且该方法还具有便于分离产物与菌体和将发酵生产自动化等优势[16]。因此,本研究尝试利用海藻酸钠包埋的酵母菌进行人参皂苷生物转化,通过制备固定化酵母菌和利用固定化酵母进行人参皂苷生物转化,建立了体外微生物转化模型,获得了理想的人参皂苷生物转化率,从而提高了人参皂苷在人体中的药效和利用率。
1 材料与方法
1.1 菌株
酵母菌是一株高温酿酒酵母菌,由河南科技学院发酵工程实验室提供。
1.2 培养基
1.2.1 斜面培养基
葡萄糖2%,蛋白胨1%,酵母膏0.5%,KH2PO40.1%,硫酸镁0.05%,氯化钠0.05%,琼脂2%,pH 5~6,高压灭菌锅灭菌30 min。
1.2.2 种子培养基
葡萄糖2%,蛋白胨1%,酵母膏1%,KH2PO40.1%,硫酸镁 0.01%,pH 5~6,高压灭菌锅灭菌30 min。
1.2.3 发酵培养基
4%粗品人参皂苷,用自来水配制,用0.1 mol·L-1HCl调 pH 5~6,于120 ℃灭菌 15~20 min。
1.3 培养方法
1.3.1 菌种活化与液体种子制备
无菌条件下将冰箱中保藏的酵母菌取一环于斜面培养基中,在恒温培养箱36℃条件下培养24 h,连续活化两代。
用接种环取活化好的斜面菌苔种3环,接种于250 mL内盛30 mL灭菌的新鲜种子培养基的三角瓶内,36 ℃,160 r·min-1培养24 h。
活菌计数:取1 mL培养好的液体种子,加入9 mL蒸馏水,混匀。然后从中再取1 mL移至另一试管中,加入9 mL蒸馏水,混匀,得到稀释100倍的菌液。取0.1 mL稀释100倍的菌液滴至活菌计数板上,重复计数3次,取其平均数,按下列公式计算每毫升菌液中所含的酵母菌细胞数[17]:
酵母菌细胞数(个·mL-1)=(100小格酵母细胞数/100)×400×10 000×菌液稀释倍数
酵母菌的计数结果见下表1。

表1 酵母菌细胞的计数结果(稀释100倍)Table 1 Results of yeast cell numbers determined by counter(diluted 100 times)
1.3.2 固定化酵母菌制备及发酵培养
将培养好的酵母菌液体种子进行海藻酸钠包埋制备固定化酵母菌。其制备方法如下:称取一定浓度灭过菌的海藻酸钠于无菌的小烧杯中,加少许无菌去离子水,调成糊状,补充剩余的水使总量一定。火上加温至熔化,冷却至45℃左右,加入一定接种量的酵母菌培养液,混合均匀,用5号针头以恒定的速度滴到盛有一定浓度CaCl2(胶诱导剂)溶液的平皿中制成凝胶珠,浸泡一定时间后,所得凝胶珠即为固定化酵母菌。将固定化酵母菌用无菌去离子水洗涤3次后用于人参皂苷生物转化。其转化条件为每250 mL三角瓶中装入30 mL发酵培养基,36℃摇床培养72 h,测定生物转化率。发酵试验分别考察不同包埋时间、不同酵母菌接种量、不同海藻酸钠浓度、不同CaCl2浓度对人参皂苷生物转化率的影响。
1.4 检测与计算方法
1.4.1 标准曲线的制备
准确称取人参皂苷Rb1标准品5 mg,溶于50 mL的容量瓶中,制得0.1 mg·mL-1的人参皂苷Rb1标准溶液。分别取Rb1标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL于已编号的具塞试管中,分别定容至1.4 mL。准确加入0.5 mL 8%的香兰素乙醇溶液(用无水乙醇现配),5 mL 77%的硫酸溶液,混合均匀,置于60℃水浴上恒温10 min,然后立即取出,放入冰水浴15 min,取出放置至室温,显示溶液于540 nm处测定吸光值,以吸光值为纵坐标,以人参皂苷Rb1含量为横坐标作图,绘制标准曲线[18]。
1.4.2 发酵液检测与转化率计算
取发酵液1.4 mL,参照人参皂苷Rb1标准曲线绘制方法进行发酵液中人参皂苷Rb1含量的测定,根据发酵前后发酵液中人参皂苷Rb1含量的变化(由吸光值决定),计算固定化酵母菌对人参皂苷Rb1的生物转化率,计算公式如下:

T:生物转化率;A0:空白对照发酵液的吸光值;A1:固定化酵母菌转化后的发酵液吸光值。
2 结果与分析
2.1 标准曲线绘制
由图1可知,R2=0.9997,说明人参皂苷Rb1在浓度为0.2~1.2 mg·mL-1范围内吸光度与浓度具有良好的相关性。

图1 人参皂苷Rb1的标准曲线Fig.1 Standard curve of ginsenoside Rb1
2.2 单因素试验结果
2.2.1 包埋时间对人参皂苷生物转化率的影响
参考以往关于海藻酸钠包埋法制备固定化细胞的条件[14-15],采用固定海藻酸钠浓度为4%,CaCl2浓度为10%,接种量为10%及装液量为30 mL,分析不同包埋时间对人参皂苷生物转化率的影响。包埋时间分别设置为5、15、25、35、45、55、65 min,且每一包埋时间设3个平行,以未加入固定化酵母菌的人参皂苷溶液作对照,最后取平均值,其中对照值A0的平均值为0.708,参照前文所述的生物转化率公式计算,结果如图2所示。

图2 包埋时间对酵母菌转化人参皂苷Rb1的影响Fig.2 Influence of embedding time on ginsenoside Rb1 biotransformation with yeast
由图2可知,在0~35 min内,包埋时间越长,固定效果越好,转化率越高。这是因为随着时间的延长,所得固定化凝胶小球的强度越高,固定效果越好。在35~45 min时,可获得较高的生物转化率,且最大值为30.68%,但随着包埋时间的继续延长,人参皂苷生物转化率平缓下降,原因主要是失水收缩,造成部分细胞活力下降或丧失,导致生物转化率下降。
2.2.2 接种量对人参皂苷生物转化率的影响
本试验采用固定海藻酸钠浓度为4%,CaCl2浓度为10%,包埋时间为40 min,装液量为30 mL,分析酵母菌不同接种量对人参皂苷生物转化率的影响。接种量分别设置为1%、3%、5%、7%、9%、11%、13%,且每个接种量设3个平行,以未加入固定化酵母菌的人参皂苷溶液作对照,最后取平均值,其中对照值A0的平均值为0.691,参照前文所述的生物转化率公式计算,结果如图3所示。
由图3可知,转化率先随接种量的增加而增大,然后开始下降。其原因可能是接种量较小时,所包埋的酵母菌数量少,因此,其活力相对较低,表现出较低的生物转化率。但是过高的接种量,必然造成菌种之间的竞争而出现营养不足,容易自溶。因此,7%的接种量可获得最大生物转化率为29.96%。
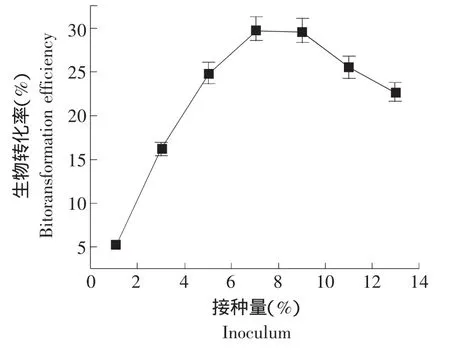
图3 接种量对酵母菌转化人参皂苷Rb1的影响Fig.3 Influence of inoculum size on ginsenoside Rb1 biotransformation with yeast
2.2.3 海藻酸钠浓度对人参皂苷生物转化率的影响
试验采用固定CaCl2浓度10%、包埋时间40 min、接种量10%、装液量为30 mL,分析不同海藻酸钠浓度对人参皂苷生物转化率的影响。海藻酸钠浓度设置为1%、3%、5%、7%、9%、11%、13%,每一浓度设3个平行,以未加入固定化酵母菌的人参皂苷溶液作对照,最后取平均值,其中对照值A0的平均值为0.722,参照前文所述的生物转化率公式计算,结果如图4所示。

图4 海藻酸钠浓度对酵母菌转化人参皂苷Rb1的影响Fig.4 Influence of sodium alginate concentration on ginsenoside Rb1 biotransformation with yeast
海藻酸钠是一类天然高分子多糖,对微生物无毒害作用。但是海藻酸钠的浓度会影响固定化细胞的机械强度、质量传递等,进而影响到微生物的活性[8]。如图4所示,海藻酸钠的浓度增加,转化率先增加,然后会减少。由此推测海藻酸钠浓度对包埋小球机械强度有影响。较低时,其所形成的胶球机械强度较小,容易破裂,包埋效果不好,而影响到酵母菌转化人参皂苷的效率。随着海藻酸钠浓度的增高,粘性增加,胶球机械强度也增加,胶球稳定。但当浓度继续增加时,粘性过大,给固定化操作带来不便。因此,海藻酸钠的浓度应选在3%~5%,此时被包埋的酵母菌有最高的生物转化率为28.45%~29.38%。
2.2.4 CaCl2浓度对人参皂苷生物转化率的影响
结果见图5。
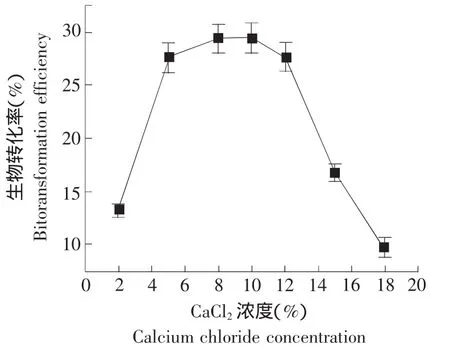
图5 CaCl2 浓度对对酵母菌转化人参皂苷Rb1的影响Fig.5 Influence of calcium chloride concentration on ginsenoside Rb1 biotransformation with yeast
试验采用固定海藻酸钠4%,包埋时间40 min,接种量为10%及装液量为30 mL,分析CaCl2浓度对人参皂苷生物转化率的影响。CaCl2浓度分别设置为2%、5%、8%、10%、12%、15%、18%,每一浓度设3个平行,以未加固定化酵母菌的人参皂苷溶液作对照,最后取平均值。其中对照值A0的平均值为0.683,参照前文所述的生物转化率公式计算,结果如图5所示。
在海藻酸钠包埋固定化过程中,固定剂CaCl2中的钙离子与海藻酸根离子螯合形成不溶于水的海藻酸钙凝胶,从而将细胞固定[8]。如图5所示,当CaCl2为低浓度时,转化率随浓度增加而增加。而随着CaCl2浓度的进一步增加,微生物细胞的活性降低,导致转化率降低。可能是由于盐的高渗透压作用,引起细胞脱水,致使微生物活性部分丧失。另外,由图5可知,当CaCl2浓度在8%~10%之间时,固定化酵母菌对人参皂苷的生物转化率较高,且生物转化率最高值为29.71%。
2.3 正交试验结果
在单因素实验的基础上,以海藻酸钠浓度、CaCl2浓度、包埋时间、接种量为研究对象,列出四因素三水平的正交试验表[19],每种组合设3次重复,以未加入固定化酵母菌的人参皂苷溶液作对照,最后取平均值。其中对照值A0的平均值为0.692,参照前文所述的生物转化率公式计算结果。

表2 试验因素水平Table 2 Factors and levels of experiment
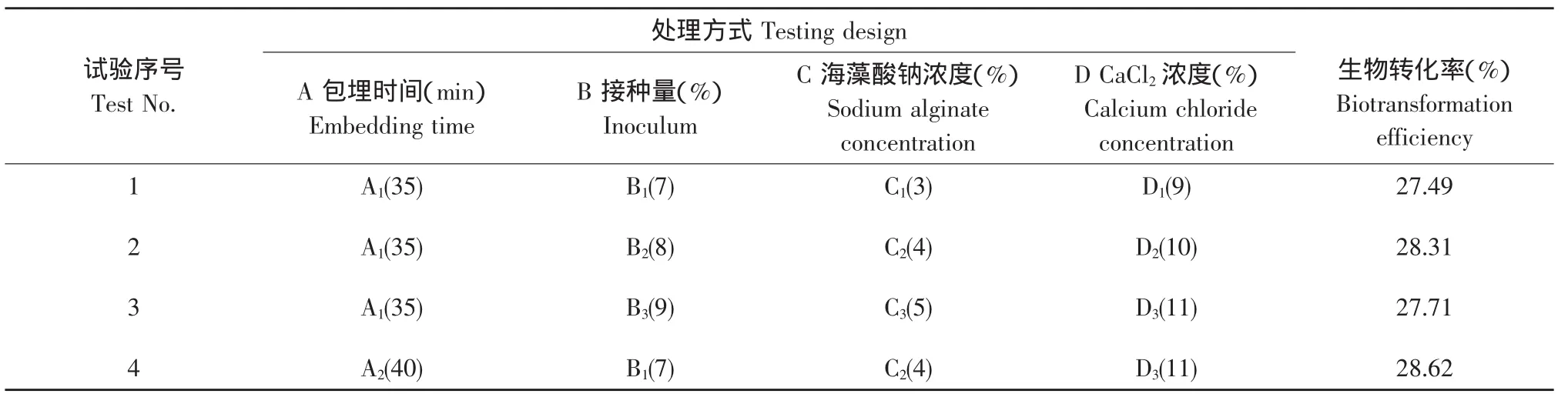
表3 L9(34)正交试验结果Table 3 Results of orthogonal experiment of L9(34)

续 表
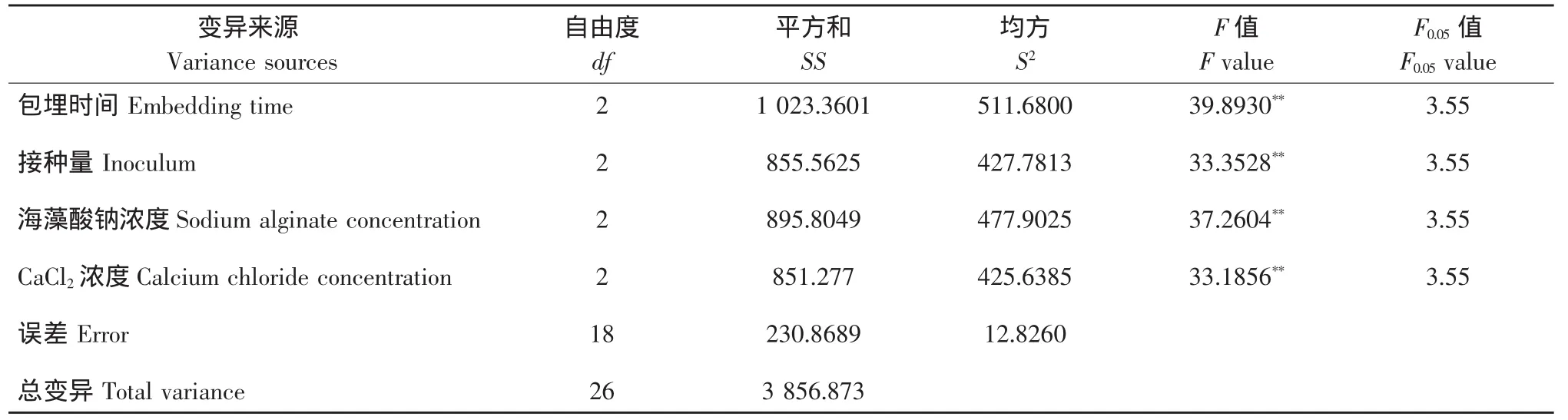
表4 方差分析结果Table 4 Analysis results of variance
由表3可知,海藻酸钠包埋时间,酵母菌接种量,海藻酸钠浓度及CaCl2浓度对固定化后的酵母菌转化人参皂苷的转化率均有一定的影响,根据极差结果显示,各因素的影响顺序为海藻酸钠包埋时间>CaCl2浓度>海藻酸钠浓度>接种量。另外,由表3可知,海藻酸钠包埋法制备酵母菌转化人参皂苷的最佳细胞固定化工艺条件为包埋时间45 min,接种量7%,海藻酸钠浓度5%,CaCl2浓度10%,在此条件下可获得最高生物转化率为31.51%。由表4的F测验分析可知,在该试验中海藻酸钠包埋时间,酵母菌接种量,海藻酸钠浓度及CaCl2浓度对人参皂苷的生物转化率均有显著的影响。以上结果分析表明:当酵母菌液体种子浓度为1.25×108个·mL-1时,在上述最佳固定化工艺条件下所制备的固定化酵母菌,进行人参皂苷生物转化时就可以获得预期最高生物转化率。
3 讨论
a.海藻酸钠包埋酵母菌转化人参皂苷的影响因素很多,除了海藻酸钠浓度,包埋时间,CaCl2浓度及酵母菌细胞浓度外,所制备的凝胶小球的大小直径以及制备固定化酵母菌时所选用的初始酵母菌细胞活力大小等对后续的生物转化率也有一定的影响。
b.通常凝胶小球直径越大,越不利于传质,易造成凝胶小球内部的细胞营养供给不足,积累的代谢产物过多,最后造成凝胶小球内部环境恶化,使得凝胶小球内微生物细胞死亡数目增多[21-23]。此外,固定化过程中所使用的CaCl2作为一种固定剂同时也是一种无机盐,无机盐的高渗透压作用,易引起细胞脱水,致使微生物活性部分丧失。在利用海藻酸钠包埋法制备固定化酵母菌时需要考虑到凝胶小球的直径和酵母菌的活力。
4 结论
本文通过海藻酸钠包埋法制备固定化酵母菌并进行了转化人参皂苷Rb1的试验,结果证明固定化的酵母菌对人参皂苷Rb1有较好的转化能力和转化效率,通过单因素和正交试验,得出了海藻酸钠包埋法制备固定化酵母菌的最佳条件即:包埋时间为45 min,接种量为7%,海藻酸钠浓度为5%,CaCl2浓度为10%,在此条件下可获得最高生物转化率为31.51%,较以往研究的非固定化酵母菌转化人参皂苷Rb1的生物转化率提高约3%~5%[11],而且固定化的酵母菌可以多次重复利用并简化灭菌、菌种活化等繁琐操作步骤[20]。因此,该研究为人参皂苷Rb1生物转化提供了新思路和新方法。
[1]张萍,张南平,肖新月.人参皂苷类成分的化学分析[J].药物分析杂志,2004,24(3):229-237.
[2]刘晓晖,朱鲲鹏.人参皂苷Rb1的研究进展[J].武警医学院学报,2006,15(1):82-84.
[3]李向高.人参皂苷Rb1的药理作用研究[J].吉林农业大学学报,2004,26(6):649-652.
[4]王立青,江荣高.人参皂苷Rb1的药理活性[J].国外医药植物药分册,2005,20(6):245-247.
[5]李泰平.人参皂苷药理活性的研究进展[J].生物学教学,2003,12(4):1-3.
[6]姜彬慧,胡筱敏,左小红.酶技术与中药现代化[J].药学报,2002,34(4):134-137.
[7]马吉胜,周秋丽,费晓方,等.真菌对人参皂苷Rb1及人参二醇系皂苷的代谢作用[J].药学学报,2001,36(8):603-605.
[8]李梁,卢明春,鱼红闪.从一种新筛选的菌中找出人参皂苷酶[J].大连轻工业学院学报,2003(3):164-166.
[9]王毅,刘铁汉,王巍,等.肠内菌群对人参皂苷Rg1的代谢转化作用的研究[J].中国中药杂志,2001,3(3):26-29.
[10]刘明杰,林琳,王钊.肠道细菌对天然药物代谢的研究进展Ⅱ[J].中国现代应用药学,2001,18(4):2-5.
[11]贾翠英,张玉辉,贾斌.酵母菌半连续转化人参皂苷Rb1的条件优化[J].生物学杂志,2009,26(6):41-44.
[12]贾翠英,张玉辉,常景玲.酵母菌生长与产人参皂苷β-葡萄糖苷酶的动力学模型[J].郑州大学学报,2009,41(12):109-111.
[13]肖美燕,徐尔尼,陈志文.包埋法固定化细胞技术的研究进展[J].食品科学,2003,24(4):158-161.
[14]梁峙,赵孝华.海藻酸钠固定化酵母菌的应用研究[J].食品科学,2002,23(12):34-35.
[15]张良,陈锡时.细胞固定化技术-海藻酸钠包埋法的研究进展[J].安徽农业科学,2006,34(7):1281-1284.
[16]Plessas S,Argyro,Kanellaki B,et al.Use of immobilized cell biocatalysts in baking process biochemistry[J].Process Biochemistry,2007,42(8):1244-1249.
[17]常景玲,李兰.酿酒酵母细胞固定化与酒精发酵.生物工程大实验[M].新乡:河南科技学院发酵工程教研室编制印刷,2007:5-6.
[18]高丽萍,刘华,封云芳.人参总皂苷的含量测定[J].浙江工程学院学报,2002,19(3):171-174.
[19]崔秀珍.生物统计分析[M].北京:中国农业科学技术出版,2002:87-173.
[20]Swain M R,Kar S,Sahoo A K,et al.Ethanol fermentation of mahula(Madhuca latifolia L.)flowers using free and immobilized yeast Saccharomyces cerevisiae[J].Microbiological Research,2007,162(2):93-98.
[21]Idris A,Suzana W.Effect of sodium alginate concentration,bead diameter,initial pH and temperature on lactic acid production from pineapple waste using immobilized Lactobacillus delbrueckii[J].Process Biochemistry,2006,41(5):1117-1123.
[22]Klinkenberg G,Lystad K Q,Levine D W,et al.Cell release from alginate immobilized Lactococcus lactis ssp.lactis in chitosan and alginate coated beads[J].Journal of Dairy Science,2001,84(5):1118-1127.
[23]Podrazky O,Kuncova G.Determination of concentration of living immobilized yeast cells by fluorescence spectroscopy[J].Sensors and Actuators B:Chemical,2005,107(1):126-134.
