铝碱制氢及其副产物的综合利用
丁东各,郭瓦力,于 涛,王建武,李芳芳
(沈阳化工学院 化学工程学院,辽宁 沈阳 110142)
迫于矿物能源的渐进枯竭及环境问题的日益严重,世界各国都十分重视高效低成本的化石能源和可再生能源制氢技术,许多国家都将氢能经济列入了发展日程,我国也将氢能及燃料电池技术作为先进能源技术领域的优先主题列入国家中长期科学技术发展规划。与此同时,我国科学家也在呼吁大力推动制氢技术和燃料电池的开发研究,抢占未来能源制高点,尽早步入可持续发展的“氢能经济”时代。
高效低成本地利用煤炭、石油、天然气等化石能源制取H2,是目前国际上通行的一类制氢方法,我国也积极倡导化石能源制氢,但该法所存在的能源资源的不可再生性及产物气体氢含量相对较低,碳氧化合物相对较高,其中的CO处理相对困难等问题也是一个不争的事实。
硼氢化钠制氢、铝碱制氢可产生高纯H2且制氢条件温和、工艺简单,在现行制氢技术中异军突起,但原料来源和制氢成本却是目前制约这两种制氢技术付诸应用的大问题。尽管这两种制氢技术的瓶颈都是制氢成本问题,但相比之下,铝碱制氢的原料成本明显低于硼氢化钠制氢且不需要催化剂,因此,成为了近年来引人关注的燃料电池氢源技术之一。
目前,对铝碱制氢的研究多在NaOH溶液中间歇进行。本文以铝粉为原料,以废旧铝材(罐装饮料外包装)为替代品,在自行设计并组建的实验装置上研究铝碱间歇制氢和连续制氢规律,并采用碳分法进行了铝碱制氢副产物铝酸钠溶液制备阻燃剂的研究,旨在提高铝元素利用效率的基础上,进一步研究低成本铝碱制氢工艺,为铝碱制氢技术早日付诸应用提供借鉴。
1 实验部分
1.1 实验原理
铝粉与NaOH溶液反应制取H2反应方程式如下:

其中铝元素化合价升高,水中氢元素化合价降低,是一个氧化还原反应过程。氧化还原反应放热,参加的反应的物质的量越大,浓度越高,反应越剧烈,反应越完全。
反应温度、NaOH溶液浓度和NaOH过量系数等因素均对制氢效果均会产生影响,本文以氢产率为实验指标来描述各种因素下的制氢规律。氢产率定义为:反应生成H2的摩尔数与标准状况下铝粉完全反应生成H2摩尔数的比值。
本文尝试将铝碱制氢副产物NaAl(OH)4溶液采用碳分法制备Al(OH)3阻燃剂(ATH),即在铝酸钠溶液中通入N2和CO2混合气,按下述反应生成Al(OH)3:

使用纯粹的CO2时,生成的Al(OH)3粒径过大易堵塞管道,N2起到稀释CO2延长结晶时间疏通管道的作用,因此,反应温度、铝酸钠浓度、CO2流量和碳氮混合气的比例对ATH的产率产生影响。
1.2 原料及设备
铝粉(符合Q/CYDZ 185-2004,松装密度1.2g·cm-3);NaOH(粒状 A.R.);蒸馏水、铝酸钠(A.R.);CO2;普氮;无水乙醇(A.R.)。
GC122型气相色谱仪;LB-05平流泵;湿式气体流量计;气体钢瓶;76-1玻璃恒温水浴;SHB-ⅢS循环水式多用真空泵;布氏漏斗;BT-9300H激光粒度分布仪、电子天平等。
1.3 实验装置
1.3.1 铝碱间歇制氢实验装置
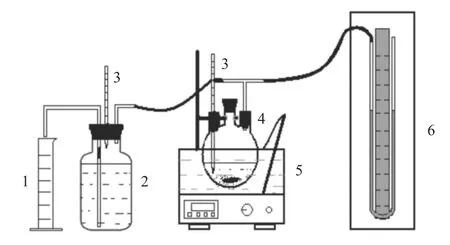
图1 铝碱间歇制氢实验装置图Fig.1 Equipment of intermittent hydrogen production from Al-NaOH
流程叙述如下:在一定温度下,将铝粉和配置好的NaOH溶液一次性加入三口烧瓶反应器中,生成的H2进入集气瓶,采用排水取气计量生成的气体体积。反应器和集气瓶温度采用温度计测量,系统压力经U型管压差计测量。采用气相色谱分析气体成分,所得气体根据克拉伯龙方程进行温度压力校正,计算氢产率。
1.3.2 铝碱连续制氢实验装置

图2 铝碱连续制氢实验装置示意图Fig.2 Equipment of continuous hydrogen production from Al-NaOH
如图2所示,铝粉储料罐下部的振动器由电机和偏心轮构成。电机带动偏心轮以30次·min-1的速度撞击铝粉储料罐以保证均匀地进料,NaOH溶液通过LB-05平流泵进入反应器。铝粉和NaOH溶液在反应器中反应,生成的气体通过湿式气体流量计测量生成气体的体积、压力和温度。可以通过三通阀直接将气体送入气相色谱气体在线检测,也可不检测直接排出。而反应生成的副产物铝酸钠溶液则通过反应器底部的阀门开关排出。反应器底部带有玻璃孔板,上面铺上耐碱滤布,防止未反应的铝粉堵塞阀门。需要设置压力平衡管平衡铝粉储料罐和反应器内压力,防止储料罐底部氢气压力过大,影响铝粉的正常进料。
1.3.3 碳分法制备Al(OH)3阻燃剂装置

图3 铝酸钠溶液与CO2制备Al(OH)3阻燃剂实验装置图Fig.3 Equipment of preparation of Al(OH)3fire retardant by sodium aluminate and CO2
实验流程及方法如下:CO2和N2分别来自钢瓶(1,2),经减压阀减压后,流经玻璃转子流量计(3,4),通过止逆阀(5,6),在气体混合器(7)内混合,混合气在反应器(9)中与铝酸钠溶液接触反应,过量气体由反应器顶部排出。反应器置于恒温水浴(8)中保持一定的反应温度。以pH值判断反应终点,反应结束后过滤并洗涤Al(OH)3沉淀,烘干后称重计算产率并用激光粒度分布仪测定产品的平均粒径,同时进行其他产品指标的检测。
1.3.4 实验研究方案
(1)间歇制氢规律研究 在铝粉质量1.0125g(0.0375mol,此时理论生成气体 1.3L),反应时间30min的基础条件下,本文通过表1所示单因素实验考察初始反应温度、NaOH浓度和NaOH过量系数对H2产率的影响。

表1 间歇制氢单因素实验条件Tab.1 Single factor conditions of intermittent hydrogen production
(2)连续制氢规律研究 ①在温度25℃、铝粉进料速度1.5mL·min-1、NaOH浓度5%,考察铝粉进料量与液固体积比(NaOH溶液与铝粉的体积比)对连续制H2产率的影响,获得适宜的操作条件。

表2 连续制氢单因素实验Tab.2 Single factor conditions of continuous hydrogen production
②为降低成本,采用废弃的铝质易拉罐(主要成分为3004铝合金)用连续制氢的最佳实验结果进实验。废旧易拉罐需要经过表面去膜处理,再粉碎到一定粒度作为制氢原料。
(3)阻燃剂制备 在探索性实验及单因素实验的基础上,本文先以分析纯铝酸钠制备溶液,通过正交实验考察初始反应温度、铝酸钠浓度、碳氮比(CO2与N2的体积比)、CO2过量系数的影响并进行显著性分析,优化工艺条件。然后,再用于铝粉与NaOH制氢废液制备Al(OH)3阻燃剂。

表3 正交实验因素水平表Tab.3 Factors level for orthogonal experiment
2 结果与讨论
2.1 间歇制氢实验结果
2.1.1 初始反应温度对H2产率的影响
图4所示为间歇条件下H2产率与初始反应温度的关系。

图4 H2产率与初始反应温度的关系Fig.4 Relationship of H2yield and initial temperature
由图4可知,初始反应温度升高反应速度加快,反应进行的比较完全,H2产率随着初始反应温度呈单调上升趋势,在85℃时,H2产率最高达到98.1%。由于反应会放出大量的热使溶液温度升高,所以在实际应用和连续制氢过程中反应可以在常温下进行,反应自身放出的热量可以促进反应更加充分。
2.1.2 NaOH浓度对H2产率的影响
图5所示为间歇条件下NaOH浓度与H2产率的关系。

图5 H2产率与NaOH浓度的关系Fig.5 Relationship of H2yield and NaOH concentration
由图5可知,H2产率随着NaOH浓度的增加而增长。当NaOH浓度在1%~3%时,H2产率的变化较大;当NaOH浓度在4%~6%,H2产率的变化较小。当NaOH浓度在7%以上时,反应生成大量气泡,溢出反应器,综合安全因素,选择NaOH浓度为5%。
2.1.3 NaOH过量系数对H2产率的影响
由图6可知,H2产率随着NaOH过量系数呈单调上升趋势。NaOH浓度一定,增加过量系数则增加了反应物的量,使铝粉反应趋于完全,但又增加了NaOH的消耗,综合考虑以1∶1.5为宜。
根据以上实验结果确定间歇制氢适宜的操作条件为:初始反应温度85℃,NaOH浓度为5%,NaOH过量系数为1∶1.5,在此条件下进行验证性实验H2产率达到99.8%。
2.2 连续制氢实验结果
H2产率与铝粉进料量的关系见表4。

表4 氢产率与铝粉进料量的关系(液固比:24∶1)Tab.4 Relationship of H2yield and input quantity of aluminum powder
由表4可知,在本文的连续制氢实验中,在液固比一定的情况下,H2产率几乎不受铝粉进料量的影响。
H2产率与液固比的关系见表5。

表5 H2产率与液固比的关系(铝粉进料量1.67mL)Tab.5 Relationship of H2yield and ratio solid-to-liquid
由表5可以看出,H2产率随着液固比的变大而增加。在液固比为48∶1的时候H2产率最高,达到98.1%。浓度一定时,增大液固比实质上是增加了反应物NaOH的加入量,液固比48∶1相当于间歇制氢实验中NaOH过量系数1∶2.0,反应物增多,使反应更加完全。
连续制氢适宜的实验条件是在温度25℃、铝粉进料速度1.5mL·min-1、NaOH浓度5%、液固体积比为48∶1时,此时H2产率最高达到98.1%,出氢快速稳定,能够满足使用要求。
2.3 废旧铝材制氢效果
在连续实验装置中置入经处理的废弃铝质易拉罐2g,按照连续制氢适宜的实验条件进行实验,即:初始温度25℃、铝粉进料速度1.5mL·min-1、NaOH浓度为5%,液固体积比为48∶1进行试验,H2产率达到96.5%。使用废铝效果微低于铝粉,但其低廉的价格使得这项技术有了广泛应用的可能。
2.4 ATH阻燃剂制备影响及工艺条件
表6、7为铝酸钠溶液制备ATH正交试验结果及极差分析。

表6 正交实验数据统计表Tab.6 Data of orthogonal experiment

表7 以产率为指标正交实验数据处理结果表Tab.7 Data of orthogonal experiment by yield as target
由极差分析结果可知,铝酸钠浓度对产率的影响最为显著,其他各因素对实验指标影响的显著性依次为,CO2过量系数,反应温度,碳氮比。适宜的工艺条件为:铝酸钠浓度为120g·L-1,过量系数为1.1,碳氮比为1:4,反应温度为50℃时,在此条件下进行验证,Al(OH)3产率最高为78.9%。经检验,产品性能符合国家标准GB/T4294-1997。
在铝酸钠溶液制备ATH影响因素分析及工艺条件优化的基础上,本文以铝粉与NaOH制H2废液为原料进行ATH制备研究。
取铝粉与NaOH制氢反应废液100mL,按正交优化条件完成碳分反应后抽滤、干燥得到白色粉末4.1g,产率达到73.2%,与正交实验最好实验结果78.9%有一定差距,这是因为铝粉与NaOH制氢后的铝酸钠溶液浓度较低,影响了NaOH的产率。因此,在实际应用中要首先对废液进行浓缩及精制处理。
3 结论
(1)铝粉及废旧铝材与NaOH制氢具H2含量高、氢产率高、接近常温常压操作、工艺条件相对温和的基本特点,将其副产铝酸钠溶液用于超细氢氧化铝阻燃剂的制备,实现了对铝元素的充分利用,可进一步降低制氢成本。
(2)开发并组建了间歇制氢实验装置、连续制氢实验装置及碳分法制备阻燃剂的实验装置,装置设计合理、流程简单、易于操作、能获得可靠的实验数据,并可为过程放大提供参考。
(3)铝碱间歇制氢适宜的操作条件为:初始反应温度85℃,NaOH浓度为5%,NaOH过量系数为1∶1.5,在此条件下H2产率可达99.8%;25℃下连续制氢适宜的操作条件为:铝粉进料速度1.5mL·min-1、NaOH浓度5%、液固体积比为48∶1,连续制氢产率最高达到98.1%;废旧铝材经表面处理及粉碎后用于制氢,H2产率可达96.5%。
(4)碳分法制备Al(OH)3阻燃剂的适宜操作条件为:铝酸钠浓度为120g·L-1,过量系数为1.1,反应温度为50℃时,碳氮比为1∶4,在此条件下,Al(OH)3产率最高为78.9%。经检验,产品性能符合国家标准GB/T4294-1997;并且废液中NaAl(OH)4浓度很低,在实际生产中为提高生产效率需要精炼制氢废液。
[1]丁福臣,易玉峰.制氢储氢技术[M].化学工业出版社,工业装备与信息工程出版中心,2006.1.
[2]侯永平,庄鸣曦,万钢.燃料电池氢耗量半经验动态模型[J].汽车工程,2007,29(11).
[3]孙元明,黄岳祥.一种氢气制备装置[J].国家专利,2002,(12):11.
[4]刘佳禾.硼氢化钠水解-制氢技术[J].沈阳化工学院院报,2006,(2):18.
[5]欧育湘,李建军.阻燃剂-性能、制造及应用[M].北京:化学工业出版社,2006.
[6]黄东,南海,吴鹤.氢氧化铝的阻燃性质与应用研究[J].材料开发与应用,2004,19(3):33-37.
[7]张泽强,胡文祥,沈上越.超声波雾化碳分法制备纳米氢氧化铝[J].化工进展,2007,26(5):55-58.
[8]张磊,林齐.碳分法生产超细氢氧化铝粉[J].轻金属,2004,(10):15-17.
[9]冉霞.超细氢氧化铝主要用途及物理指标分析[J].世界有色金属,2008,(10).
[10]李殿顺,李峻峰,李峻松.用金属铝氢氧化钠从水中制取氢气[J].化学世界,1997,38(3):122-125.

