CD4+CD25+调节T细胞对内皮细胞炎性因子分泌的影响①
何少林 李大主 黎 明 马旭明 林 静 昌 薇 赵 卉
(华中科技大学同济医学院协和医院心内科,武汉 430022)
CD4+CD25+调节T细胞对内皮细胞炎性因子分泌的影响①
何少林 李大主 黎 明 马旭明 林 静 昌 薇 赵 卉
(华中科技大学同济医学院协和医院心内科,武汉 430022)
目的:探讨CD4+CD25+调节性T细胞(Tregs)对氧化型低密度脂蛋白(ox-LDL)诱导人脐静脉内皮细胞(HUVECs)VCAM-1、MCP-1、IL-6表达的影响。方法:磁性细胞分离器(MACS)分离 CD4+CD25+T细胞及CD4+CD25-T细胞。在 ox-LDL作用下,将内皮细胞分别与anti-CD3mAb激活的CD4+CD25+T细胞,CD4+CD25-T细胞共培养24小时。分别应用流式细胞术、ELISA、real-time PCR测定Tregs对ox-LDL诱导损伤HUVECs炎性因子VCAM-1、MCP-1、IL-6表达的影响。应用Transwell小室及中和抗体实验观察Tregs作用于HUVECs的具体机制。结果:与对照组比较,Tregs细胞可显著抑制ox-LDL诱导损伤HUVECs炎性因子VCAM-1、MCP-1、IL-6的表达;被Transwell隔离或加入中和性抗体 anti-IL-10/anti-TGF-β后,Tregs对HUVECs的抑制作用可被部分逆转。结论:Tregs细胞可显著抑制ox-LDL诱导损伤HUVECs炎性因子的表达,其作用机制既依赖于细胞直接接触,又依赖于细胞因子。
CD4+CD25+调节性T细胞;人脐静脉内皮细胞;氧化型低密度脂蛋白;炎性因子;Transwell
动脉粥样硬化(AS)是一种炎症性疾病,血管内皮细胞的损伤是其启动机制[1]。传统的AS危险因素如ox-LDL能刺激内皮细胞分泌炎性因子如血管细胞粘附分子-1(VCAM-1)、单核细胞趋化蛋白-1(MCP-1)、白细胞介素6(IL-6),吸引炎性细胞并使其在局部粘附,进而进入内膜下,产生炎症反应[2]。近年研究发现,Tregs作为体内专职的炎症负性调节细胞,具有抗AS的作用,但其抗AS的确切机制尚不清楚[3,4]。本文探讨Tregs对ox-LDL诱导内皮细胞炎性因子表达的影响及其机制。
1 材料与方法
1.1 材料 主要试剂:DMEM/F-12培养基购于Gibco-BRL公司,按说明书配制,4℃保存;特级胎牛血清购于杭州四季青生物制品公司,使用前56℃水浴30分钟灭活补体后分装,-20℃保存;ox-LDL购于Sigma公司;DMSO购于上海华美生物工程公司;人淋巴细胞分离液购于中国医学科学院生物医学工程研究所;FITC-anti human CD4、PE-anti human CD25、CD4+CD25+Foxp3+Treg细胞免疫磁珠(MACS)分选试剂盒购于德国Miltenyi Biotec公司;human VCAM-1-PE、human MCP-1-PE、human IL-6-PE 、human IgGPE、human anti-CD3mAb OKT3购于美国eBioscience公司;Anti-IL-10 mAbs、anti-TGF-βmAbs、ELISA 试剂盒购于美国R&D公司;Trizol试剂盒购于Gibco-BRL公司;逆转录试剂盒购于日本TOYOBO公司;实时定量试剂盒购于日本TaKaRa公司;引物设计与合成:根据GenBank中人基因序列,由上海生工生物技术有限公司合成;Transwell购于美国Corning公司。
1.2 方法
1.2.1 细胞分离与培养
1.2.1.1 HUVECs的培养及鉴定 新生儿脐带由华中科技大学同济医学院附属协和医院妇产科提供。取新生儿脐带,PBS洗净脐静脉腔后灌注0.1% Ⅰ型胶原酶,血管钳夹闭静脉两端 ,置37℃水浴箱12~15分钟,收集消化液,1 200 r/min离心10分钟,弃上清,加入内皮细胞培养基,置37℃、5%CO2孵育箱中培养24小时,PBS洗去红细胞及未贴壁细胞,加入含10%特级胎牛血清及内皮细胞生长添加物(100mg/L)的培养基中继续培养,2~3天换液一次。至贴壁细胞70%~80%融合时,用0.25%胰蛋白酶消化传代,取3~6代用于试验 。倒置相差显微镜下观察细胞呈单层鹅卵石样排列,Ⅷ因子相关抗原免疫荧光染色阳性,确定为内皮细胞。
1.2.1.2 CD4+CD25+T细胞及CD4+CD25-T细胞的分离及激活 以无菌注射器采集外周血50 ml(来自健康志愿者),肝素抗凝,密度梯度离心法分离外周血单个核细胞(PBMCs),收集的PBMCs用CD4+CD25+Foxp3+Treg细胞免疫磁珠(MACS)分选试剂盒,阴性选择获得CD4+T细胞;加入PE标记抗人CD25单克隆抗体,再加入磁珠标记抗PE,阳性选择获得CD4+CD25+T细胞,阴性选择获得CD4+CD25-T细胞,通过流式细胞仪(BD FACSCalibur)分析细胞纯度,经鉴定其纯度分别>92%和>98%。将分选后的CD4+CD25+T细胞和CD4+CD25-T细胞分别用无血清DMEM/F-12培养基重悬,调整细胞至终浓度1×109cells/L,种入预先包被好human anti-CD3mAbsOKT3(10mg/L)的96孔板,每孔终体积100μl,孵育48小时。
1.2.2 Tregs与HUVECs的共培养及分组 CD4+CD25+T细胞,CD4+CD25-T细胞(均为 5×105细胞/孔)与抗人CD3mAbs(10mg/L)孵育48小时后,分别加入已种有内皮细胞(3×106~4×106细胞/孔)的培养板,在终浓度均为50 mg/L的ox-LDL中共培养[5],分为3组:①ox-LDL诱导组(noT组):HUVECs+50 mg/L ox-LDL;②CD4+CD25+T细胞组(25+组):HUVECs+CD4+CD25+T细胞+50 mg/L ox-LDL;③CD4+CD25-细胞组(25-组):HUVECs+CD4+CD25-T细胞+50mg/L ox-LDL。细胞置于37℃、5%CO2、95%空气的培养箱中培养。24小时后,移去培养液,用 PBS轻洗2遍,去除未粘附细胞,用0.25%胰蛋白酶液消化收集HUVECs备用。
1.2.3 流式细胞术检测HUVECs VCAM-1、MCP-1、IL-6的表达 收集上述处理过的各组单个HUVECs,离心弃上清,80μl PBS液重悬,各组细胞分别加入单克隆抗体human VCAM-1-PE,humanMCP-1-PE,human IL-6-PE各20μl,4℃孵育30分钟,加入含2%BSA、0.1%NaN3的 PBS液,1 200 r/min离心,10分钟,反复洗2次。去上清,加入1%多聚甲醛PBS液(pH7.2)500μl,流式细胞仪检测,其结果以阳性百分率表示。每份样本均设阴性对照(加相应IgG抗体),以消除本底荧光的影响。
1.2.4 ELISA检测上清液MCP-1、IL-6浓度 操作按试剂盒说明进行。
1.2.5 Real-time Quantitative-PCR检测HUVECs VCAM-1、MCP-1、IL-6 的基因表达
1.2.5.1 总RNA的提取 用一步法提取细胞总RNA。提取的总RNA经电泳鉴定未被降解,用72-1分光光度计测RNA在260 nm和280 nm的吸光度(A)值,所有样品的A 260/A280比值均介于1.9~2.1。根据260 nm的吸光度值对样品的总RNA进行初步定量。
1.2.5.2 逆转录反应 应用TOYOBO逆转录试剂盒配制20μl反应体系,其中含 RNase free H2O 6μl、5×RT buffer 4 μl、dNTPMixture 2 μl、RNase Inhibitor 1 μl、Oligo(dT)1 μl、相当于 1 μg的 RNA 样品 5 μl、ReverTra Ace 1μl。在Tgradient梯度PCR仪进行逆转录反应得到 cDNA,温度设置为30℃、10分钟,42℃、20分钟,85℃、5分钟,4℃、5分钟。
1.2.5.3 Real Time RT-PCR 应用TaKaRa实时定量试剂盒配制25μl反应体系,其中含SYBR Prem ix Ex Taq 12.5μl,PCR正义引物0.5μl、PCR 反义引物0.5 μl、cDNA 2 μl、dH2O 9.5 μl。VCAM-1 的上下游引物分别为 5′-CAT CCA CAA AGC TGC AAG AA-3′和 5′-CCTGGA TTCCCT TTTCCAGT-3′;MCP-1的上下游引物分别为 5′-CTC ATA GCA GCC ACC TTC ATTC-3′和 5′-CAA GTC TTCGGA GTT TGG GTT T-3′;IL-6的上下游引物分别为 5′-CAA ATT CGG TAC ATC CTC GAC GGC-3′和 5′-GGT TCA GGT TGT TTT CTGCCA GTG C-3′;GAPDH的上下游引物分别为5′-CCA CCC ATG GCA AAT TCC ATG GCA-3′和 5′-TCT AGA CCG CAG GTC AGG TCC ACC-3′。在 ABI Step one实时荧光定量PCR仪上扩增。相对基因表达水平用CT值比较法2-△△CT计算转录水平差异。
1.2.6 Transwell与中和抗体实验 Transwell上下小室间的通透膜孔径为0.4μm,可允许细胞因子自由通过,而Tregs不能自由通过。实验分为六组:①ox-LDL诱导组(noT组):HUVECs+50mg/Lox-LDL;②CD4+CD25+T细胞组(CC组):HUVECs+CD4+CD25+T细胞+anti-CD3mAbs+50 mg/L ox-LDL;③Transwell实验组(TW组):下室中种入HUVECs,上室中种入CD4+CD25+T细胞+anti-CD3mAbs。④anti-IL-10组:下室中种入HUVECs,上室中种入CD4+CD25+T细胞+anti-CD3mAbs+anti-IL-10 mAbs;⑤anti-TGF-β组:下室中种入 HUVECs,上室中种入CD4+CD25+T细胞 +anti-CD3 mAbs+anti-TGF-β mAbs;⑥anti-IL-10+anti-TGF-β组:下室中种入HUVECs,上室中种入 CD4+CD25+T细胞+anti-CD3 mAbs+anti-IL-10 mAbs+anti-TGF-βmAbs。48小时后,移走上室,下室中加入50mg/L ox-LDL。各组细胞均置5%CO2、37℃孵箱,培养 24小时后收获HUVECs测定VCAM-1的表达,收集上清液测定MCP-1、IL-6的量。
1.3 统计学处理 以上各组实验至少独立重复三次,结果均用SPSS13.0统计软件进行统计学处理。组间数据处理根据方差齐性分析的结果,进一步使用S-N-K检验进行组间差异的比较,P<0.05为差异有显著性。
2 结果
2.1 调节性T细胞抑制 HUVECs VCAM-1、MCP-1、IL-6表达
2.1.1 调节性T细胞抑制HUVECs VCAM-1、MCP-1、IL-6蛋白水平的表达 流式细胞术(图1A)和ELISA(图1B)表明:和 noT组及25-组相比,25+组VCAM-1(P<0.001)、MCP-1(P<0.01)、IL-6(P<0.01)蛋白水平的表达均显著下降。
2.1.2 调节性T细胞抑制HUVECs VCAM-1、MCP-1、IL-6mRNA水平的表达 与noT组和25-组相比,25+组细胞 VCAM-1(P<0.05)、MCP-1(P<0.01)、IL-6(P<0.01)mRNA水平的表达显著下调(图2)。
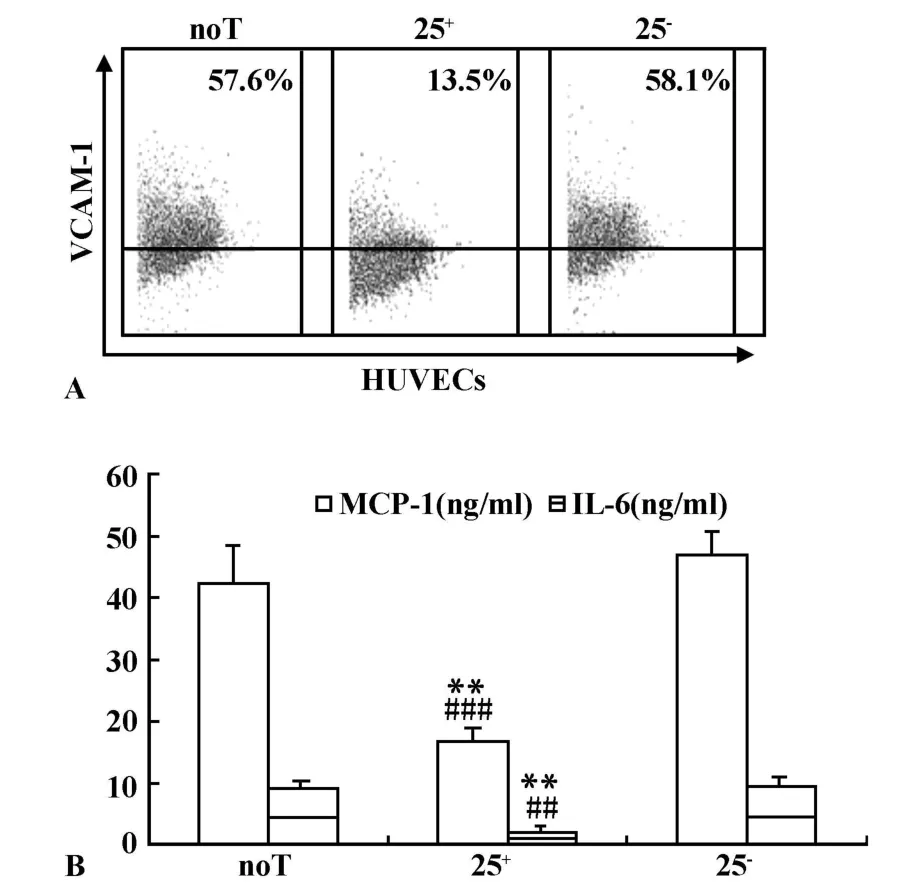
图1 Tregs抑制HUVECs VCAM-1、MCP-1和IL-6蛋白表达Fig.1 Tregs down-regulate protein expression of VCAM-1,MCP-1 and IL-6 in HUVECs im paired by ox-LDL
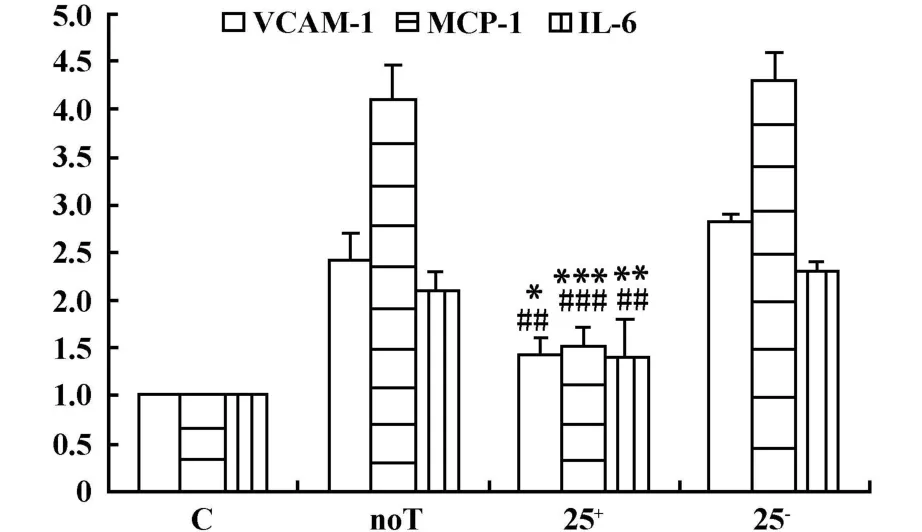
图2 Tregs抑制HUVECs VCAM-1、MCP-1和 IL-6 mRNA表达Fig.2 Tregs down-regulate mRNA expression of VCAM-1,MCP-1 and IL-6 in HUVECs im paired by ox-LDL

图3 Tregs抑制HUVECs VCAM-1,MCP-1和IL-6的表达依赖细胞直接接触与细胞因子Fig.3 Tregs mediated suppression of HUVECs VCAM-1,MCP-1 and IL-6 expression requires both cell contact and solub le factors
2.2 Tregs对HUVECs的抑制作用依赖于细胞直接接触和细胞因子 与noT组相比,CC组HUVECs VCAM-1表达下降79.4%(P<0.001);与noT组相比,TW组HUVECs VCAM-1表达下降40.4%(P<0.01),Tregs对HUVECs的抑制作用可被Transwell小室,anti-IL-10 mAbs和或anti-TGF-βmAbs部分逆转(图 3A)。同样,Transwell小室、anti-IL-10mAbs和或anti-TGF-βmAbs可部分逆转Tregs对MCP-1与 IL-6表达的抑制作用(图3B)。
3 讨论
动脉粥样硬化的发生是血管局部产生的一种慢性炎性增生反应,内皮细胞受损和功能障碍是其早期重要的病理生理变化[1]。
正常情况下,覆盖于血管的内皮细胞可以阻止白细胞粘附于血管壁。然而,AS的触发因素如ox-LDL可刺激内皮细胞高表达粘附分子如VCAM-1,促进炎性细胞如巨噬细胞与T淋巴细胞粘附于受损的血管壁。同时受损的内皮细胞可分泌趋化因子,如MCP-1,促进单核细胞或T细胞以渗出的方式透过内皮细胞层进入内皮下,参与炎症反应[6,7]。而IL-6则可以刺激这一炎症反应中所有相关急性期蛋白的合成并可对凝血瀑布、内皮细胞及脉管系统的其他组分产生影响[8]。提示VCAM-1、MCP-1及IL-6等炎性因子在AS的发生发展过程中起着重要的促进作用。与既往的研究一致,本实验证实,在ox-LDL刺激下,HUVECs可大量表达上述炎性相关因子。
越来越多的研究表明,Tregs在调控动脉粥样硬化炎症反应和发生发展中起重要作用。Tregs既可抑制CD4+T细胞、CD8+T细胞、NK细胞或B细胞,也可抑制天然免疫系统中的单核巨噬细胞,树突状细胞及中性粒细胞的功能[5,9-14]。但Tregs是否抑制内皮细胞炎性因子的表达目前尚无研究。本实验发现,HUVECs与Tregs共培养24小时,HUVECs炎性因子VCAM-1、MCP-1及IL-6表达显著被抑制,说明Tregs除了抑制免疫炎性细胞的功能外,其还可抑制内皮细胞的分泌功能,从而发生抑制AS的作用。
Tregs发生免疫调节的确切机制尚存争议,有的报道认为其调节功能依赖于细胞直接接触;也有报道认为其调节功能是细胞因子介导[15,16]。本实验发现,Tregs与HUVECs共培养后炎性因子如VCAM-1的表达下降79.4%;而用Transwell小室阻断Tregs与HUVECs直接接触后,VCAM-1的表达只下降40.4%,说明Tregs对HUVECs的抑制作用部分依赖于细胞直接接触。在用Transwell小室阻断Tregs与HUVECs直接接触的同时,加入anti-IL-10/anti-TGF-β中和抗体,Tregs对HUVECs的抑制作用进一步被逆转,说明此抑制作用也有抑制性细胞因子如IL-10、TGF-β的参与。
本实验表明,Tregs可抑制ox-LDL诱导损伤的内皮细胞炎性因子如VCAM-1、MCP-1、IL-6的表达;此作用机制可能与Tregs分泌抑制性细胞因子及与内皮细胞直接接触抑制有关。上述发现不仅有助于阐明Tregs在AS发生发展中的调控作用,而且为AS的防治提供了一条新的途径。
1 Hansson G K.Inflammation,atherosclerosis,and coronary artery disease[J].N Engl JMed,2005;352(16):1685-1695.
2 Fraley A E,Schwartz G G,O lsson A Getal.Relationship of oxidized phospholipidsand biomarkersof oxidized low-density lipoproteinwith cardio vascular risk factors,inflammatory biomarkers,and effect of stating therapy in patientswith acute coronary syndromes[J].JAm CollCardiol,2009;53(23):2186-2196.
3 SakaguchiS,YamaguchiT,Normura Tetal.Regulatory T cells and immune tolerance[J].Cell,2008;133(5):775-787.
4 杨克平,李大主,胡英锋etal.抗原特异性调节性T细胞的诱导及其对粥样斑块形成的影响[J].中国免疫学杂志,2007;23(3):208-211.
5 CâmaraN O,Sebille F,Lechler R I.Human CD4+CD25+regulatory cells havemarked and sustained effectson CD8+T cell activation[J].Eur J Immunol,2003;33(12):3473-3483.
6 Peter Libby.Inflammation and cardiovascular diseasemechanisms[J].Am JClin Nutr,2006;83(2):456S-460S.
7 Stangl V,Lorenz M,Ludwig Aetal.The flavonoid phloretin suppressesstimulated expression of endothelial adhesion molecules and reducesactivation of human platelets[J].JNutr,2005;135(2):172-178.
8 Saremi A,Anderson R J,Luo Petal.Association between IL-6 and the extentof coronary athe rosclerosis in the veterans affairs diabetes trial(VADT)[J].Atherosclerosis,2009;203(2):610-614.
9 Wolf A M,Wolf D,SteurerMetal.Increase of regulatory T cells in the peripheralblood of cancer patients[J].Clin Cancer Res,2003;9(2):606-612.
10 JanssensW,Carlier V,Wu Betal.CD4+CD25+T cells lyse antigen presenting B cells by Fas-Fas ligand interaction in an epitope-specific manner[J].J Immunol,2003;171(9):4604-4612.
11 林 静,李大主.CD4+CD25+调节性T细胞对巨噬细胞泡沫化的影响[J].中华微生物学和免疫学杂志,2010;30(2):99-103.
12 Taams L S,Akbar A N.Peripheral generation and function of CD4+CD25+regulatory T cells[J].Curr Top Microbiol Immunol,2005;293:115-131.
13 Tiemessen M M,Jagger A L,Evans H Getal.CD4+CD25+Foxp3+regulatory T cells induce alternative activation of human monocytes/macrophages[J].Proc Natl Acad Sci USA,2007;104(49):19446-19451.
14 Lewkowicz P,Lewkowicz N,Sasiak Aetal.Lipopolysaccharide-activated CD4+CD25+T regulatory cells inhibit neutrophil function and promote their apoptosisand death[J].J Immunol,2006;177(10):7155-7163.
15 Shevach EM,McHugh RS,Piccirillo CAetal.Controlof T-cellactivation by CD4+CD25+suppressor T cells[J].Immunol Rev,2001;182:58-67.
16 Annunziato F,Cosm i L,Liotta Fetal.Phenotype,localization,and mechanism of suppression of CD4+CD 25+humanthymocytes[J].JExp Med,2002;196:379-387.
[收稿2010-06-11 修回2010-07-13]
(编辑 倪 鹏)
CD4+CD25+regulatory T cellsmodulate oxidized low density lipoprotein mediated VCAM-1,MCP-1 and IL-6 expression in human umbilical vein endothelial cells
HEShao-Lin,LIDa-Zhu,LIMing,MAXu-Ming,LINJing,CHANGWei,ZHAOHui.InstituteofCardiology,Union Hospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
Objective:To investigate the effects of CD4+CD25+regu latory T cells(Tregs)on oxidized low-density lipoprotein(ox-LDL)-mediated VCAM-1,MCP-1 and IL-6 expression in human umbilical vein endothelial cells(HUVECs).Methods:HUVECswere incubated alone(noT),with Tregs(25+),or CD4+CD25-T cells(25-)in the presence ofanti-CD3mAbs for48 h,then were stimulatedwith ox-LDL for an additional 24 h.Flow cytometry and ELISA were used tomeasure the expression of inflammatory cytokines like vascu lar cell adhesionmolecule-1(VCAM-1),monocyte chemoattractant protein-1(MCP-1)and interleukin-6(IL-6)in HUVECs responding toox-LDL,respectively.Transwell experimentswere carried to investigate whether suppression of HUVECs inflammatory cytokine expression depended on cell contactor soluble factors.Results:The protein levels of inflammatory cytokines expression in HUVECswere determined by Flow cytometry or ELISA,which showed a significant reduction of inflammatory cytokines(VCAM-1:13.5%±4.0%;MCP-1:16.6±2.0 ng/m l;IL-6:1.9±0.8 ng/ml)in 25+system compared with that in noT system(VCAM-1:57.6%±5.2%;MCP-1:42.4±5.8 ng/m l;IL-6:8.8±1.4 ng/m l)or 25-system(VCAM-1:58.1%±7.1%;MCP-1:46.7±4.0 ng/ml;IL-6:9.3±1.7 ng/ml).The similar effects of Tregs on themRNA levels of inflammatory cytokineexpression in HUVECswereobtained.Moreover,mechanistic studies revealed that Tregs-mediated suppressionof the HUVECs response to ox-LDL required both cell contact and soluble factors.Conclusion:Tregs are able to inhibit the inflammatory cytokines like VCAM-1,MCP-1 or IL-6 response of HUVECs to ox-LDL,which depends on cell contact aswell as soluble factors.
CD4+CD25+Regu latory T cells;Human umbilical vein endothelial cells;Oxidized Low-Density Lipoprotein;Inflammatory cytokines;Transwell
R392.12
A
1000-484X(2010)12-1064-05
10.3969/j.issn.1000-484X.2010.12.002
①本文为国家自然科学基金资助项目(No.30670855)
何少林(1983年-),男,硕士,主要从事冠心病发症机制及其诊断与治疗研究,E-mail:wskg1982@yahoo.com.cn;
及指导教师:李大主(1963年-),男,教授,博士生导师,主要从事冠心病发病机理及其诊断与治疗研究,E-mail:lidazhuhp@sohu.com。
·遗传免疫学·

