黑质自身抗体在MPTP致小鼠帕金森病发病中的作用
张艳玲,李淑蓉,梁亚杰,郭强,文灿,苏炳银*
(1.第三军医大学附属西南医院神经内科,重庆 400038;2.成都医学院发育与再生四川省重点实验室,人体解剖与组织胚胎学教研室,成都 610083;3.第三军医大学基础部神经生物学教研室,重庆 400038)
帕金森病(Parkinson disease,PD)是以黑质致密带腹外侧部(area 9,A 9)多巴胺神经元损害最重为特点的中枢神经系统变性性疾病。其腹内侧部(area 10,A 10)多巴胺神经元损害程度较轻。目前用于解释选择性的多巴胺神经元损害的学说有氧化应激学说、兴奋性毒性学说、钙的细胞毒作用学说以及A 9区特异蛋白的表达等。近些年来,与特异性损害相关的抗体介导的体液免疫在PD发病中的研究屡有报道。研究认为,外周血及脑脊液内存在抗多巴胺(DA)能神经元的自身抗体[1-3],参与PD的发病过程。但是,目前尚未能分离出该自身抗体,自身抗体所针对的抗原亦不明确。本研究利用MPTP导致的PD模型,利用免疫组织化学、酶链免疫吸附测定(ELISA)、蛋白免疫印迹法(Western blot)等方法探讨该PD模型有无自身抗体的存在,并初步推断自身抗体是否参与PD发病过程。
1 材料和方法
1.1 动物分组及模型制作
雄性C57BL/6小鼠野生型(widetype,W T),体重20~25 g,由第三军医大学第三附属医院实验动物中心提供。采用MPTP亚急性模型:使用Sigma公司的MPTP,使用前用生理盐水新鲜配制,腹腔注射,注射剂量30mg/(kg◦d)连续5 d。对照组给予腹腔注射相同体积生理盐水。
1.2 标本采集及处理
完成MPTP腹腔注射后次日为d1,之后为d2、d3……依次类推。造模后10 d(d10),动物麻醉后,采用摘除眼球的方法取不抗凝血,1~2m l,4℃下凝固12 h,3000 r/min离心5 min,取上清液,即为所需要的血清,于-20℃下保存。
取血后采用颈椎脱臼法处死动物,在4℃冰上操作,迅速断头取脑。采用以下方式处理:(1)分离黑质标本,在4℃Zamboni's液中浸泡固定24 h后转移到30%蔗糖/Zamboni's液中脱水2~3 d,脑片沉到液体底部提示脱水完全,至恒冷冰冻切片机做连续切片。(2)每只小鼠的黑质标本,在体视显微镜下尽量去除黑质外的部分,使每只小鼠的黑质净重在30 mg左右,按照每10 m g组织加入100μl PRO-PREPTM Solution,在微量匀浆器中匀浆。使用注射器反复抽吸几次可增加细胞溶解,之后在冰盒或者-20℃的冰箱内孵育30 min;之后14000 r/min(4℃)离心20 min,转移上清液至新的EP管内,-20℃保存。
1.3 实验方案
利用免疫组织化学方法观察黑质冰冻切片与自体血清的反应情况,以期对体液免疫反应部位进行形态学细胞定位;利用ELISA观察黑质蛋白质匀浆与自体血清的反应情况,从蛋白水平验证自体血清中自身抗体的存在;利用Western blot尝试寻找黑质蛋白质匀浆中不同蛋白质与自体血清的结合情况,初步寻找自身抗体的靶抗原。
2 结果
2.1 MPTP注射后PD模型小鼠血清与黑质切片的免疫组织化学研究
2.1.1 PBST的阴性对照 方法:小鼠黑质的冠状切片,一抗为PBST,二抗为生物素化马抗小鼠,三抗为链酶卵白素标记的HRP,DAB显色。
结果:小鼠黑质冠状切片上有血管着色(图1)。
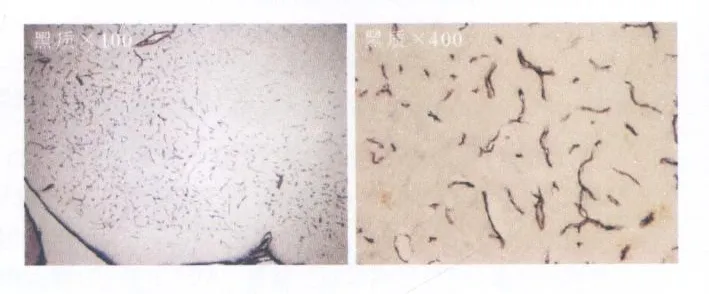
图1 黑质自体血清的免疫组化之PBST阴性对照Fig.1 Immunoenzymatic histochem istry staining w ith PBST negative control in SNpc section

图3 黑质自体血清的免疫组化之异常血清结果Fig.3 Immunoenzymatic histochemistry staining with serum from MPTPm ice in SNpc section

图2 黑质自体血清的免疫组化之正常血清对照Fig.2 Immunoenzymatic histochemistry staining with normal serum control in SNpc section
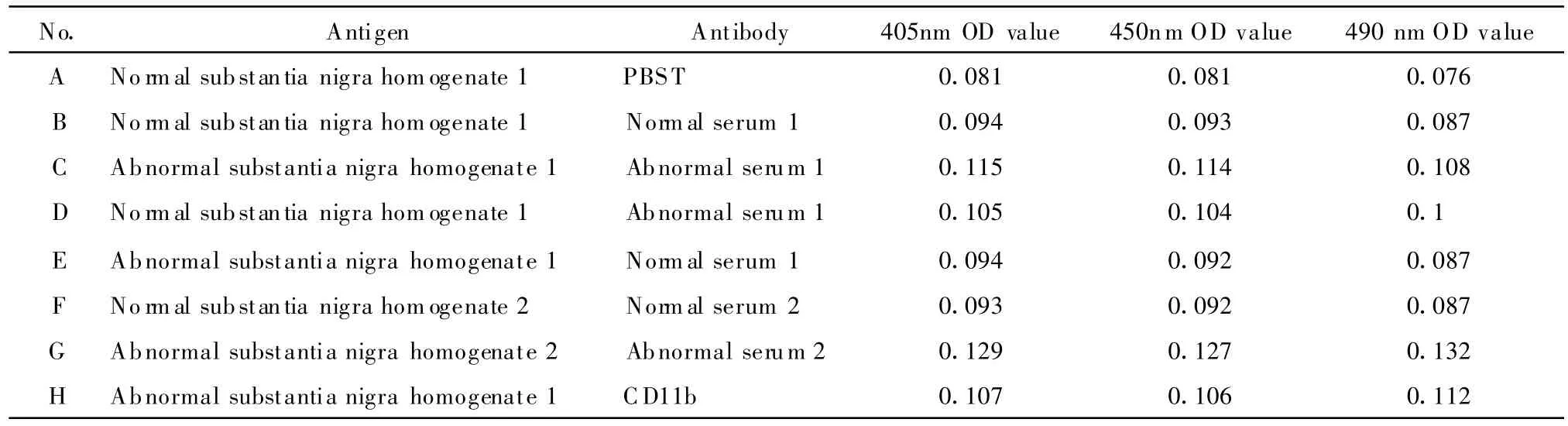
表1 自体血清和黑质蛋白匀浆相互作用的ELISA研究结果Tab.1 The interactive results of ELISA between serum and protein from substantia nigra
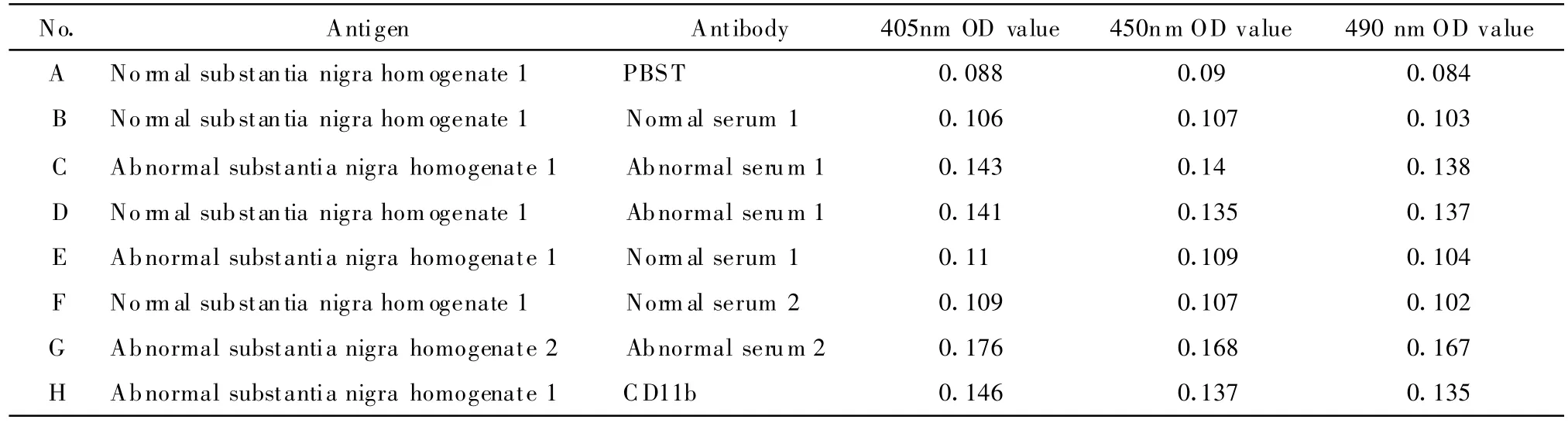
表2 自体血清和黑质蛋白匀浆相互作用的ELISA研究结果Tab.2 The interactive resultsof ELISA between serum and protein from substantia nigra
2.1.2 正常小鼠血清的对照 方法:小鼠黑质的冠状切片(分别选择正常小鼠和MPTP小鼠的黑质切片),一抗为正常小鼠血清,二抗为生物素化马抗小鼠,三抗为链酶卵白素标记的HRP,DAB显色。
结果:小鼠黑质的冠状切片上,有非特异性的弥漫性着色,皮层及脑干内神经元均可着色,但黑质区无明显阳性神经细胞(图2)。
2.1.3 MPTP造模的PD小鼠血清的免疫组化方法:小鼠黑质的冠状切片(分别选择正常小鼠和MPTP小鼠的黑质切片),一抗为MPTP造模的PD小鼠血清,二抗为生物素化马抗小鼠,三抗为链酶卵白素标记的HRP,DAB显色。
结果:除与正常小鼠血清相似的弥漫性着色外,正常脑和MPTP小鼠脑黑质的冠状切片上,有可疑的黑质阳性神经元(图3)。
2.2 MPTP注射后PD病小鼠血清与黑质匀浆的ELISA研究
设立严格的阴性对照和阳性对照,结果举例如下(表1,2):
例1:提示:(1)包被效果好;(2)阴性及阳性对照结果均较理想;(3)正常血清与黑质匀浆的结合性与PBST接近,提示结合力较低;(4)异常血清和正常黑质及异常黑质的结合均较强,考虑是异常血清中的IgG的Fab段与黑质中的抗原有特异性的结合作用的可能。
例2:结果与例1相似,且差异表现更加明显,因此我们认为异常血清和正常黑质及异常黑质的结合均较强,考虑是异常血清小的IgG的Fab段与黑质中的抗原有特异性的结合作用的可能。
2.3 MPTP注射后PD模型小鼠血清与黑质匀浆相互作用的Western blot研究
预染M arker显色较好,条带清晰。阴性对照(PBST作为一抗),可见到多个小细条带,考虑为黑质中含有生物素的蛋白的非特异性的着色。正常血清与正常脑和异常脑相互作用时,均无明显着色。异常血清与正常脑蛋白匀浆(泳道1)和异常脑蛋白匀浆(泳道2)相互作用时,在相对分子质量为35×103处有弱阳性蛋白着色条带,提示脑黑质匀浆中可能有相对分子质量为35×103的蛋白,和患病血清中的抗体结合(图4)。
3 讨论
本研究中,各种研究方法(免疫组化,ELISA,Western blot)均提示MPTP导致的小鼠亚急性PD模型的外周血中,可能存在与黑质蛋白成分有特异性结合的抗体。

图4 Western b lot结果Fig.4 Results ofW estern blot
3.1 自身抗体与PD发病关系的研究现状
自身抗体和PD的关系一直是有争议的话题。自1971年左右已经有研究关注到PD患者存在体液免疫的改变[4]。Abramsky等[5]研究认为PD中存在针对DA受体的自身免疫反应,可能是一种抗体样的物质阻断了受体,从而参与了PD的发病过程。1980年的一项研究中认为PD患者血液中存在有针对交感神经元的自身抗体[6]。1例PD男性患者的个案报道中,研究发现患者存在IgM免疫球蛋白病(IgM gammopathy),患者的血清对脑蛋白具有抗体活性,通过Western blot发现患者血清中有抗体和来自黑质相对分子质量为156×103的蛋白反应,也可以和来自大脑皮层灰质、小脑皮层、壳核、丘脑或苍白球的相对分子质量为130×103的蛋白反应[7]。Carvey等[8]在PD移植治疗的研究中认为,纹状体移植肾上腺髓质后,可能在纹状体源性的DA能神经元营养因子的作用下,使有争议的抗DA能自身抗体减少。研究者在培养的黑质DA神经元中,同样证实了PD患者脑脊液中的IgG可攻击DA神经元,移植治疗可减轻攻击情况[9]。中枢神经系统Sjögren's综合征(CNS-SS)中,患者表现的PD样症状可能与抗心磷脂抗体有关[10]。
1998年研究者[11]使用特异性抗原的电泳免疫测定的方法(antigen-specific EIAs),测定了神经微丝重亚基(neurofilament heavy subunit)、微管蛋白(tubulin)、神经胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、S100蛋白、tau蛋白、beta淀粉样肽(beta-am yloid peptide)、髓磷脂碱性蛋白(myelin basic protein,MBP)和硫酸类肝素蛋白多糖(heparan su lfate p roteog lycan)。研究发现PD患者的血清和脑脊液中出现微管蛋白自身抗体的几率增加,但没有发现其它的自身抗体的几率增加。2001年协和医院的一项研究认为,PD患者中存在自身抗体,能加重PD病情的进展[12]。2006年在一例EB病毒性脑炎伴随PD症状的患者中,发现患者体内有自身抗体,可以和人神经母细胞瘤的细胞株表达的大约130×103的抗原反应[13]。2006年利用Western blot研究发现PD患者血清和黑质蛋白有相互作用[14]。2007年最近的报道提示遗传性PD患者血清中有抗alpha-synuclein的自身抗体[15]。2007年另外的一项研究发现,PD血清中针对胰岛素和S100B的自身抗体增加。并且认为这种改变和PD进展有关[16]。此外,还有研究认为针对钾通道的自身抗体[17]、针对钙通道的自身抗体[18]和针对神经节苷脂的自身抗体[19]参与PD的发病过程。从历年的研究中我们知道:PD患者血清中的自身抗体是长期被关注的一个研究课题,但是该课题一直没有明确肯定、且能对治疗卓有成效的结论。因此研究结论也是备受争议的。但是从众多的研究中,研究者还是确信有一种自身抗体可能参与了黑质多巴胺神经元的损伤过程。因此我们认为,鉴定该抗体及抗原,可能对延缓PD疾病的进程起一定作用。
3.2 本研究结果提示,PD小鼠血清中可能存在自身抗体,但未能成功分离黑质抗原,原因是什么?能怎样改进?
本实验中,我们使用最基本的研究方法,初步探讨了PD动物模型和PD患者血清中是否有针对黑质蛋白匀浆的自身抗体的问题。实验中设立了较严格的阴性和阳性对照,因此可以从实验结果中初步总结:可能有一种自身抗体能够和黑质的蛋白成分反应。该自身抗体的靶蛋白在黑质,并且可能在神经元上,有一相对分子质量35×103的黑质蛋白可能和自身抗体结合,可能是寻找中的靶蛋白。
但是遗憾的是,我们没有能够鉴定出靶蛋白。原因如下:①结果背景和阳性结果间差异不够显著,是结论的肯定性不够高;②与报道中不同,本实验中发现的阳性条带分子质量均较低,和文献报道的有差异,考虑是我们选择电泳的体系受限制,本实验体系对大分子量的蛋白分离不佳,结果可能具有片面性。
进一步研究本课题方向,可能有以下方面可以改进:(1)抗体角度:血清中因为蛋白质种类繁多,可能导致实验中背景信号增高,和阳性结果的差异减小,从而可能影响结果的判读。因此以后的实验中,可以首先分离血清中的免疫球蛋白,然后分别作为抗体去尝试使用,可能在一定程度能提高阳性结果的判断;另外,也可以选用脑脊液的免疫球蛋白同时对照研究,可能能使实验更加严格。也可以借助其它实验中使用的方法,从已知蛋白中去分析,寻找PD患者中可能的自身抗体。(2)抗原角度:以往研究者也曾经报道,抗体是多样的。因此,我们在寻找黑质抗原的过程中,一个比较单纯的抗原体系也是尤其重要的。
本研究因为是初步探讨,使用的是涵盖面很广的黑质蛋白匀浆,其中包括的成分较多。因此本研究结果,只能体现PD的自身抗体能对黑质成分有反应,但不能说明该抗原是来源于哪些种类的细胞。因此,如果能够将抗原体系分类纯化,可能有利于深入的研究。我们认为,将抗原分类纯化的方法有以下几种:(1)将黑质在解剖镜下分离后,进行急性神经元分离的步骤,是黑质神经元在保持活性的状态下,进行快速免疫荧光染色。使用不同的抗体,可以分离出A 9区和A 10区多巴胺神经元。通过流式细胞仪可以将两类多巴胺神经元分离并纯化。因此我们可以得到纯的A 9区和A 10区多巴胺神经元。再分别进行蛋白匀浆,备后续实验使用。(2)黑质神经元的培养,目前已经有培养黑质神经元的成熟方法。在合适的培养体系下,可以得到纯度较高的黑质多巴胺神经元,可以达到一定的纯化抗原的目的。(3)激光捕获显微分离A 9,A 10区DA能神经元:该方法是保持抗原状态的最好的方法,但是目前国内使用和开展尚少,还需要再进一步摸索这种方法在研究本课题的适用性。
4 结论
亚急性MPTP小鼠的帕金森病模型及PD患者中,外周血中可能存在针对黑质结构的自身抗体。PD的自身抗体可能能与黑质中相对分子质量为35×103的蛋白质有反应。
[1] He Y,LeWD,Appel SH.Role of Fcgamma receptors in nig ral cell inju ry indu ced by Parkinson disease immunoglobu lin injection into mouse substantia nigra[J].Exp Neu rol,2002,176(2):322-327.
[2] Fiszer U.Does Parkinson's disease have an immunologicalbasis?The evidence and its therapeu tic implications[J].Bio Drugs,2001,15(6):351-355.
[3] Chen S,Le Wi,Xie W J,et al.Experim en tal destruction of substantia nig ra initiated by Parkinson disease immunoglobulins[J].A rch Neu rol,1998,55(8):1075-1080.
[4] Henry RE,Goldberg ls,Stu rgyeon P,et al.Serologic abnorm alities associated w ith L-dopa therapy.Vox Sang,1971,20(4):306-316.
[5] Abram sky O,Litvin Y.Autom immune response to dopam inereceptor as a possible mechanism in the pathogenesis of Parkinson's disease and schizoph renia[J].Perspect Biol M ed,1978,22(1):104-114.
[6] Emile J,Poup lard A,Bossu Van Nieuwenhuyes C,et al.Parkinson's disease,dysautonomy,and auto-antibodies directed against sympatheticneu rones(author's transl)[J].Rev Neurol(Paris),1980,136(3):221-233.
[7] Tanaka K,Nakajim a T,A tsum i T,et al.Serum an tibodies to brain proteins in a patient with parkinsonism associated with IgM paraproteinemia[J].Jpn JMed,1988,27(3):300-304.
[8] Carvey PM,McRae A,Ptak LR,et al.Disappearance of a putative DA-neuron an tibody following adrenal medulla transplantation:relationship to a striatal-derived DA neuron trophic factor[J].Prog Brain Res,1990,82:693-697.
[9] Dahlström A,Wigander A,Lundm ark K,et al.Investigations on auto-antibodies in Alzheimer's and Parkinson's diseases,using defined neuronal cultures[J].J Neural Transm Suppl,1990,29:195-206.
[10] Mochizuki H,Okauo M,Masaki T,et al.A case of Sjogren's syndrome with a high titer of anticardiolipin antibody that developed as parkinsonism[J].Rinsho Shinkeigaku,1997,37(1):57-59.
[11] Terryberry JW,Thor G,Peter JB.Autoan tibodies in neurodegenerative diseases:antigen-specific frequencies and in trathecalanalysis[J].Neurobiol Aging,1998,19(3):205-216.
[12] Chen J,Cao X,Xu Y,et al.Experimentalstudy of serum substantia nigra neuron autoan tibody and its effect in Parkinson disease patients[J].J Tongji Med Univ,2001,21(4):280-282.
[13] Roselli F,Russo I,Fraddosio A,et al.Reversible Parkinsonian syndrome associated with anti-neu ronal an tibodies in acute EBV encephalitis:a case report[J].Parkinsonism Relat Disord,2006,12(4):257-260.
[14] Huber VC,Mondal T,Factor SA,et al.Serum antibodies from Parkinson's disease patients react with neuronal membrane proteins from amouse dopaminergic cell line and affect its dopamine expression[J].JNeu roinflamm ation,2006,3:1.[15] Papachroni KK,Ninkina N,Papapanagiotou A,et al.Autoantibodies to alpha-synuclein in inherited Parkinson's disease[J].JNeurochem,2007,101(3):749-756.
[16] Wilhelm KR,Yanamandra K,Graden M A,et al.Immune reactivity towards insulin,its a my loid and protein S100B in blood sera of Parkinson's disease patients[J].Eur J Neurol,2007,14(3):327-334.
[17] Vincent A,Buckley C,Schott JM,et al.Potassium channel antibody-associated encephalopathy:a potentially immunotherapy-responsive fo rm of limbic encephalitis.Brain,2004,127(Pt 3):701-712.
[18] AppelSH,Smith RG,Alexianu M,et al.Neurodegenerative disease:autoimmunity involving calcium channels[J].Ann N Y Acad Sci,1994,747:183-194.
[19] Zappia M,Crescibene L,Bosco D,et al.Anti-GM 1 ganglioside antibodies in Parkinson's disease[J].Acta Neurol Scand,2002,106(1):54-57.