乳酸杆菌对系统性白色念珠菌感染小鼠保护作用的实验研究
高云星,董 群
(皖南医学院 微生物学与免疫学教研室,安徽 芜湖 241002)
乳酸杆菌是人体消化道与生殖道黏膜的主要益生菌。它们在机体内发挥生物拮抗,维持微生态平衡,调节免疫,抗肿瘤等作用,随着科技的发展,乳酸杆菌的研究范围不断拓展,其在抑制致病菌生长与增强机体免疫功能方面的研究正日趋受到关注。本实验以系统性白色念珠菌感染小鼠为模型,从增强小鼠细胞免疫功能角度探讨乳酸杆菌对深部真菌感染小鼠保护作用的机理。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康K M系小鼠40只,8~10周龄,雌雄各半,体重23~25 g,购于南京医科大学医学实验动物中心。
1.1.2 菌种 Lactobacillus.acidophilus(嗜酸乳酸杆菌),本室保存菌种,经API-CH50系统鉴定;Candida.albicans(白色念珠菌)标准菌株:AX2-2086,购于广州市微生物研究所。
1.1.3 主要试剂和仪器 MRS肉汤、沙堡弱培养基、RPM I-1640培养液、小牛血清、小鼠IFN-γ、 IL-12试剂盒、Anthos lucy2安图酶标仪、生物安全柜、CO2培养缸。
1.2 方法
1.2.1 系统性白色念珠菌感染小鼠模型建立[1]用NS将环磷酰胺配制成20 mg/ml注射液,按200 mg/kg标准根据小鼠体重计算注射液量后,对小鼠一次性腹腔注射,96 h后行尾静脉接种浓度为2×106/ml白色念珠菌菌液,每只0.2 ml。
1.2.2 分组与给药 造模完成后将40只小鼠随机分为生理盐水对照组,低剂量、中剂量、高剂量组,每组10只,24 h后分别给予腹腔注射生理盐水、1×108、1×109、1×1010/ml乳酸杆菌悬液0.2 ml/d×10 d。
1.2.3 EL ISA法测小鼠血清IFN-γ、 IL-12水平 最后一次腹腔注射乳酸杆菌悬液24 h后,摘小鼠眼球取血,参照试剂盒说明书测小鼠血清中IFN-γ、 IL-12浓度。从已平衡至室温的密封袋中取出所需板条。除空白孔外,分别将标本或不同浓度标准品(50μl/孔)加入相应孔中,用封板胶纸封住反应孔,37℃水浴箱水浴30 min,洗板5次,拍干。除空白孔外,加入酶标试剂(50μl/孔),封住板孔,37℃水浴箱水浴30 min,洗板5次,拍干。每孔加入显色剂A(50 μl/孔),再加入显色剂B(50μl/孔),避光37℃温箱显色10 min。每孔加入终止液(50μl/孔),混匀后即刻以空白孔调零测量各孔OD450值。空白孔仅加入显色剂A、B和终止液。根据标准品浓度及其OD450值计算出标准曲线的回归方程,再根据标本的OD450值计算出对应的标本浓度。
1.2.4 MTT法测小鼠脾脏T淋巴细胞增殖活性眼球取血后脱颈椎处死小鼠,无菌取出小鼠脾脏,制备成5×106/ml脾细胞悬液,将脾细胞悬液加入96孔培养板MTT法测脾淋巴细胞增殖活性。
1.2.5 计算小鼠肾负荷真菌数 眼球取血后脱颈椎处死小鼠,无菌取出小鼠肾脏,研碎,用生理盐水制成10倍稀释系列,取10-3稀释度悬液1 ml注入平板,同时倒入灭菌冷却至50℃的沙堡弱氏培养基,混匀,冷凝后置于37℃温箱培养,48 h后计数平板菌落数,计算出肾负荷真菌数。
1.2.6 数据分析 采用SPSS 13.0软件进行统计分析。数值变量资料以表示,多组均数间的比较采用F检验,多组均数之间两两比较采用SN K法(q检验)。
2 结果
2.1 乳酸杆菌对感染小鼠血清IFN-γ、 IL-12水平的影响 由表1、2可见,中、高剂量组感染小鼠血清IFN-γ、 IL-12浓度与对照组、低剂量组有明显差异(P<0.05),而低剂量组与生理盐水对照组之间无统计学差异(P>0.05)。说明乳酸杆菌可提高感染小鼠体内IFN-γ、 IL-12的水平,且在一定范围内与乳酸杆菌剂量呈正相关。
表1 各组小鼠血清中IFN-γ的浓度Tab 1 Serum level of IFN-γin each group
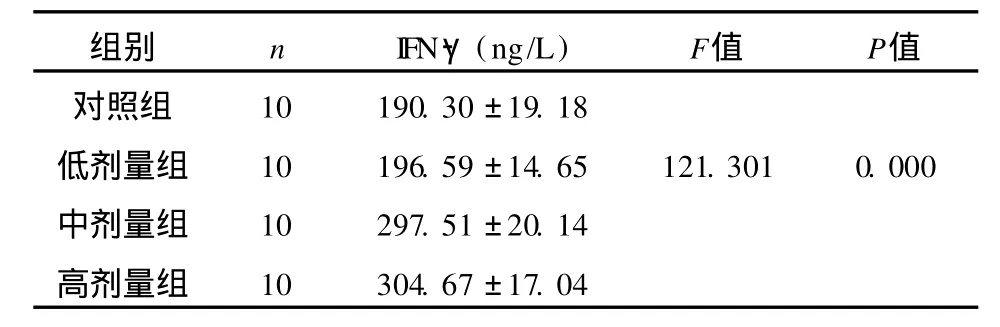
表1 各组小鼠血清中IFN-γ的浓度Tab 1 Serum level of IFN-γin each group
注:多组之间两两比较时,对照组与低剂量组之间、中剂量组与高剂量组之间无统计学意义,P>0.05;其余各两组之间具有统计学意义,P<0.05
组别nIFN-γ(ng/L)F值P值对照组10190.30±19.18低剂量组10196.59±14.65121.3010.000中剂量组10297.51±20.14高剂量组10304.67±17.04
表2 各组小鼠血清中 IL-12的浓度Tab 2 Serum level of IL-12 in each group

表2 各组小鼠血清中 IL-12的浓度Tab 2 Serum level of IL-12 in each group
注:多组之间两两比较时,对照组与低剂量组之间、中剂量组与高剂量组之间无统计学意义,P>0.05;其余各两组之间具有统计学意义,P<0.05
组别n IL-12(ng/L)F值P值对照组102.209±0.214低剂量组102.252±0.215374.7300.000中剂量组104.117±0.139高剂量组104.194±0.144
2.2 乳酸杆菌对感染小鼠脾脏T淋巴细胞增殖活性的影响 由表3可见,腹腔注射中、高剂量乳酸杆菌后小鼠脾脏T淋巴细胞增殖活性明显增强,与对照组、低剂量组之间有明显差异(P<0.05)。说明一定剂量的乳酸杆菌可增强小鼠脾脏T淋巴细胞增殖活性,提高小鼠细胞免疫功能。
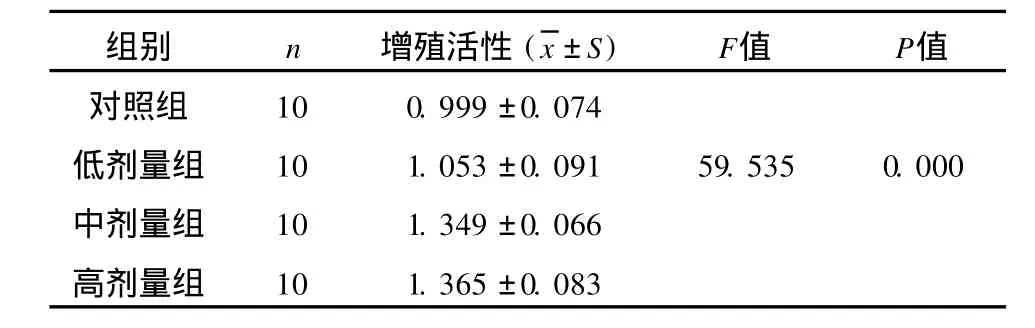
表3 各组小鼠脾脏T淋巴细胞增殖活性(¯x±s)Tab 3 Spleen T-lymphocyte proliferation activity of each group
2.3 各实验组小鼠肾负荷真菌数 由表4可见,中、高剂量组感染小鼠肾脏负荷真菌量较对照组、低剂量组明显减少(P<0.05),说明腹腔注射一定剂量的乳酸杆菌能对感染小鼠起保护作用,其机制可能为增强小鼠细胞免疫功能。

表4 各组小鼠肾脏负荷的真菌量(¯x±s)Tab 4 The amount of kidney fungal load of each group
3 讨论
乳酸杆菌是一类革兰阳性厌氧或微需氧的杆菌,发酵糖类产乳酸。是脊椎动物消化道与生殖道黏膜的主要益生菌。它们在宿主体内发挥生物拮抗,维持机体微生态平衡,调节免疫,抗肿瘤等作用[2]。白色念珠菌是一种寄生在健康宿主的消化道、呼吸道和女性生殖道黏膜的机会性致病菌。一旦机体的免疫力下降或者正常的菌群平衡被破坏,它就会在黏膜下大量繁殖,侵入深层组织,引起系统性念珠菌感染[3]。
机体抗白色念珠菌的免疫反应是一个极其复杂的过程,大量临床和动物实验证明细胞免疫应答反应在抗白色念珠菌感染中发挥了主导作用[4]。通过建立T细胞缺陷和细胞因子缺陷的小鼠模型,许多学者证明了各种亚群T细胞在宿主与白色念珠菌的相互作用过程中具有重要的调节和效应作用。特别是CD4+Th细胞和细胞因子,它们将抗体的形成和免疫效应细胞的杀伤作用联系在一起,共同构成机体抵抗念珠菌的可调控网络[5]。 IL-12可刺激激活的T细胞和NK细胞增生产生IFN-γ,促进Th1细胞的形成。IFN-γ不仅能增强巨噬细胞的杀菌活性,而且能使静止的T细胞向Th1细胞分化,活化NK细胞等[6]。本实验研究表明,一定剂量乳酸杆菌可通过提高白色念珠菌感染小鼠血清IFN-γ、 IL-12水平增强感染小鼠的细胞免疫功能,从而对感染小鼠发挥保护作用。还可明显增强小鼠脾细胞对ConA刺激的增殖反应。其机制可能为乳酸杆菌的DNA含有大量的非甲基化CpG二核苷酸为核心的重复序列,具较强的免疫调节活性。乳酸杆菌的代谢产物或细菌降解产物可与巨噬细胞、树突状细胞表面的Toll样受体结合,激活了巨噬细胞、树突状细胞并释放细胞因子,这些细胞因子又可诱导宿主其他免疫细胞的应答,提高免疫细胞再循环而活化全身免疫系统[7],还可提高T细胞针对有丝分裂原的增殖能力,使T细胞的数目增多[8]。从而增强了感染小鼠的细胞免疫功能,对小鼠抗白色念珠菌的感染起到了积极的保护作用。
[1]熊延靖,王萍,董群.免疫抑制小鼠系统性白色念珠菌感染模型建立的研究[J].皖南医学院学报,2008,27(6):403-405.
[2]任月,袁杰利.乳酸杆菌及其免疫治疗作用研究进展[J].中国微生态杂志,2005,17(5):392.
[3]MAERTENSJ,VREBOS M,BOOGAERTS M.Assessing risk factors for systemic fungal infections[J].Eur J Cancer Care,2001,10:56-62.
[4]WORMLEY FL JR,CUTR IGHT J,F IDEL PL JR.Multiple experimental designs to evaluate the role of T-cell-mediated immunity against experimental vaginal Candida albicans infection[J].Med Mycol,2003,41(5):401-409.
[5]ROMAN IL. Immunity to Candida albicans:Th1,Th2 cells and beyond[J].CurrOp in Microbiol,1999,2:363-367.
[6]熊延靖,董群.干扰素-γ在抗系统性白色念珠菌感染中的作用[J].热带病与寄生虫学,2008,6(2):113-116.
[7]TAKESHIM,AK IM ITSU T,HARUO I,et al.Antitumor activity and action mechanisms of Lactobacillus casei through the regulation of immune responses[J].Bio Factors,2004,(22):63-66.
[8]L IM B K,MAHENDRAN R,LEE Y K,et al.Chemopreventive effect of Lactobacillus rhamnosus on growth of a subcutaneously implanted bladder cancer cell line in the mouse[J].Jpn J Cancer Res,2002,93(1):36-41.
- 皖南医学院学报的其它文章
- 《皖南医学院学报》作者群现状及基金论文定量分析

