离体脊髓运动神经元兴奋性突触传递的双脉冲易化和抑制
金建慧,江 潇,汪萌芽
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
突触传递的可塑性是指突触前神经元的反复活动导致突触传递效能的短时程和长时程改变,其中短时程突触可塑性通常由短串的突触前刺激引起,持续时间通常在数十秒之内,包括易化(facilitation)、压抑(depression)、增强(potentiation)和强直后增强(post-tetanic potentiation,PTP)等[1]。由两次刺激强度相同、间隔时间为毫秒级的双脉冲刺激(paired-pulse stimulation,PPS)所诱发的突触反应改变,是一种短时程的突触可塑性,通常用双脉冲比值(paired-pulse ratio,PPR)即刺激2与刺激1诱发突触反应幅度之比,来表示突触反应变化的方向和大小,PPR>1为双脉冲易化(paired-pulse facilitation,PPF),而PPR<1为双脉冲抑制(paired-pulse depression,PPD)。尽管PPF和PPD二者已被发现广泛存在于海马、皮层、丘脑等多种神经回路中[2],也有研究报道短时程突触可塑性与小脑运动任务学习相关[3],但脊髓作为运动控制的初级中枢,其与某些运动技巧相关的学习记忆功能仍未得到系统的研究。因此,我们采用新生大鼠脊髓切片运动神经元(motoneuron,MN)细胞内记录技术,观察对同侧背根(iDR)和腹外侧索(iVLF)施加不同脉冲间隔(ISI)的PPS,在MN诱发的兴奋性突触后电位(EPSP)的双脉冲易化和抑制现象。
1 材料和方法
1.1 实验动物与标本制备 取7~14 d龄新生SD大鼠,雌雄不拘,参照报道方法[4],乙醚麻醉后行椎板切除术,分离出腰骶段脊髓,用振荡切片机(Vibratome)切取数片脊髓横向厚片(400~500μm),置室温下用95%O2和5%CO2混合气体饱和的人工脑脊液(ACSF)孵育30~60 min备用。
1.2 电生理记录与刺激方式 将脊髓切片放于自制的全浸式记录浴槽,用上、下两个丝网相夹固定,经恒流泵持续灌流经混合气体饱和的ACSF,浴槽内溶液温度保持22~25℃。取内充3 mol/L乙酸钾、尖端阻抗为70~160 MΩ的玻璃微电极,在体视显微镜下对脊髓腹角进行细胞穿刺,记录到的电信号经Axoclamp-2B微电极放大器(Axon Instruments,USA)放大后,通过DigiData 1200转换接口(Axon)输入计算机,用pClamp 7.0软件(Axon)进行采样、记录和贮存。细胞内电流注射由微机触发,信号经Dig iData 1200联机接口至微电极放大器,再由探头输出经微电极注入细胞内。
同侧腹根(iVR)、iDR和iVLF电刺激,由三通道电刺激器产生的方波脉冲,经隔离器以恒压模式通过同芯双极刺激电极施加。通过刺激电极对 iDR和iVLF施加单脉冲、波宽0.1~0.4 ms、10~100 V、0.1~0.2 Hz的测试刺激,在MN记录相应的 iDREPSP和iVLF-EPSP,稳定记录15 min后,每隔6 min记录一次由刺激电极在iDR和(或) iVLF施加PPS诱发的EPSP,PPS的ISI为30~150 ms,波宽0.1~0.4 ms,电压10~100 V。
1.3 数据分析 记录的资料用pClamp 8.0中的Clampfit 8.1软件(Axon)进行测量和分析。用Origin 5.0软件(Microcal,USA)进行数据统计,结果以¯x±s表示。两组均数比较用配对t检验、两组t检验进行统计学显著性检验,多组均数比较用单因素方差分析,出现率比较用χ2检验,P<0.05为差异有显著性意义。
EPSP幅度的测量:取1 min内5~10次测试记录所得平均记录线的EPSP幅度值,如果EPSP上爆发AP,则取首次出现的AP阈值水平。
PPR的计算:第2个脉冲刺激诱发的EPSP2幅度与由第1个脉冲刺激诱发的EPSP1幅度的比值,即PPR=EPSP2/EPSP1。当PPR>1为PPF,PPR<1为PPD。
2 结果
2.1 双脉冲电刺激iDR诱发的PPF和PPD 在16个测试的MN,对iDR进行ISI为30 ms的PPS,结果显示有14个(87.5%)MN的 iDR-EPSP表现为PPF,PPR值为1.68±0.74(配对t检验,P<0.01,图1),另2个MN表现为PPD。在20个测试的MN进行ISI为50 ms的PPS,有13个(65.0%)MN的iDR-EPSP表现为PPF,PPR值为1.50±0.40(配对t检验,P<0.01),另7个MN表现为PPD,PPR值为0.72±0.12(配对t检验,P<0.01,图2)。
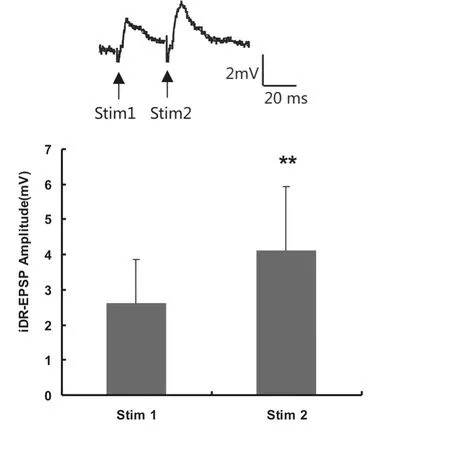
图1 同侧背根(iDR)施加脉冲间隔30 ms的双脉冲电刺激在MN诱发的双脉冲易化Fig 1 Paired-pulse facilitation of iDR-EPSPs elicited by iDR paired-pulse stimulation(PPS)with interst imulation interval(ISI)of 30 ms
在ISI为50 ms的PPS所诱发的 iDR-EPSP中,用刺激2诱发的iDR-EPSP2的幅度,对刺激1诱发的iDR-EPSP1的幅度作图显示,不仅可以用斜率为1的直线划分PPF和PPD,同时PPF或PPD的出现与iDR-EPSP1的幅度有关,iDR-EPSP1幅度低者出现PPF,而高者出现PPD(图2C)。
对呈现PPF的5个MN,进行同细胞测试ISI为30 ms和50 ms的PPR值比较,结果见图3(配对t检验,P>0.05)。
2.2 双脉冲电刺激iVLF诱发的PPF和PPD 在记录到iVLF-EPSP的MN,对iVLF进行ISI分别为30 ms、50 ms、100 ms、150 ms的PPS,结果表明(图4):
ISI=30 ms时,在19个MN中有18个(94.7%)MN的iVLF-EPSP表现为PPF,其PPR值为1.87±0.74(配对t检验,P<0.01),另1个MN表现为PPD。
ISI=50 ms时,在49个MN中有46个(93.9%)MN的iVLF-EPSP表现为PPF,其PPR值为1.70±0.52(配对t检验,P<0.01),其余3个MN表现为PPD,PPR值为0.74±0.19(配对t检验,P>0.05)。
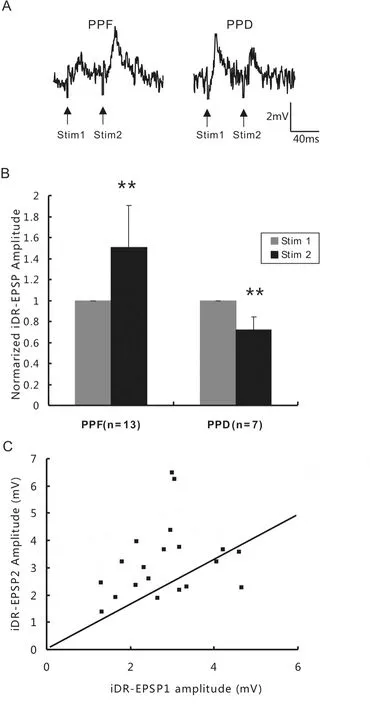
图2 iDR施加脉冲间隔为50 ms的PPS在MN诱发的双脉冲易化和双脉冲抑制Fig 2 Paired-pulse facilitation and depression of iDR-EPSPs elicited by iDR PPSwith ISIof 50 ms
ISI=100 ms时,在29个MN中有26个(89.6%)MN的iVLF-EPSP表现为PPF,其PPR值为1.42±0.36(配对t检验,P<0.01),另3个MN表现为PPD,PPR值为0.74±0.23(配对t检验,P>0.05)。
ISI=150 ms时,在25个MN中有19个(76.0%)MN的iVLF-EPSP表现为PPF,其PPR值为1.37±0.31(配对t检验,P<0.01),另外6个MN表现为PPD,其PPR值为0.90±0.07(配对t检验,P<0.05,图5)。
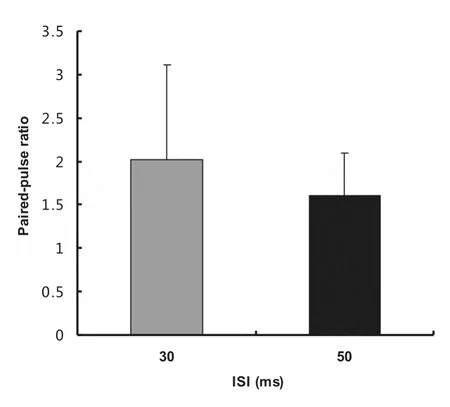
图3 同MN由ISI为30 ms和50 ms的iDR双脉冲刺激诱发双脉冲易化的比较Fig 3 Comparison of PPF of iDR-EPSPs induced by pairedpulse stimuluswith two different ISIs
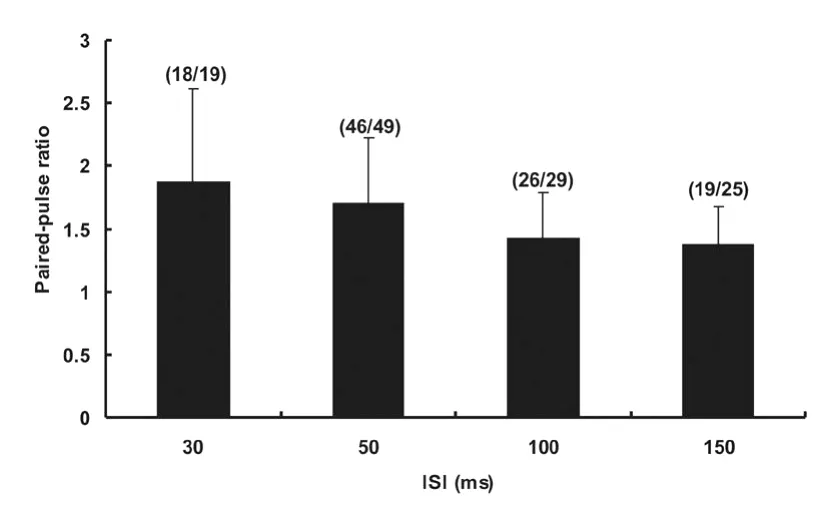
图4 不同ISI双脉冲电刺激在MN诱发iVLF-EPSP双脉冲易化的比较Fig 4 Comparison of PPF among iVLF-EPSPs induced by paired-pulse stimulation with four different ISIs
将上述4种ISI的PPS表现为PPF的MN,进行PPR值的比较显示,随着ISI的延长PPR值逐渐降低(单因素方差分析,P<0.01,图4)。
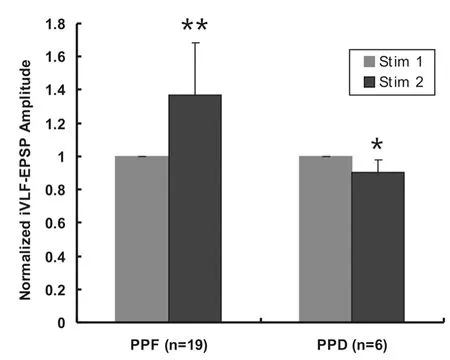
图5 对iVLF施加ISI为150 ms的双脉冲电刺激在MN诱发PPF和PPDFig 5 Paired-pulse facilitation and depression of iVLF-EPSPs elicited by the paired-pulse st imuli(ISI=150 ms)
2.3 iDR-EPSP与iVLF-EPSP的PPF出现率比较对上述在iDR-EPSP和iVLF-EPSP都进行测试的ISI,进行PPF出现率的比较,结果显示在ISI=30 ms的测试中, iDR-EPSP的PPF出现率为87.5%,而iVLF-EPSP为94.7%,比较结果P>0.05。但是,在ISI=50 ms的测试中,iDR-EPSP的PPF出现率为65.0%,而 iVLF-EPSP为93.9%,比较结果P<0.01。
3 讨论
突触可塑性是指突触在形态和功能上的可变性,是神经系统可塑性的主要和关键部分,包括短时程突触可塑性和长时程突触可塑性。PPF和PPD都属于活动依赖性的短时程突触可塑性,通常应用PPR来评价,PPF引起突触效能增加,PPD导致突触效能降低,其产生主要依赖于由胞内Ca2+水平变化所导致的神经递质释放概率的变化,二者可能与输入信号的识别及处理有关[5]。PPF和PPD不仅能加强突触传递的精确性,而且可影响神经调制和长时程可塑性的表达[6]。
本实验对脊髓 iDR通路和iVLF通路施加不同ISI的PPS,均可在MN上记录到iDR-EPSP和iVLFEPSP的PPF(P<0.01)和(或)PPD现象,而且随ISI增大而PPR降低。PPF是由于第1个刺激脉冲到来时,导致突触前末梢Ca2+浓度升高,相隔很短时间的第2个刺激脉冲作用时,源于第1个刺激的残余Ca2+提高了第2次的递质释放概率,因而突触反应得到增强[5];PPD是由于第1个刺激脉冲引起大量的囊泡释放,当第2个刺激脉冲作用时,可释放囊泡减少,因而突触反应减弱,除此之外,PPD还可能与自身受体的失敏和Ca2+通道的失活等因素有关[7,8]。本实验结果还显示,用同一ISI的PPS,MN的iDR和iVLF通路的突触反应即 iDR-EPSP幅度和iVLF-EPSP幅度既可以表现为PPF,也可以表现为PPD现象,这与文献报道的很多突触既能表现PPF,又能同时或不同时地表现出PPD相吻合,二者之间的相对制衡决定着神经网络中突触效能的变化。对iDR通路和iVLF通路施加相同刺激间隔(ISI=50 ms)的PPS,我们观察到iVLF-EPSP的PPF出现率高于iDR-EPSP,可能提示iDR通路和iVLF通路的神经递质释放概率可能不同。神经递质释放概率低的突触,以PPF为主;神经递质释放概率高的突触,常表现为与上述相反的效果,即以PPD为主[9]。因此,不同通路中递质释放概率的差异可能是短时程可塑性表现不同的重要原因。
脊髓具有不同形式的可塑性,脊髓腹角运动系统的可塑性在运动技能的学习[10,11]以及运动技巧的记忆储存[12]过程中发挥重要作用,而且可以发生于不同的神经元和突触位点,并由不同的机制介导。对于脊髓MN短时程可塑性的深入研究,可以使我们更好地理解脊髓运动环路的信息处理方式和脊髓MN可能的运动学习记忆功能,同时也有助于探索脊髓MN的长时程突触可塑性的机制。
[1]ZUCKER RS,REGEHR WG.Short-term synaptic plasticity[J].Annu Rev Physiol,2002,664:355-405.
[2]RAMSEY MM,WE INER JL,SONNTAG WE,et al.Growth hormone treatment attenuates age-related changes in hippocampal short-term plasticity and spatial learning[J].Neuroscience,2004,129(1):119-127.
[3]PEKHLETSKI R,GERLA I R,HUANG XP,et al. Impaired cerebellar synaptic plasticity and motorper for mance inmice lacking the mGluR4 subtype of metabotropic glutamate receptor[J].J Neurosci,1996,16:6364-6373.
[4]汪萌芽.离体新生大鼠运动神经元的电学特性[J].皖南医学院学报,1993,12(2):79-81.
[5]SAVI ANE C,SAVTCHENKO LP,RAFFAELL I G,et al.Frequency-dependent shift from paired-pulse facilitation to paired-pulse depression at unitaryCA3-CA3 synapses in the rat hippocampus[J].J Physiol,2002,544(Pt 2):469-476.
[6]CASTRO-ALAMANCOSMA,CORMORSBW.Short-term synaptic enhancement and long-term potentiation in neocortex[J].Proc Natl Acad SciUSA,1996,93(3):1335-1339.
[7]KANG Y.Differential paired-pulse depression of non-NMDA and NMDA currents in pyramidal cells of the rat frontal cortex[J].J Neurosci,1995,15(12):8268-8280.
[8]DEBANNE D,GUER INEAU NC,GAHW ILER BH,et al.Pairedpulse facilitation and depression at unitary synapses in rat hippocampus:quantal fluctuation affects subsequent release[J].J Physiol,1996,491(Pt 1):163-176.
[9]CASTRO-ALAMANCOS MA,CONNORS BW.Distinct forms of short-ter m plasticity at excitatory synapses of hippocampus and neocortex[J].Proc Natl Acad Sci USA,1997,94(8):4161-4166.
[10]DE LEON RD,HODGSON JA,ROY RR,et al.Retention of hindlimb stepping ability in adult spinal cats after the cessation of step training[J].J Neurophysiol,1999,81(1):85-94.
[11]WOLPAW JR.Spinal cord plasticity in acquisition and maintenance ofmotor skills[J].Acta Physiol(Oxf),2007,189(2):155-169.
[12]MEUN IER S,K WON J,RUSS MANN H,et al.Spinal use-dependent plasticity of synaptic transmission in humans after a single cycling session[J].J Physiol,2007,579(Pt 2):375-388.
- 皖南医学院学报的其它文章
- 医学生睡眠质量及其影响因素的调查分析

