Skp2在宫颈癌组织中的表达及其临床意义
吕育纯 饶靖红 李爱禄 欧阳永娥
宫颈癌是女性生殖系统最常见的恶性肿瘤,近年来其发病率呈明显上升并且有年轻化趋势。虽然采用以手术、放疗为主的综合治疗,但近20年来总5年生存率没有明显提高。细胞周期与细胞癌变的关系是近年来肿瘤研究的热点,G1期到S期的转换失调是肿瘤形成的主要原因之一,Skp2是与此转换密切相关的细胞周期调控因子,目前国内外有关这方面的报道甚少且结果不尽相同。我们采用免疫组织化学方法,检测Skp2在宫颈癌组织中的表达情况,分析了其表达水平与宫颈癌的临床病理因素之间的关系,为临床上进一步了解宫颈癌的生物学行为、判断预后、指导治疗提供帮助。
1 材料与方法
1.1 材料来源
研究对象:收集我院2002年1月至2006年12月间手术切除、并经病理检查证实的65例宫颈浸润癌石蜡标本,20例宫颈上皮内瘤样病变石蜡标本。所有研究对象具有完整的临床资料、病理资料和随访资料。所有病例均为初治者,术前未接受过放射治疗或化学治疗。
临床资料:宫颈浸润癌(invasive cervical carcinoma,ICC)组:65例患者年龄29~61岁,中位年龄43岁;﹤40岁28例,≥40岁37例。FIGO分期:Ⅰa期6例,Ⅰb期23例,Ⅱa期27例,Ⅱb期9例。大体类型:外生型37例,内生型7例,溃疡型3例,糜烂型18例。局部肿瘤大小:<4 cm者34例,≥4 cm者31例。病理诊断均为宫颈鳞状上皮细胞癌。组织学分级:高中分化癌(≤Ⅱ级)28例,低分化癌(Ⅲ级)37例。根据术后病理报告的宫颈肌层浸润程度,浸润﹤浅肌层21例,浸润≥浅肌层44例。有脉管和(或)宫旁浸润45例,无脉管和(或)宫旁浸润20例。伴有盆腔淋巴结转移12例,无盆腔淋巴结转移53例。宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)组:CINⅡ3例,CINⅢ17例;年龄35~60岁,中位年龄44岁。对照组选择同期因子宫肌瘤手术的60例宫颈正常组织(NCE)作为对照,年龄32~58岁,中位年龄45岁。3组患者年龄比较无统计学差异(P>0.05)。
1.2 方法
所有标本均经10% 中性福尔马林液固定,石蜡包埋。蜡块连续4~5 μm厚度切片,贴于涂有0.05% 多聚赖氨酸的载玻片备用。采用免疫组化S-P法检测Skp2。浓缩型Skp2鼠抗人单克隆抗体(克隆号2C8D9),购自北京友谊中联生物科技有限公司,工作浓度为1∶200。超敏S-P检测试剂盒,购自福州迈新生物技术开发有限公司。按说明书操作。用已知阳性对照片作阳性对照,用PBS代替一抗作阴性对照。每例常规进行HE染色。
1.3 结果判断
与两位病理科医师一起独立观察每张切片后作出判断。Skp2阳性表达部位主要在宫颈鳞状上皮细胞的细胞核,呈棕色或棕黄色颗粒,胞质可以有少量表达;阳性染色细胞条件为细胞结构清晰、阳性颗粒定位好、着色与背景对比清楚。综合染色强度和阳性细胞所占百分比进行半定量处理。染色强度评分标准:不着色0分,黄色1分,棕黄色2分,黄褐色3分;阳性细胞比例评定标准:阳性细胞数﹤5%为0分,5%~25%为1分,26%~50%为2分,﹥50%为3分。2种评分得分相加,0~1分为阴性“-”,2~3分为弱阳性“+”,4~6分为强阳性“++”。
1.4 统计学分析
采用SPSS11.5版统计软件包对数据进行分析。Skp2的表达及与临床病理因素之间关系用卡方检验,生存率采用Kaplan-Meier法计算,并绘制生存曲线,生存期差别的比较及Kaplan-Meier生存曲线采用 Log-rank 检验。
2 结果
2.1 Skp2表达
Skp2在宫颈癌癌细胞核部位染色阳性,低分化或转移灶的癌细胞常出现Skp2染色强阳性,在CIN中Skp2为阳性或弱阳性,而在正常宫颈组织的基底细胞中偶尔可见胞核Skp2染色阳性。我们还观察到Skp2表达细胞在正常宫颈组织局限于增生的基底和基底旁,高分化癌位于具有角化核心的癌岛边缘,而分化差的癌Skp2表达细胞则分布于整个标本中。
宫颈癌组织中Skp2的阳性率为55.4 %,与CIN的25.0%比较有显著性差异(χ2=5.655,P=0.017),与正常宫颈组织Skp2的阳性率(6.7%)比较有极显著性差异(χ2=34.031,P=0.000),而CIN与正常宫颈组织Skp2蛋白的阳性率比较也有显著性差异(χ2=5.505,P=0.025),见表1。

表1 宫颈癌、CIN及正常组织中Skp2的表达(例)
2.2 宫颈癌中Skp2的表达与临床病理因素的关系
宫颈癌中Skp2的阳性率随着肿瘤分化程度的降低表达增高,其中高、中分化癌(≤Ⅱ级)和低分化癌(Ⅲ级)Skp2的阳性率分别为39.3%和67.6%,两者比较有统计学意义(P=0.023),见表2。
宫颈癌中Skp2的表达与肿瘤浸润深度、淋巴结转移和脉管浸润显著相关;宫颈间质浸润>浅肌层、有盆腔淋巴结转移和脉管浸润者,Skp2的阳性表达率显著高于宫颈间质浸润≤浅肌层、无盆腔淋巴结转移和无脉管浸润者,但Skp2的表达与年龄、肿瘤大小、临床分期无明显关系(P>0.05),见表2。
Skp2阳性表达者盆腔淋巴结转移和脉管浸润的发生率分别为33.3%(12/36)和47.2%(17/36),Skp2阴性表达者则分别为0(0/29)和10.3%(3/29),前者盆腔淋巴结转移和脉管浸润的发生率显著高于后者(P<0.01)。
2.3 Skp2表达与宫颈癌预后的关系
宫颈癌中,Skp2阳性表达36例,平均生存期51.3个月,5年生存率52.8%(19/36);Skp2阴性表达29例,平均生存期为59.3个月,5年生存率69.0%(20/29),见图1。 Skp2阳性表达组的生存期及5年生存率均低于Skp2阴性表达组,经Log-rank 检验,Log-rank=8.60,P=0.0034,两者差别具有统计学意义,提示Skp2表达与宫颈癌的预后显著相关。
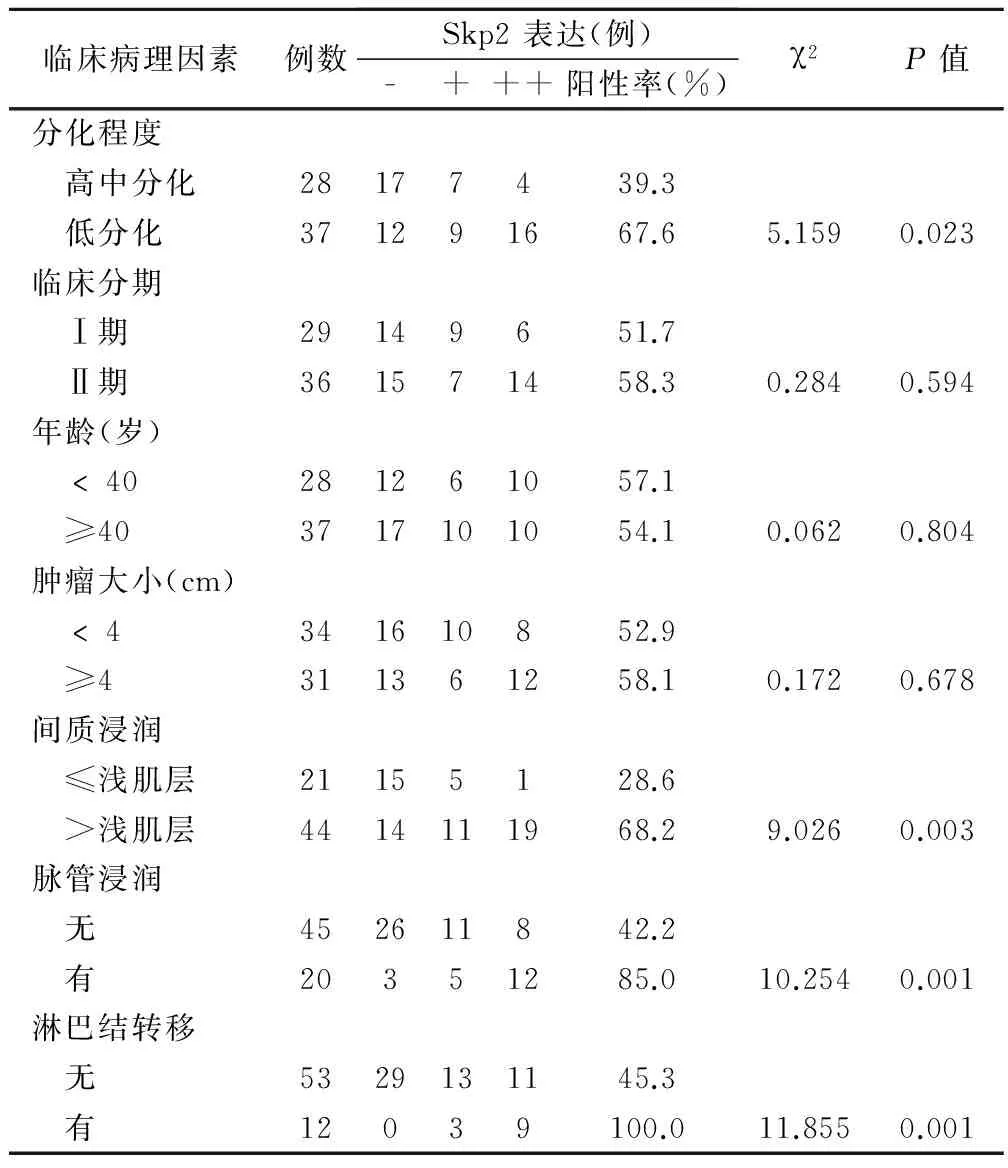
表2 宫颈癌中Skp2的表达与临床病理因素的关系

图1 Skp2表达阳性与阴性患者的Kaplan-Meier生存曲线
3 讨论
3.1 宫颈癌中Skp2的表达及其意义
1995年Zhang等[1]首次发现细胞内注射p45抗体或反义寡核酸能阻断p45的功能,阻止细胞进入S期,认为p45增加与转化细胞的细胞周期控制改变有关,p45因与细胞周期蛋白cyclin A相互作用而命名为Skp2(S-phase kinase-associated proteins 2)。Skp2基因定位于人5号染色体短臂上(5p13),分子量约45 kD。由F-box序列、“Linker”序列、蛋白-蛋白相互作用模块如亮氨酸重复序列结构域(leucine-rich repeat,LRR)依次连接构成[2]。
Skp2是泛素连接酶E3结合磷酸化p27的识别蛋白质,参与p27的泛素化降解,与细胞周期的进展,DNA的复制、细胞的增殖密切相关。Skp2能调节CDKI的降解、控制Skp1A/B与CyclinA/CDK2复合物的结合、与Skp1结合以形成SCFSkp2复合物。此外Skp2还参与转录调控,如转录因子E2F-1在G1末期积累,在S-G2期显著降低;研究发现这种降低与Skp2有关,阻断Skp2与E2F-1的相互作用可使E2F-1泛素化下调、稳定性增加[3]。Skp2还能作为某些癌基因如c-myc的联合转录因子,在其转录激活和泛素化降解中发挥重要作用,并促进c-myc诱导的S期转变和活化c-myc的靶基因[4],而某些抑癌基因如PTEN也可能通过下调Skp2的表达而发挥抑癌作用。
肿瘤发生的根本原因在于基因组的不稳定,致使G1/S和G2/M 2个关卡失控,使本来应该停止增殖或生理性凋亡的细胞不停地进入细胞周期,因而造成细胞的恶性增生。Skp2具有促进细胞通过G1/S转换“关卡”的作用,促进细胞周期的进展,从而促进DNA的复制、细胞的增殖。因此Skp2基因被认为是1种原癌基因,具有癌基因功能。研究发现Skp2蛋白在乳腺癌[3]、前列腺癌[6]、胃癌[7],结肠癌[8],宫颈癌[9]等多种恶性肿瘤中表达增加。
本项研究中,我们检测到宫颈癌中Skp2的阳性率为55.4%,与Dowen等[9]在宫颈癌的研究结果相近。我们的研究结果显示Skp2在宫颈癌中特异性表达,其表达水平明显高于正常宫颈组织的6.7%和宫颈上皮内瘤样病变的25.0%,而且宫颈上皮内瘤样病变中 Skp2的阳性率也显著高于正常宫颈组织。 这一结果提示Skp2的表达在宫颈癌的发生中可能起重要作用。
3.2 Skp2的表达与临床病理因素及预后的关系
为进一步探讨Skp2在宫颈癌的发展进程中的作用,我们分析了Skp2的表达与临床病理因素的关系,发现组织学分级≤Ⅱ级的病例Skp2的阳性表达水平明显低于组织学分级Ⅲ级的病例,这表明Skp2表达水平与肿瘤的分化相关,肿瘤分化越低其表达越高,Hershko等[8]在结直肠癌病例的研究中也有相似的报道,说明Skp2表达增高不同程度地影响肿瘤的分化程度及其恶性进程。
同时我们还发现Skp2的表达水平与肿瘤的浸润深度、是否有脉管浸润密切相关,浸润深度超过深肌层组,有脉管浸润组Skp2的表达水平均明显高于不超过浅肌层组,无脉管浸润组。除此之外,Skp2的表达水平与淋巴结转移也密切相关,有淋巴结转移组显著高于无淋巴结转移组,这些临床病理因素与患者的预后密切相关。因此Skp2的上调可能与宫颈癌的恶性进展有关,其高表达提示患者预后可能不良。Shigemasa等[10]用免疫组化法检测134例卵巢肿瘤患者,发现腺瘤和低度恶性倾向肿瘤细胞中未检测到Skp2的表达,而43例腺癌细胞中检测到Skp2的表达,与前两者有显著性差异,并且晚期患者的Skp2表达检出率明显高于早期患者(P=0.01)。经Log-rank检验后发现,Skp2过度表达明显与低生存率关联,他们认为Skp2过表达提示预后不良。我们从本研究中也发现,Skp2表达阳性的病例5年生存率明显低于Skp2表达阴性的病例。进一步支持宫颈癌中Skp2的高表达与预后不良相关,Skp2的高表达是宫颈癌的高危因素之一。
综上所述,Skp2的表达升高可能与宫颈癌的发生、发展及恶性程度有关,检测Skp2的表达水平对判断宫颈癌的恶性程度和预后具有重要的参考价值,为术后辅助治疗的选择提供客观依据,具有较大的临床意义。因此,Skp2可以作为宫颈癌独立的预后指标,为宫颈癌的治疗提供新的靶点。
[1] Zhang H,Kobayashi R,Galaktionoy K,et al.p19Skp1 and p45Skp2 are essential elements of the cyclin A-CDK2 S phase kinase〔J〕.Cell,1995,82(6):915.
[2] Yokoi S,Yasui K,Saito Ohara F,et al.A novel targer gene,Skp2,within the 5p13 amplicon that is frequently detected in small cell lung cancers〔J〕.Am J Pathol,2002,161(1):207.
[3] Farhana L,Dowson M,Rishi AK,et al.Cyclin B and E2F-1 expression in prostate carcinoma cells treated with the novel retinoid CD437 are regulated by the ubiquitin-mediated pathway〔J〕.Cancer Res,2002,62(13):3842.
[4] Latres E,Chiarle R,Schulman BA,et al.Role of the F-box protein Skp2 in lymphomagenesis〔J〕.Proc Natl Acad Sci USA,2001,98(5):2515.
[5] Gstaiger M,Jordan R,Lim M,et al.Skp2 is oncogenic and overexpressed in human cancers〔J〕.Proc Natl Acad Sci USA,2001,98(9):5043.
[6] Ben-Izhak O,Lahav-Baratz S,Meretyk S,et al.Inverse relationship between Skp2 ubiquitin ligase and the cyclin dependent kinase inhibitor P27 in prostate cancer〔J〕.J Urol,2003,170(1):241.
[7] Masuda TA,Inoue H,Sonoda H,et al.Clinical and biological significance of Skp2 gene expression in gastric carcinoma:modulation of malignant phenotype by Skp2 overexpression.Possibly via P27 proteolysis〔J〕.Cancer Res,2002,62(13):3819.
[8] Hershko D,Bornstein G,Ben Izhak O,et al.Inverse relation between levels of P27(Kip1) and of its ubiquitin ligase subunit Skp2 in colorectal carcinomas〔J〕.Cancer,2001,91(9):1745.
[9] Dowen SE,Scott A,Mukherjee G,et al.Overexpression of Skp2 in carcinoma of the cervix does not correlate inversely with P27 expression〔J〕.Int J Cancer,2003,105(3):326.
[10] Shigemasa K,Gu L,O’Brien YJ,et al.Skp2 overexpression is a prognostic factor in patients with ovarian adenocarcinoma〔J〕.Clin Cancer Res,2003,9(5):1756.

