重组人血管内皮抑素联合紫杉醇对裸鼠MKN-45胃癌抗肿瘤效应的实验研究
钱 飞, 马利林, 朱建伟, 于嘉伟, 袁 健
胃癌是最常见的恶性肿瘤之一,死亡率居人类恶性肿瘤的第2位[1]。目前国内外应用较多的胃癌化疗方案是两药以上的联合化疗,以期减少耐药株的出现,获取较好疗效。但目前尚无一种化疗方案能在完全缓解率、中位生存期等方面达到令人满意的效果[2]。因此,胃癌化疗至今尚无标准可循。胃癌作为血管依赖性的实体瘤,新生血管在肿瘤发生发展过程中可能具有非常关键的作用,抗血管生成治疗正逐步成为肿瘤治疗领域中的热点之一。本实验采用胃癌MKN-45细胞株作裸鼠原位移植,建立类似于临床胃癌生长、转移的裸鼠模型,观察抗血管生成代表药物重组人血管内皮抑素联合细胞毒化疗药物紫杉醇对裸鼠胃癌原位移植瘤生长和转移的影响,探讨重组人血管内皮抑素是否增强化疗药物的疗效或两药联合是否具有明显的协同作用。
1 材料和方法
1.1 材料
1.1.1 细胞株 将人胃癌MKN-45细胞株(购自中科院上海细胞库)置于10%胎牛血清, RPMI 1640培养基,37℃,5% CO2细胞培养箱中培养。细胞贴壁生长,每5~7天传代1次。
1.1.2 药物及试剂 重组人血管内皮抑素(江苏先声药业,批准文号: 国药准字S20050088)。紫杉醇(华北制药集团,批准文号:国药准字H20084439)。原位细胞凋亡检测试剂盒(In Situ Apoptosis Drtection KitI),CD34(H-140),多克隆抗体(SC-9095),VEGF ELISA试剂盒和bFGF ELISA试剂盒(武汉博士德公司)。
1.1.3 实验动物 SPF级裸鼠,BALB/c-nu/nu,38只,扬州大学实验动物中心提供,合格证号:[苏]SCXK 2007-0001,南通大学动物中心饲养,雌雄各半,鼠龄6~8周,体重18~20 g。
1.1.4 动物模型 将人胃癌细胞株MKN- 45配成浓度为5×107个/mL混悬液0.2 mL,注入小鼠腋窝下。成瘤后鼠间传代成实体瘤,本组实验取第5代瘤源。原位动物模型的建立:裸鼠术前禁食12 h,腹腔注射50 mg/kg氯胺酮麻醉,常规消毒皮肤,沿左腹正中旁线切开约1.5 cm,打开腹腔后将胃拉出,取第五代裸鼠皮下移植瘤切成直径1 mm的瘤块,无菌针头轻微损伤(以出血为度)胃大弯中部浆肌层,将1块瘤组织用医用OB胶粘合在破损处。10 s 凝固后将胃壁回纳入腹腔,逐层关腹,完成造模工作。
1.1.5 实验分组给药 接种3周后,从体表触摸已有肿瘤形成,开始用药。32只裸鼠随机分为4组,每组8只,分别为对照组、重组人血管内皮抑素组(简称抑素组,下同)、单一化疗组和联合用药组。抑素组选用重组人血管内皮抑素,剂量为15 mg/kg,尾静脉注射,自第1天起连续用药14天;单一化疗组选用紫杉醇,剂量为20 mg/kg,第1、7、14天行腹腔注射,连续用药2周后停用1周,共3个疗程;联合用药组两药联合应用,剂量用法均同单药组;对照组注射相同体积的生理盐水。
1.2 检测指标与方法
1.2.1 肿瘤生长情况 实验第9周将裸鼠脱颈处死,原位肿瘤直接称重,并根据以下公式计算各组药物的抑瘤率:抑瘤率=(对照组瘤重-治疗组瘤重)/对照组瘤重×100%。
1.2.2 肿瘤转移情况 通过大体观察和HE切片观察肿瘤的转移情况,任何脏器或组织有转移灶或癌性腹水即被认定为有转移。转移率=(有转移动物数/该组动物总数)×100%。
1.2.3 癌细胞凋亡指数(apoptosis index,AI) 采用原位末端转移酶标记技术(TUNEL法)检测细胞凋亡,计算凋亡指数时仅以癌细胞计数细胞核中有棕黄色颗粒者为凋亡细胞,每例切片5个随机400倍视野中的凋亡细胞平均数即为其凋亡指数,凋亡指数=(凋亡细胞数/癌细胞总数)×100%。
1.2.4 肿瘤微血管密度(MVD) 采用CD34抗体检测,具体操作步骤按说明书进行,DAB显色,MVD的计算参照按Weidner[3]报道的方法,以任何1个棕黄色的内皮细胞或细胞丛作为1个血管。先在低倍镜下观察切片全部视野,找到肿瘤血管密度最高区域,然后在高倍镜下计数5个视野的微血管数,取其平均值作为该例肿瘤的MVD。
1.2.5 血清VEGF及bFGF 分别于裸鼠用药前1天和处死前从内毗静脉采血,置于干净2 mL Eppendorf 管中,4℃冰箱中过夜,次日2000 rpm离心15 min,小心吸取上清液,双抗体夹心ELISA法检测血清中VEGF及bFGF浓度,具体操作步骤按说明书进行。
1.3 统计学方法
所有数据采用SPSS 13.0 进行统计分析,组间比较均采用方差分析。
2 结果
2.1 重组人血管内皮抑素与紫杉醇对裸鼠一般状况的影响
整个实验过程中,32只实验动物均未出现明显精神不振、活动减少、食量下降、消瘦、血便、腹泻等症状,生存良好,无1例死亡。测量各组裸鼠体重,用药前后各组差异均无显著性,体重变化差异亦无显著性(P>0.05) (见表1)。

表1 用药前后裸鼠的体重
各组间比较,P>0.05
2.2 肿瘤转移情况
通过大体观察和HE切片观察肿瘤的转移情
况,任何1个脏器或组织有转移灶或出现癌性腹水即被认定为有转移(见表2)。
转移率=(有转移动物数/该组动物总数)×100%

表2 重组人血管内皮抑素和紫杉醇对原位移植人胃癌转移的影响
*P<0.01,**P<0.05(与对照组比较);*P<0.05,**P<0.01(与联合用药组比较)
2.3 各组小鼠瘤重变化
抑素组、单一化疗组和联合用药组的抑瘤率与对照组相比差异有统计学意义(P<0.05);联合用药组比两药单独应用时抑瘤率更加显著(P<0.01或P<0.05)(见表3)。
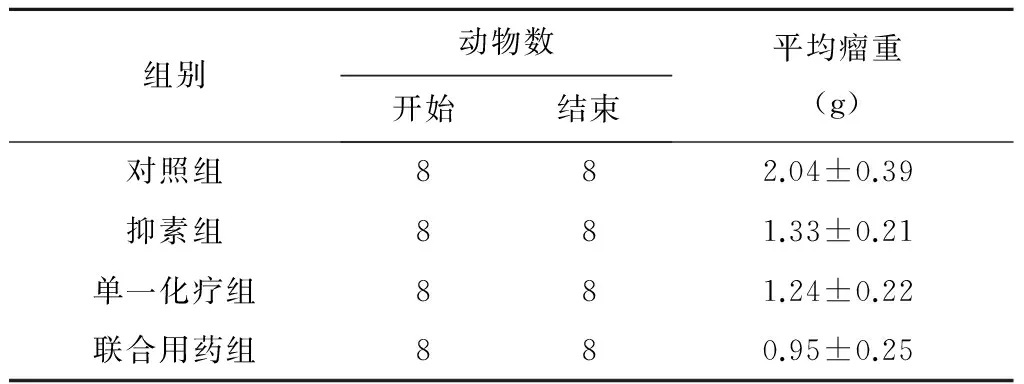
表3 重组人血管内皮抑素和紫杉醇对原位移植人胃癌生长的抑制作用
抑瘤率:*P、**P<0.01(与对照组比较);*P<0.01、**P<0.05(与联合用药组比较);
凋亡指数:*P<0.05,*#P<0.01(与对照组比较);*P<0.01,*#P<0.05(与联合用药组比较);MVD:*P<0.05,*△P<0.01(与对照组比较);*P<0.01,*△P<0.05(与联合用药组比较)
2.4 凋亡指数(AI)
光镜下以TUNEL法计算凋亡指数,染色阳性信号呈棕黄色,位于细胞核内,浓缩的核质紧贴核膜,或出现均匀的染色。联合用药组凋亡指数高于其他各组,差异有统计学意义(P<0.01或P<0.05),说明重组人血管内皮抑素和紫杉醇联合应用可以协同增加胃癌细胞凋亡率(见表3)。
2.5 肿瘤微血管密度(MVD)
微血管密度CD34蛋白阳性染色呈棕黄色,位于微血管内皮细胞的细胞膜和细胞浆,与周边组织界限清楚,联合用药组微血管密度明显低于其他各组,差异有统计学意义(P<0.01或P<0.05)(见表3,图1~4)。

图1 对照组MVD(400×)
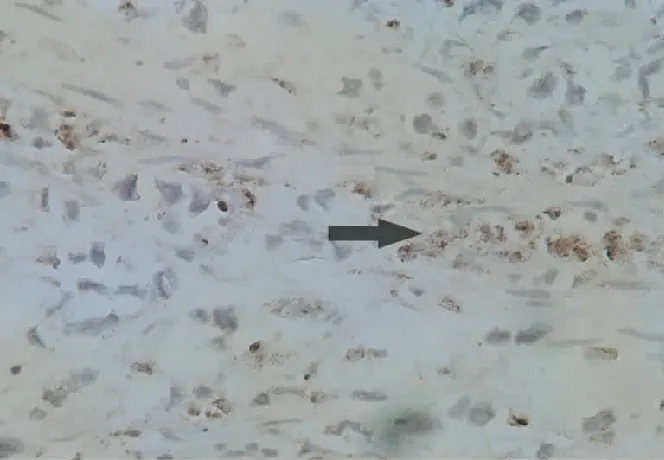
图2 抑素组MVD(400×)

图3 单一化疗组MVD(400×)

图4 联合用药组MVD(400×)
2.6 血清VEGF及bFGF
采用ELISA法检测血清VEGF和bFGF的表达,显示抑素组血清VEGF和bFGF表达较对照组明显降低,联合用药组比对照组显著下降。(见表4,5)

表4 重组人血管内皮抑素和紫杉醇对原位移植人胃癌VEGF表达的影响
*P<0.05,**P<0.01(与对照组比较);**P<0.05,*P<0.01(与联合用药组比较)

表5 重组人血管内皮抑素和紫杉醇对原位移植人胃癌bFGF表达的影响
*P<0.05,**P<0.01(与对照组比较);**P<0.05,*P<0.01(与联合用药组比较)
3 讨论
胃癌的外科治疗近十年来虽然进步很快,但治疗效果却没有根本性的突破[4]。统计学资料显示,手术前后的新辅助化疗与辅助化疗可以明显提高疗效,但因毒副反应较大,患者往往不能耐受,总体有效率仍然不能令人满意[5]。紫杉类的化疗药物是目前公认的较为有效的化疗用药,但其对提高胃癌治疗完全缓解率的作用仍然有限。因此,寻找具有低毒高效的多药联合治疗方案具有十分重要的意义。
Folkman[6]提出,肿瘤直径小于2 mm时,其生长缓慢,原发肿瘤仅局部浸润,尚未发生转移,处于所谓“潜伏期”。只有当肿瘤直径大于2 mm时,微血管逐渐形成,肿瘤实体随之迅速增大,进而发生转移和扩散。研究表明[7],胃癌作为血管依赖性的实体瘤,新生血管在其病程进展中具有十分重要的作用,因此,抗血管生成治疗可能在肿瘤治疗领域中占据重要地位。本实验采用的抗肿瘤血管生成代表药物重组人血管内皮抑素是以大肠杆菌作为蛋白表达体系生产出来的一种血管生长抑制剂,能有效抑制血管内皮细胞的迁移,阻断血管生长,中断肿瘤细胞营养和氧气的供应,最终使肿瘤细胞处于休眠状态,达到“饿死”肿瘤细胞的目的。重组人血管内皮抑素作用机制尚不明确[8],但已有研究表明,内皮抑素的主要作用机理可能包括:(1)抑制金属蛋白酶活性,阻断其降解细胞外基质;(2)诱导内皮细胞停滞在G1期,阻止内皮细胞分裂;(3)诱导内皮细胞凋亡;(4)阻止内皮细胞的粘附移行;(5)阻止生长因子与受体结合,干扰其信号传导通路。动物实验也证明内皮抑素对肺癌、黑色素瘤、纤维肉瘤、结肠癌、肝癌、直肠癌等均有较好疗效并能使肿瘤最后达到休眠状态[9]。尽管重组人血管内皮抑素对肿瘤的治疗显示出良好的应用前景,但在胃癌方面的应用研究报道甚少。本实验研究的目的就在于探讨重组人血管内皮抑素联合紫杉醇是否对胃癌具有协同的抗肿瘤效应及可能的作用机制, 可能为进一步的临床应用提供理论依据。
一般认为,肿瘤实体内微血管数量与肿瘤转移潜能成正相关,有学者在黑色素瘤及乳腺癌的观察中发现,肿瘤实体内微血管数量增多提示预后欠佳。由此我们可以看出新生血管形成是肿瘤发生发展中的关键环节之一。从本实验我们可以看出对照组微血管密度为40.25±5.12,而联合用药组微血管密度为24.38±4.03,两组差异具有统计学意义,P<0.01,说明重组人血管内皮抑素联合紫杉醇能明显抑制肿瘤新生血管的形成,显示出较强的抗肿瘤协同作用。
肿瘤血管生成是一个多因子参与的多步骤过程,阻断此环节中的任何一步,都将阻止肿瘤血管生成[6]。现有研究表明:VEGF和bFGF是目前已知的作用最强的两种血管生成促进因子[10],能增加肿瘤血管的通透性,促进血管内皮细胞的萌芽、增殖、迁移,促进肿瘤新生血管的形成、生长和转移。本研究结果可以看出重组人血管内皮抑素联合紫杉醇能明显下调血清VEGF和bFGF的表达,这可能是联合用药组能显著抑制裸鼠胃癌转移的机制之一。
人癌转移瘤的原位移植模型已经成为目前国际上普遍接受的研究人癌侵袭和转移的重要理论基础。这种模型与临床患者的转移特点相似,转移率高,能较客观地模拟胃癌患者的体内侵袭和转移特性[11]。本实验成功地复制了人胃癌裸鼠原位转移模型,所有实验动物胃壁均有胃癌的生长,荷瘤率为100%。转移是恶性肿瘤最重要的生物学特征,是大多数恶性肿瘤患者的主要死亡原因。本实验结果显示对照组转移率为100%,内皮抑素组为37.5%,单一化疗组为62.5%,联合用药组为25%,由此可见重组人血管内皮抑素联合紫杉醇在抑制肿瘤的转移方面存在明显的协同作用。
肿瘤细胞的凋亡作为一个很重要的生物学指标常用于判断抗肿瘤药物的疗效。本组用药9周后的结果表明,对照组肿瘤细胞凋亡指数为21.87±3.56,内皮抑素组为29.12±5.83,单一化疗组为36.25±3.24,联合用药组为45.75±3.62,提示单独使用重组人血管内皮抑素或化疗药物紫杉醇对促进肿瘤细胞凋亡的作用有限,而两者联合应用较其他各组有更显著的抑制肿瘤细胞生长的作用。
本研究中观察应用重组人血管内皮抑素的各组实验动物,均未发现特殊或明显的毒副反应,显示出重组人血管内皮抑素可能具有低毒的优点,进一步表明重组人血管内皮抑素在胃癌的辅助治疗或综合治疗中将会具有良好的临床应用前景,也将为胃癌的临床治疗方案增加一种选择。
[1] 徐飚, 王建明. 胃癌流行病学研究[J].中华肿瘤防治杂志, 2006, 13(1): 1-8.
[2] Archie V, Kauh J, Jones DV Jr, et al. Gastric cancer:standards for the 21st century[J]. Crit Rev Oncol Hematol, 2006;57(2):123-131.
[3] Weidner N. Current pathologic methods for measaring intratumoral microvessel density within breast carcinoma and other solid tumors [J]. Breast Cancer Res Treat,1995,36(2):169-180.
[4] 邹寿椿,陶厚权.胃癌外科治疗若干问题的思考[J]. 国际外科学杂志,2009,36(3):145-147.
[5] 陈凛,李涛.胃癌综合治疗现状与进展[J]. 世界华人消化杂志,2008,16(6): 571-574.
[6] Folkman J. Role of angiogenesis in tumor growth and metastasis[J].Semin Oncol, 2002, 29(6 Suppl 16):15-18.
[7] Folkman J. Anti-angiogenesis in cancer therapy-endostatin and its mechanisms of action[J]. Expt Cell Res, 2006, 312(5): 594 -607.
[8] Abdollahi A, Hahnfeldt P, Maercker C, et al. Endostatin's anti-angiogenic signaling network. [J]. Mol Cell, 2004, 13(5):649-663.
[9] Kirsch M, Schackert G, Black PM. Angiogenesis, metastasis, and endogenous inhibition [J]. J Neurooncol, 2000, 50(1-2):173-180.
[10] 丁旭青, 韩玉培. 食管鳞癌p53、TSP-1、VEGF表达与肿瘤血管生成[J]. 中国肿瘤外科杂志, 2009, 1(4): 209-211.
[11] Illert B, Otto C, Braendlein S, et al. Optimization of a metastasizing human gastric cancer model in nude mice[J]. microsurgery, 2003, 23(5):508-512.

