壳聚糖-明胶/β-磷酸三钙复合体作为组织工程软骨支架材料的实验研究
刘建斌
壳聚糖-明胶/β-磷酸三钙复合体作为组织工程软骨支架材料的实验研究
刘建斌
目的 了解壳聚糖(CS)-明胶(Gel)/β-磷酸三钙(β-TCP)复合体支架超微结构、机械性能及生物相容性,探讨其作为组织工程软骨支架材料的可行性。方法 采用二次冻干技术制备CS-Gel/β-TCP复合体支架,扫描电镜观察超微形态,材料万能测试机测定压缩强度和压缩模量;将CS-Gel/β-TCP复合体支架植入兔皮下,观察体内降解情况及生物相容性。结果 混合溶液固含量、β-TCP添加量、预冻温度对复合体支架的孔隙结构具有决定性作用。β-TCP的引入能显著增强CS-Gel聚合体支架的机械性,随着β-TCP添加量的增多,复合体支架的压缩强度、模量都有较大程度提高;随着预冻温度的降低,材料的机械性能亦随之降低。在植入早期可观察到一过性炎性反应,随着植入时间延长,支架逐渐降解,12周时基本降解吸收。结论 CS-Gel/β-TCP复合体支架具有良好的超微结构、机械性能和生物相容性,是一种较好的构建组织工程软骨的支架材料。
组织工程 支架材料 壳聚糖 明胶 β-磷酸三钙 机械性能 生物相容性
组织工程是利用工程学和生命科学的原理和技术,构建具有生命的组织或器官,用于再造或修复组织缺损的综合性交叉学科,支架材料作为人工细胞外基质,为功能细胞的黏附、生长提供三维空间[1-2]。本实验采用二次冻干技术制备CS-Gel/β-TCP复合体支架,研究其超微结构、机械性能、降解性及生物相容性,探讨其作为组织工程软骨支架材料的可行性。
1 材料与方法
1.1 材料
壳聚糖(Chitosan,CS)(脱乙酰度>85%,粘均分子量 15 万),明胶(Gelatin,Gel)(G9391,Sigma 公司),β-磷酸三钙(平均粒径 2.62 μm,比表面积22.91 m2/g,黑龙江八一农垦大学生命科学院提供),冰醋酸(分析纯),柠檬酸(生化试剂),氢氧化钠(分析纯),戊巴比妥钠。
1.2 方法
1.2.1 支架材料的制备
将CS粉末溶解于2%冰醋酸溶液100 mL中,加入等量的Gel,混匀,40℃水浴,将加入一定量的去离子水的β-TCP搅拌30 min后,溶解于混合溶液中,加入柠檬酸溶液后混匀,倒入塑料平皿。预冷冻8 h(分别选择-40℃、-60℃和-80℃),冷冻干燥机真空冷冻干燥48 h,置于2%NaOH水溶液中4 h,中和材料中的残存冰醋酸后,将其二次冻干,制备成5 mm×5 mm×5 mm的立方体和直径为10 mm、高15 mm的圆柱体 CS-Gel/β-TCP海绵状复合体支架,置于干燥器中备用。两种形状的支架依据β-TCP的添加量(重量分率)分别分为0%组、0.3%组、0.5%组和0.7%组
1.2.2 复合体支架的孔隙率测定
将复合体支架置于一定体积的(V1)无水乙醇中,循环抽真空脱气泡后,材料和乙醇总体积记为V2,再将复合体支架移出,剩余乙醇记为V3,则材料孔隙率为:
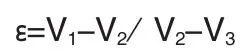
1.2.3 复合体支架超微结构观察
将立方体CS-Gel/β-TCP海绵状复合体支架标本真空干燥后,每组标本的横截面表面喷金,扫描电镜观察超微结构。
1.2.4 复合体支架压缩强度及压缩模量测定
材料万能测试机测试圆柱体标本,每组试样至少测试6个样品,加载速率0.5 mm/min,抗压测试加载至试样变形,记录最大压力,计算最大压缩强度及其压缩模量(取平均值作为复合体支架材料的初始压缩模量)

(式中△N为载荷变量,△L为相对位移变量,L为试样的长度,A为试样横截面面积)
1.2.5 复合体支架的体内降解及生物相容性观察
取3月龄新西兰兔6只,3%戊巴比妥耳缘静脉给药全身麻醉(1 mL/Kg)。无菌条件下背部正中纵行切口,潜行分离,于不同部位皮下植入4块立体海绵状复合体标本,缝合皮肤。分别于4、8、12周取材, 10%福尔马林固定24 h,常规石蜡包埋切片,HE染色,倒置显微镜观察。
1.3 统计学方法
应用Excel 5.0统计软件进行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 复合体支架一般性状及孔隙率
二次冻干后的海绵状复合体支架呈白色,具有轻微的延展性,孔隙率均约为80%~90%。
2.2 复合体支架孔隙结构、机械性能的影响因素
扫描电镜观察发现,CS-Gel/β-TCP海绵状复合体支架有较多微孔,分布均匀。混合溶液固含量、β-TCP添加量和预冻温度对复合支架的孔隙结构起到决定性作用(图1-3)。强度测试结果表明,β-TCP的添加对CS-Gel聚合体机械性能的增强效果显著,随着β-TCP添加量的增多,复合体支架的压缩强度与压缩模量都有较大程度提高(表1、2);随着预冻温度的降低其机械性能亦随之降低(表3)。
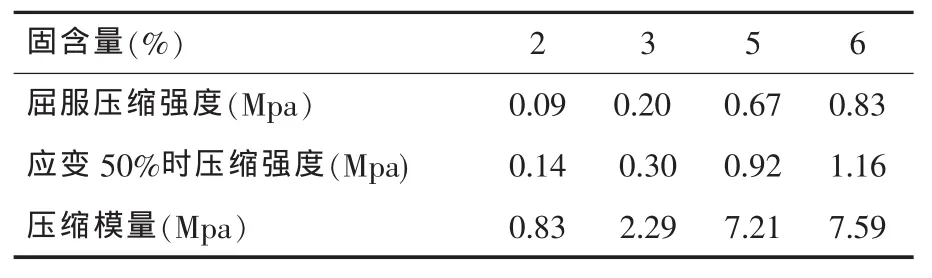
表1 混合溶液固含量对复合体支架机械性能的影响
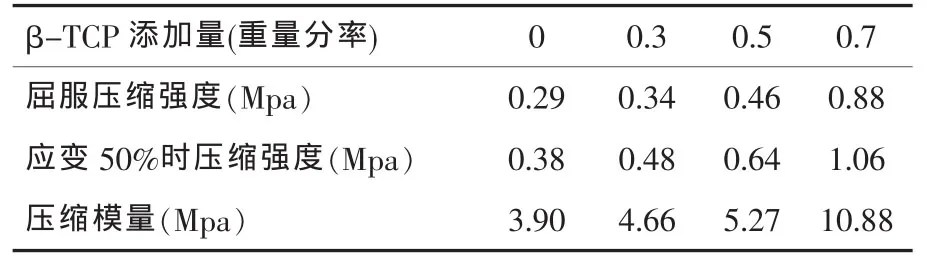
表2 β-TCP添加量对对复合体支架机械性能的影响
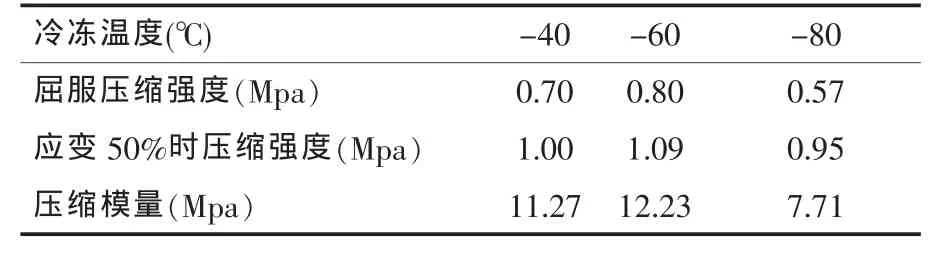
表3 冷冻温度对复合体支架机械性能的影响
2.3 复合体支架的体内降解及生物相容性观察
2.3.1 大体观察
实验动物全部存活,无全身或局部毒性反应。皮下植入部位伤口无感染,愈合良好,植入物无脱出。4周时植入物与周围组织愈合良好,有较硬的膜状物;8周时植入物与周围组织边界不清;12周时植入物基本被纤维结缔组织取代,材料基本被吸收。
2.3.2 组织学观察
支架植入后4周,表面有纤维膜包绕,与周围组织无粘连,内部有结缔组织和小血管长入,有部分的片状复合体支架材料未吸收,其周围可见少量淋巴细胞、巨噬细胞(图4)。8周时,表面有纤维膜包绕,纤维膜变薄,孔隙内结缔组织丰富,周围淋巴细胞、巨噬细胞较4周时更少,支架材料仅少量残存(图5)。12周时植入物基本被纤维结缔组织取代,周围无淋巴细胞、巨噬细胞(图6)。

图1 混合溶液固含量对复合体支架孔隙结构的影响(50×,标尺为500 μm)
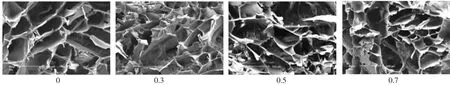
图2 β-TCP添加量对对复合体支架孔隙结构的影响(50×,标尺为500 μm)

图3 冷冻温度对复合体支架孔隙结构、性能的影响(50×,标尺为500 μm)
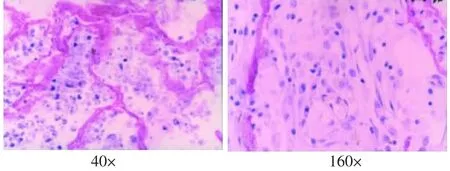
图4 支架植入4周的组织学观察(HE)
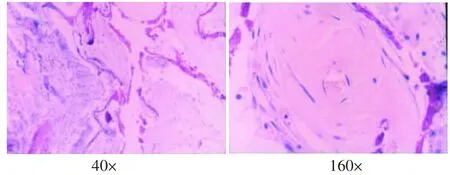
图5 支架植入8周的组织学观察(HE)
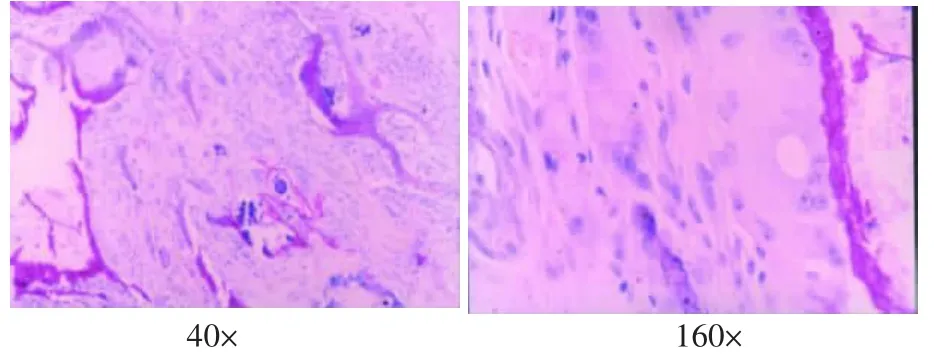
图6 支架植入12周的组织学观察(HE)
3 讨论
受损关节软骨的愈合能力非常有限,直径大于4 mm者极少能自发修复。组织工程软骨为关节软骨损伤的修复提供了新方法,组织工程软骨需要具备3个主要条件:①足够数量且功能正常的“种子”细胞;②合适的支架材料;③调节种子细胞增殖并维持其表型特征的生长因子[3]。其中细胞支架是组织工程软骨研究的热点之一。
支架的主要作用是模拟细胞在体内的生长空间,为形成软骨提供种子细胞增殖分化所需的微环境。理想的支架材料应具备良好的组织相容性和多孔的立体结构,微孔的直径应适宜,孔隙率为70%~95%。目前,单一的支架材料都具备理想支架的部分优点,但又有着难以克服的缺点,两种或两种以上具有互补性的支架材料按一定比例与方式组合,可制备出具有所需结构和性能的三维复合支架材料。
CS带正电荷,结构类似于软骨组织细胞外基质的氨基葡萄糖,在体内溶菌酶、甲壳酶的作用下降解为氨基葡萄糖单体[4]。具有来源广泛、生物相容性良好、可塑形、黏附性良好、降解率可控、无免疫原性等诸多优点,并具有骨、软骨引导性,能促进具有成软骨潜能细胞的分化并有利于软骨形成。Van deVord等[5]将多孔的CS支架植入小鼠体内,观察到对于CS特异的细胞免疫和体液免疫的水平极低。但CS机械性能差,其降解产物还会使局部pH值降低,导致降解进一步加快并引起炎症反应。
明胶(Gel)是胶原的衍生物,同胶原一样具有细胞膜整合素结合区精氨酸-甘氨酸-天冬氨酸-苏氨酸(RGDT)序列和天冬氨酸-甘氨酸-谷氨酸-丙氨酸(DGEA)序列,具有良好的生物相容性和特异性分子识别,可介导细胞的黏附,对细胞的生长、分化、迁移具有促进作用。Mao等[6]指出,CS抑制细胞进入细胞周期,而CS-Gel则可促进细胞增殖,可能与Gel屏蔽了CS高密度的正电荷有关。但Gel存在降解速度较快,机械性能差等问题。
β-磷酸三钙(β-TCP)是一种理想的硬组织替代材料[7],具有良好的生物相容性、机械性能和降解率,骨、软骨引导性,其降解产物呈碱性[8]。能中和CS的降解酸性产物,从而消除或减轻CS引起的无菌性炎症反应。王常勇等[9]以β-TCP为支架,接种软骨细胞后植入裸鼠体内,培育出具有三维立体形态及组织学特征良好的软骨组织。但其脆性大、孔隙率偏低、塑形性差。
CS带正电荷,通过静电作用与Gel的蛋白分子结合,增加了CS的亲水性,也提高了其透氧性能。但CS-Gel聚合物机械强度不足,而添加β-TCP可提高机械性能。CS与β-TCP在体内都是缓慢降解的,而Gel降解很快,可以通过调整CS、Gel在混合溶液固含量、β-TCP添加量和预冻温度,控制降解率使其机械性能与骨、软骨相匹配。据此,本实验以水为致孔剂采用冷冻干燥法制备CS-Gel/β-TCP复合体支架,采用柠檬酸作为CS的交联剂。柠檬酸中的羧基,可与CS中的羟基发生酯化反应,未反应的羧基与CS中的氨基相作用形成盐键,交联形成有机的网络结构,无细胞毒性。Yin等[10]制备了CSGel/β-TCP复合多孔支架,兔皮下植入3个月仅见轻微的炎症反应,与本实验的结果一致。
综上所述,CS-Gel/β-TCP复合体支架具有多孔的三维立体结构,利于细胞的黏附和生长,具有良好的机械性能,生物相容性,可控的降解率,无酸性降解物,基本符合组织工程软骨理想支架材料的要求,有潜在的临床应用前景。
[1]Pollok JK,Vacanti JP.Tissue engineering[J].Semin Pediatr Surg,1996,5(3):191-196.
[2]Sittinger M.Tissue engineering:artificial tissue replacement containing vital components[J].Laryngorhinootologie,1995,74(11):695-699.
[3]马祖伟,高长有.软骨组织工程用材料进展[J].生物医学工程学杂志,2O01,l8(4):638-641.
[4]Okemoto Y,Minami S,Matsuhashi A,et al.Application polymeric N-acetyl Dglucosamine(chitin)to veterinary practice[J].Vet Med Sci,1993,55(5):743-747.
[5]Van de Vord PJ,Matthew HW.Evaluation of the biocompatibility of a chitosan scaffold in mice[J].J Biomed Mater Res,2002,59(3):585-590.
[6]Mao JS,Cui YL.A preliminary study oil chitosan and gelatin polyelectrolyte complex cytocompatibility by cell cycleand apoptosis analysis[J].Biomaterials,2004,25(18):3973-3981.
[7]李朝阳,杨德安,徐廷献.可降解β-磷酸三钙的制备及应用[J].硅酸盐通报,2002,21(3):30-39.
[8]Zhang Y,Zhang M.Three-dimensional macroporous calcium phosphate bioceramics with nested chitosan sponges forloadbearing bone implants[J].J Biomed Mater Res,2002,61(1):1-8.
[9]王常勇,薄斌,赵强,等.以磷酸三钙多孔陶瓷为载体建造组织工程化人工软骨[J].中华整形外科杂志,2002,18(1):9-11.
[10]Yin Y,Ye F,Cui J,et a1.Preparation and characterization of macroporous chitosan -gelatin/beta -tricalcium phosphate composite scaffolds for bone tissue engineering [J].J Biomed Mater Res,2003,67A(3):844-855.
Experimental Study on Chitosan-Gelatin/β-Tricalcium Complex as Novel Scaffolds for Cartilage Tissue Engineering
LIU Jianbin.Depattment of Orthopaedics,The Fifth Hospital of Haerbin Medical University,Daqing 163316,China.
ObjectiveTo investigate the ultra-microstructure,physical characteristics and biocompatibility of the manmade porous chitosan(CS)-gelatin(Gel)/β-tricalcium(β-TCP)complex,so as to explore the feasibility of the complex as cartilage tissue engineering scaffolds.MethodsThe CS-Gel/β-TCP sponges were prepared by freezing and lyophilizing taking water as the hole-making agent.The ultra-microstructure was observed with scanning electron microscope.The compress strength and modulus were determined by omnipotent material-testing machine.The complex was subcutaneously imbedded in the rabbit to observe the biodegradability and biocompatibility.ResultsThe solid content of the mixed solution,the affix quantity of β-TCP and the preliminary freeze temperature play the decisive role of the hole structure of the scaffold complex.The compress strength and modulus of the scaffold improved significantly with the affix quantity of β-TCP increased.And the mechanical function reduced when preliminary freeze temperature lowered.Immunological rejection was observed on early stage after embedded.Then the scaffold degraded,and was absorbed at 12 weeks.ConclusionThe CSGel/β-TCP complex scaffold has a 3-D network structure with high porosity,good mechanical function and good biocompatibility.It may be regarded as one of the important cartilage tissue engineering scaffolds with latent value.
Tissue engineering;Scaffold;Chitosan;Gelatin;Beta-tricalcium phosphate;Mechanical function;Biocompatibility
R318.08
A
1673-0364(2010)06-0319-04
10.3969/j.issn.1673-0364.2010.06.005
163318 大庆市,黑龙江 哈尔滨医科大学第五附属医院骨科。
2010年10月5日,
2010年12月1日)
