PEI与Cr(Ⅲ)螯合物结构的测定及其分析应用
卫睿华
摘要:使用分光光度法与电导滴定法研究了聚乙烯亚胺(PEI)与Cr3+的配合过程,测定了二者形成的螯合物结构。Cr3+与水溶性聚胺PEI可以定量地形成六配位螫合物,而且配合过程速度很快,螯合物稳定;在用PEI水溶液滴定Cr3+过程中,体系的电导率快速下降,在滴定终点电导率发生了清晰的转变。建立了测定CR3+含量的一种新方法PEI螯合作用电导滴定法,考察了各种因素对分析方法的影响,优化了分析条件。
关键词:聚乙烯亚胺;铬离子;螯合物;电导滴定
中图分类号:R945
文献标识码:A
文章编号:1000-8136(2009)29-0086-03
聚乙烯亚胺(Polyethyleneimine。PEI)是一种典型的水溶性聚胺,大分子链上拥有大量的胺基N原子,使PEI具有很强的授电子性,这表现在它对重金属离子能产生很强的螯合作用[1],对重金属离子具有良好的富集、分离性能,因此聚乙烯亚胺是一种功能性水溶性大分子,其特性已引起了国内外学者的广泛关注,正将其应用于重金属离子的吸附分离[1,2]、环境保护[3,4]等研究领域。
在研究化学键合有PEI的载体对重金属离子吸附分离作用的过程时,我们发现,线性大分子聚乙烯亚胺与Cr3+会发生快速的螯合作用,生成稳定的、六配位的水不溶性螯合物。在此基础上,本研究建立了一种快速、准确且方便的测定Cr3+含量的新方法-PEI螯合作用电导滴定法,不但可以测定水溶液中的Cr3+含量,而且还可用来准确地测定水溶液中聚乙烯亚胺及其它可溶性胺的含量,因此PEI-Cr3+配位螫合体系在检测分析无机金属离子及水溶性高分子的检测分析领域,具有明显的应用价值。
1实验部分
1.1试剂与仪器
聚乙烯亚胺(武汉强龙化学工业有限公司,Mr=50000),化学纯;硝酸铬(Cr(NO3)3·5H2O,,天津市化学试剂三厂),分析纯;硝酸铵(红星化工厂),分析纯;浓氨水(太原化肥厂化学试剂厂),分析纯;浓盐酸(太原化肥厂化学试剂厂),分析纯;其它试剂均为分析纯试剂。
上海尤尼柯公司的UV-2602紫外可见光分光光度计;上海司乐仪器厂的721型分光光度计;上海第二分析仪器厂的PHS-2型酸度计;上海雷磁仪器厂的DDS-IIA型电导率仪。
1.2PEI与Cr3+螯合过程吸收光谱的测定
准确称取一定量的已干燥至恒重的PEI,在1L容量瓶中用蒸馏水稀释并定容,得到体积摩尔浓度一定的(按PEI大分子链中的N原子计算,为0.01574mol·L-1)PEI水溶液。
准确称取一定量的Cr(NO3)3·5H2O,在1L容量瓶中用蒸馏水稀释并定容,得到体积摩尔浓度为0.01574mol·L-1,的C3+溶液。
取若于份5mL浓度为0.01574 mol·L-1的Cr3+溶液分别置于若干个50mL容量瓶中,再向其中加人不同体积的浓度亦为0.01574 mol·L-1的PEI溶液,用蒸馏水稀释并定容至刻度,体系在高速离心机上离心分离后,以空白试剂为参比,用UV-2602分光光度计在490—660nm测定各上清液的吸收光谱。
1.3PEI与Cr3+螯合过程电导率的测定
用移液管准确量取5mLCr3+溶液于三角瓶中,加入5mL缓冲溶液(pH=6),使用PEI溶液滴定Cr3+溶液,用DDS-IIA型电导率仪测定滴定过程中加入不同体积PEI时溶液的电导率。
1.4PEI螯合作用电导滴定法测定Cr3+含量的分析方法
用移液管准确量取5mL待测铬溶液以及5mL缓冲溶液,使用PEI标准溶液滴定铬溶液,测定滴定过程中溶液的电导率与消耗的PEI溶液体积,绘制电导率-PEI溶液体积(K-v)曲线,由曲线的折点确定滴定终点时消耗的PEI溶液体积,由下式可求得铬的含量(g·L-1)。
c=V×cN×MCr/6×5
式中:c:待测铬溶液中铬的含量,g·L-1
V:转折点处对应的PEI溶液的体积,mL;
cN:PEI溶液的含氮体积摩尔浓度,mol·L-1;
MCr/6×5:铬的摩尔质量。
2结果与讨论
2.1 PEI—Cr3+)螯合物的结构
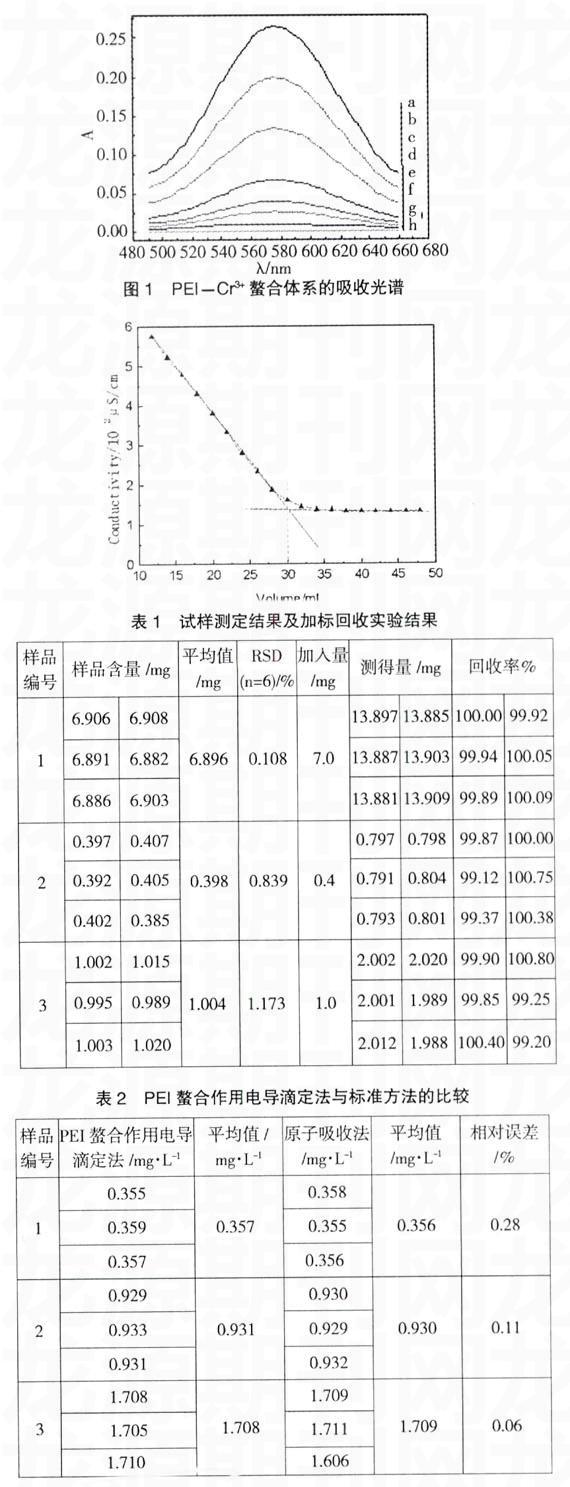
按照实验方法1.2,使5mL的Cr3+溶液(水合Cr3+离子的颜色为深绿色)与浓度相同但体积不同的PEI溶液发生配合反应,产物为苹果绿色的水不溶物质,用蒸馏水稀释并定容至刻度,体系在高速离心机上离心分离后,以空白试剂PEI溶液为参比,用UV-2602分光光度计在490nm~660nm波长范围内测定各混合体系上清液的吸收光谱,见图1。从图中可以看出。随着PEI溶液加入量的增多,体系的吸光度逐渐减小;当加入的PEI溶液体积为30mL(h谱线),即当加入的PEI溶液中N的物质的量与Cru离子的物质的量之比为6:1时,体系吸光度达到最小。A=0。表明Cr3+已配合完毕;再继续加入PEI溶液,体系的吸光度仍为零,i谱线与h谱线重合。实验结果清楚地表明,PEI大分子链中的胺基N原子与Cr3+发生了配合,形成了配位数为6的稳定螯合物。
图2为5mL的Cr3+溶液在用PEI溶液滴定过程中,体系电导率随PEI溶液体积的变化曲线。从图中看出,当消耗30mL的PEI溶液时,曲线发生了清晰的转折,这表明二者(Cr3+,N)反应的计量比为1:6,再次证实了PEI大分子链与Cr3+发生了配合作用,生成了配位数为6的螯合物。由此看来,PEI与Cr3+的螯合作用既速度快,又定量,在此基础上本研究建立了一种测定水溶液中Cr3+含量的新方法一PEI螫合作用电导滴定法。
2.2PEI螯合作用电导滴定法测定Cr3+含量条件的选择
2.2.1酸度的影响

