铜与浓硝酸反应的简易装置
万竹青
文章编号:1005-6629(2009)07-0020-01 中图分类号:G633.8文献标识码:C
1实验装置、操作及现象
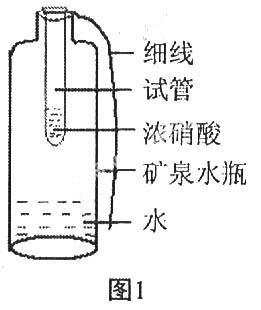
取一只无色矿泉水瓶,内盛有适量的蒸馏水,将瓶子稍微捏捏瘪。用细线将小试管(口径应比矿泉水瓶的口小)牢牢的扣紧,再向小试管里加入适量的浓硝酸,将试管放入瓶中,用手拉紧细线使两瓶口相平,用镊子夹取一小块铜片放入小试管中,立即放下线,将矿泉水的瓶盖拧上(见图1)。此时可观察到铜片表面产生大量的气泡,试管中溶液逐渐变为绿色,试管内产生红棕色气体,气体逐渐进入瓶内,瓶逐渐鼓起,一段时间后,将矿泉水瓶倒置振荡,瓶内反应停止,气体颜色逐渐变浅直至无色,矿泉水瓶又变瘪,瓶中溶液变为蓝色;打开瓶盖接触空气后,瓶内上端气体由上而下颜色逐渐变深,呈浅红棕色。
2实验现象解释
1.众所周知,硝酸铜溶液呈蓝色,但铜与浓硝酸反应后溶液却呈现绿色。原因是产生的红棕色二氧化氮气体一部分溶解在溶液中呈黄色,而溶液中[Cu(H2O)4]2+呈蓝色, 两者的混合色为绿色。
2.当绿色溶液与水混合后,溶液则变为蓝色。原因是二氧化氮遇水发生反应:3NO2+H2O=2HNO3 +NO,这样,溶解在溶液中的二氧化氮气体很快消失,最终瓶中溶液呈蓝色,且气体颜色逐渐变浅直至无色。
3.当向瓶内鼓入空气后,气体颜色又变为红棕色,原因是一氧化氮遇到空气变为二氧化氮,反应为:2NO +O2=2NO2
4.当瓶内液体混合后,反应停止。原因是硝酸变得很稀,与铜几乎不反应。
3 实验中注意的问题
1.浓硝酸浓度的选定
通过实验证明,当硝酸物质的量浓度≥11.0 mol•L-1时, 反应太快,太剧烈,难以控制,不便于操作;当硝酸物质的量浓度≤8.0 mol•L-1时,开始时产生无色气体,一段时间后,方有红棕色气体出现。故浓硝酸的浓度以10.0 mol•L-1左右为宜。
2.加铜片和通空气后要迅速盖上瓶盖。
4实验优点
1.按上述方法进行实验,操作简便,实验现象明显,既可以演示也可以分组实验。
2.这样实验能有效防止二氧化氮对空气的污染,也有助于同学们增强环保意识。
3.该装置有可随时停止反应的优点。

