乙醇催化氧化实验的创新设计
陈贵新 胡文礼 刘晶

一、问题的提出
人教版化学必修第二册中,乙醇催化氧化实验的做法是:将下端呈螺旋状的铜丝在酒精灯上灼烧,铜丝红热变黑后插入装有无水乙醇的试管中,反复几次,通过观察铜丝颜色的变化说明铜是催化剂,通过闻试管中液体有刺激性气味证明产物是乙醛。该实验虽然简易可行,但也存在如下问题:
1.通过闻气味的方法确定产物是乙醛,这个说服力不够强,因为无水乙醇的挥发性很强,乙醇的气味会带来干扰。
2.铜丝从酒精灯移到试管内过程中散热降温,且乙醇是液体温度低,反应生成的乙醛量很少,需要反复多次才能闻到一点乙醛的气味。
3.乙醇的催化氧化反应是一个放热反应,这在一些习题书上已经出现过,但课本实验中没有显现。
4.未能有效检验乙醇氧化后生成的乙醛。
二、乙醇催化氧化实验的创新设计
笔者认为,决定该实验成功的关键是反应温度,在较高的温度下,乙醇的催化氧化反应会更快,生成的乙醛量会更多。所以,笔者试着让乙醇气体在灼烧至红热的铜丝表面氧化,取得了很好的实验效果,具体的创新实验如下。
1.主要实验用品
无水乙醇、希夫试剂、10% NaOH溶液、5% CuSO4溶液、2%氨水、2% AgNO3溶液、1mol/L NaOH溶液;粗铜丝(下端螺旋状)、锥形瓶、吸滤瓶、水槽、烧杯、橡胶塞、玻璃导管、橡皮管、医用双连球、滤纸条、酒精燈。
2.实验过程与现象
(1)实验1:如图1所示,在锥形瓶中加入适量的热无水乙醇,或将盛有无水乙醇的锥形瓶放入热水中浸泡一会,使瓶内乙醇挥发产生较多的乙醇气体。取1根下端呈螺旋状的红色铜丝在酒精灯火焰上灼烧至火红色,迅速伸入锥形瓶内的中下方处,注意不要将铜丝插入乙醇中,可看到灼热的铜丝离开火焰后逐渐变为黑色,但进入锥形瓶中下部后,迅速由黑色变回到光亮的红色,再将铜丝拉升到锥形瓶口附近,可看到铜丝又呈火红色(略带黑色),证明乙醇在铜催化下与氧气反应放热。将铜丝在锥形瓶口和中下方之间反复来回移动几次,可看到铜丝表面的颜色也重复着变化,接着把蘸有希夫试剂的滤纸条放在锥形瓶口,可看到滤纸条表面很快变为紫红色,同时可闻到刺激性气味,证明有乙醛气体产生。
(2)实验2:取2支试管,向其中1支试管中加入2mL 10% NaOH溶液,滴加4滴5% CuSO4溶液,得到新制的深蓝色Cu(OH)2;向另1支试管中加入0.5mL 2% AgNO3溶液,然后边振荡边滴加2%氨水,直到产生的沉淀恰好溶解为止,得到银氨溶液,再滴加1滴1mol/L NaOH溶液,反复摇匀,尽可能使试管壁湿润。
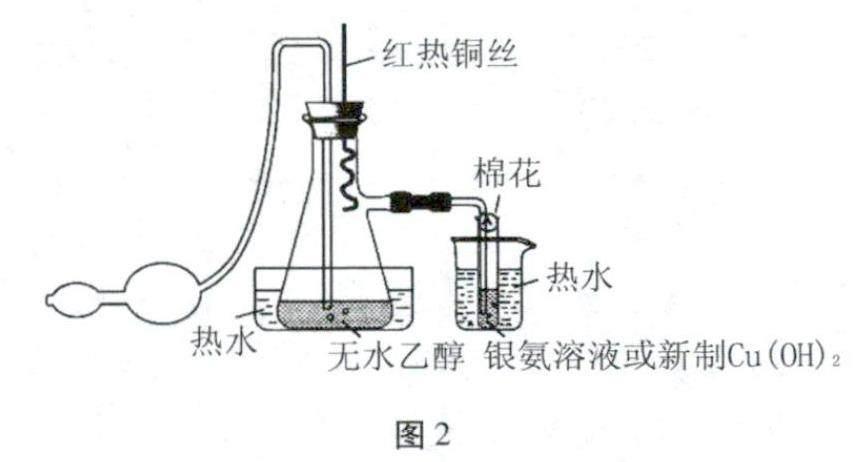
①按图2装置所示装配好仪器,试管中装有以上银氨溶液,往烧杯中倒入热水,取下锥形瓶上插有铜丝的橡胶塞,将下端的螺旋状铜丝在酒精灯火焰上灼烧至火红色,然后迅速将橡胶塞塞回到锥形瓶上,并立即用双连球缓缓鼓入空气,很快可看到盛有银氨溶液的试管壁上产生亮黑色的银镜,证明有乙醛气体生成。
②用装有以上新制Cu(OH)2的试管替换有银氨溶液的试管,重复步骤①的操作,1min后可看到新制的Cu(OH)2慢慢变成绿色。将试管取出,置于酒精灯火焰上加热,可看到有砖红色沉淀产生,同样证明有乙醛气体生成。
3.实验注意事项
(1)在实验1中,锥形瓶中无水酒精的温度在60℃左右效果较好。
(2)在实验2中,用双连球鼓气要缓缓进行,否则过多的乙醇气体会降低铜丝的温度,从而导致反应变慢。
(3)银氨溶液中加点稀碱溶液可增强它的还原性。
(4)若现象不够明显,可将铜丝重新加热后再操作,使产生足够多的乙醛气体。
4.实验优点
(1)装置简单,操作简便,可重复操作,现象明显,成功率高。
(2)增加了反应放热的实验,改进了产物的检验方法,使得产物的检测更加直观、快速,增强了实验的教学效果。
(3)该创新实验既适合课堂演示,还可用于学生的课外探究活动。
(收稿日期:2024-01-12)

