果蔬成分与细胞结构对其质地特性的影响
赵邯 刘春菊,* 李越 李大婧 李斌 牛丽影 肖亚冬 于蕊
(1江苏省农业科学院农产品加工研究所,江苏 南京 210014;2沈阳农业大学食品学院,辽宁 沈阳 110161)
随着生活水平的提高,水果与蔬菜成为人们日常饮食中不可或缺的食物之一。有研究表明,适当食用水果与蔬菜可有效降低患癌症的风险,且水果与蔬菜具有低热量及高膳食纤维等特点,有助于人们降低体重,降低高血压、高血脂等疾病的发生几率[1]。而不同果蔬的内在化学成分、细胞组织结构和外在质地特性、口感味道等差异较大,如苹果富含碳水化合物、酚类等营养物质,且干物质含量丰厚,组织结构较为紧密,表现出较好的黏弹性[2];桃味道香甜,富含糖类物质和果胶,香气浓郁,质地较软[3-4];马铃薯的淀粉、纤维素、果胶质含量较高,具有较高的硬度[5]。
质地是除了色、香、味之外重要的物理品质特性,是决定果蔬品质优劣的关键指标之一,也是影响消费者选择产品的重要因素。Wang等[6]研究表明,细胞内可溶性固形物、蛋白质、淀粉、多糖、可溶性糖及酚类等化学组分均对质地特性存在一定影响;李卓豪等[7]研究发现,果蔬内含有的小分子糖可替代水分,与大分子极性残基连接,稳定细胞膜中的结构组分如磷脂、蛋白质等,防止细胞发生坍塌;Zhang等[8]研究表明,纤维素是影响产品质地特性的主要因素,其次是淀粉、果胶含量;张崇彬[9]研究发现,蛋白质可作为淀粉物料膨化时内部密闭气室的可塑性壁材,对产品的组织结构具有改善作用,对内部网架结构的力学特性具有维持作用;Feng等[10]研究发现,纤维素是一种稳定性较强的聚合物,其微纤维厚度对细胞壁的机械强度有着显著影响。果蔬细胞的形态、结构以及空间排布对果蔬的力学性能具有直接影响,决定着果蔬产品的质地[11],武新慧等[12]研究发现,细胞变形、细胞间的孔隙增大、细胞膨压下降是影响果蔬黏弹性的主要原因。田青兰等[13]研究表明,果皮的质地特性与其微观结构具有显著相关性。
不同果蔬具有不同的性质与结构,同时也影响后续加工过程中的产品品质。本研究选取6种常见的不同基质类的果蔬作为研究对象,测定其化学组分、微观结构、孔隙率、力学特性及质地特性,通过相关性分析、主成分分析以及聚类分析探明不同果蔬化学组分、细胞结构与质地特性之间的关系,旨在为后续果蔬的加工利用提供理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
选取新鲜、八分熟的果蔬,包括苹果(陕西红富士)、梨(山西贡梨)、桃(锦绣黄桃)、马铃薯(定西黄皮土豆)、山药(安徽淮山药)、青萝卜(潍县萝卜),购于南京市国银水果超市。蒽酮、戊二醛、甲醇、氢氧化钾、无水碳酸钠、硼氢化钠、三氯甲烷、丙酮、无水乙醇、二甲苯、中性树胶、酒精醋酸福尔马林混合固定液(formalin-aceto-alcohol,FAA),上海国药集团化学试剂有限公司。
1.2 仪器与设备
SZF-06A粗脂肪测定仪,上海新嘉电子有限公司;CT3-25K型质构仪,美国BROOKFIELD公司;101A-2型数显电热鼓风干燥箱,上海浦东荣丰科学仪器有限公司;QDPH-5型电加热式气流膨化设备,天津市勤德新材料科技有限公司;BS224S电子分析天平,北京赛多利斯科学仪器公司;TDL-5-A低速台式大容量离心机,上海安亭科学仪器厂;HZQ-F100全温度振荡培养箱,太仓市华美生化仪器厂;UV-6300紫外可见分光光度计,上海美谱达仪器有限公司;JXFSTPR全自动样品快速研磨仪,上海净信实业发展有限公司;H-7650透射电子显微镜,上海铸金分析仪器有限公司。
1.3 试验方法
1.3.1 原料预处理 选取6种形状大小均匀、无损伤的不同新鲜果蔬清洗、去皮,一部分果肉用于后续化学组分以及细胞结构的测定;另一部分制成直径为27 mm、厚5 mm的果蔬片,用于孔隙度、应力-松弛曲线、质地剖面分析(texture profile analysis,TPA)指标测定。
1.3.2 基本化学成分含量测定 水分含量:GB 5009.3-2016《食品安全国家标准 食品中水分的测定》[14];淀粉含量:GB 5009.9-2016《食品安全国家标准 食品中淀粉的测定》[15]中的酸水解法;脂肪含量:GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》[16];蛋白质含量:GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》[17]中的分光光度法;总酸含量:GB 12456-2021《食品安全国家标准 食品中总酸的测定》[18];灰分含量:GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》[19];可溶性糖含量测定参照黄丽等[20]的方法,结果均以新鲜质量计。
1.3.3 细胞壁组分含量的测定
1.3.3.1 细胞壁提取 取20.0 g新鲜果蔬去皮后切丁,液氮冷冻后进行研磨,研磨后样品分别加入80 mL 95%的乙醇溶液,在100 ℃下水浴30 min,冷却后离心40 min。去上清液,加入70%乙醇120 mL充分搅拌后再次离心。去上清液后分别加入120 mL氯仿-甲醇(体积比为1∶1)、120 mL丙酮进行抽滤,直至滤渣呈白色粉饼状。收集所得滤渣,将滤渣置于60 ℃干燥箱中干燥至恒重,即得细胞壁物质(cell wall material,CWM);将CWM装袋密封后于-80 ℃超低温冰箱储存。
1.3.3.2 细胞壁各组分分离 称取0.04 g CWM放入50 mL离心管中,加入25 mL蒸馏水,热水浴5 min,冷却后离心(11 000 r·min-1,40 min),上清液为水溶性果胶(water-soluble pectin,WSP)。取残渣加入25 mL 0.05 mol·L-1反式-1,2-环己二胺四乙酸溶液(含0.1 mol·L-1乙酸钾),在28 ℃下恒温震荡培养6 h,离心,上清液为螯合性果胶(CDTA-soluble pectin,CSP)。取残渣加入25 mL的50 mmol·L-1碳酸钠溶液(含20 mmol·L-1硼氢化钠)25 ℃下恒温震荡培养6 h,离心,上清液为碱溶性果胶(Na2CO3-soluble pectin,NSP)。进一步在剩余残渣中加入25 mL 4 mol·L-1氢氧化钾溶液(含20 mmol·L-1硼氢化钠)25 ℃震荡培养12 h,离心,上清液为半纤维素(hemicelluloses,HC)。在剩余残渣中加入25 mL蒸馏水冲洗,离心,将5 mL 72 %硫酸加入洗涤后的沉淀中,35 ℃恒温培养1 h后加入25 mL蒸馏水,100 ℃水解1 h,离心,得到纤维素(cellulose,CEL)。WSP、CSP、NSP含量采用咔唑乙醇比色法进行测定,HC、CEL含量采用蒽酮比色法测定,结果均以新鲜质量计。
1.3.4 微观结构
1.3.4.1 过碘酸雪夫染色法(periodic acid-schiff stain,PAS) 将不同新鲜去皮果蔬切成体积不超过1 cm3的果蔬块,放入10 mL离心管中,加入FAA固定液,常温保存。将样品进行石蜡切片、染色、脱水,封片后利用显微镜镜检,并采集图像进行分析。
1.3.4.2 透射电镜观察 将果肉切成2 mm×2 mm×2 mm的小正方体后,放入装有6 mL 2.5%戊二醛溶液的离心管中,用纱布将样品固定在溶液中(防止样品漂浮在溶液表面),常温放置2 h后,放入4 ℃冰箱内保存24 h,再进行前固定、漂洗、后固定、脱水、包埋、聚合、切片等试验流程,运用透射电镜对制片进行图像采集。
1.3.4.3 图像处理 运用CaseViewer 2.4软件将不同新鲜果蔬PAS染色图放大相同倍数,运用Image J V 1.8.0软件对原始图像进行灰度转化、二值化表达;再运用Adobe Photoshop 2020软件对二值图内的杂质进行消除,并填补细胞间孔隙及边缘,调整图像对比度及亮度,获得最终图像。
1.3.4.4 测量指标 利用Image J V 1.8.0软件计算不同新鲜果蔬最终图像上的平均细胞横截面面积(A)、细胞横截面周长(L)和分形维数,并根据公式计算当量直径、细胞圆度,每个组计算3个平行。
细胞当量直径:与所测对象面积相同的圆的直径D,计算见公式(1):
式中,D为细胞截面当量直径(μm);A为细胞截面面积(μm2)。
细胞圆度:细胞横截面接近理论圆的程度SR,计算见公式(2):
式中,SR为细胞截面圆度;A为细胞截面面积(μm2);L为细胞截面周长(μm)。
1.3.5 孔隙度测定 参照Zielinska等[21]的方法测定体积密度、颗粒密度及孔隙度。
1.3.6 应力-松弛特性曲线测定 采用CT3-25K质构分析仪进行应力-松弛曲线的测定:探头为TA25/1000,目标值为形变量20%,触发点负荷为10 g,测试速度为1 mm·s-1。
运用公式(3)和公式(5)计算出应力与应变数值,运用公式(4)计算出最大应力,运用公式(6)拟合载荷部分的应力-应变曲线:
式中,σ为应力(MPa);G为负荷(N);A为样品的横切面面积(cm2);σmax为最大应力(MPa);Fmax为最大负荷(N);ε为应变(%);△L为位移或距离(厚度改变量)(mm);L为样品压缩前原始厚度(mm);E为弹性模量(MPa);p为黏性指数;d为黏弹性参数(MPa)。
松弛段曲线用Maxwell三元件流变模型进行拟合,其数学模型见公式(7)和公式(8):
式中,F(t)为物料承受的载荷(N);t为松弛试验时间(s);D0为定变形量(mm);E0为平衡弹性系数(N·mm-1);E1为衰变弹性系数(N·mm-1);T为松弛时间(s);η为阻尼体黏滞系数(N·s·mm-1)。
使用IBM SPSS Statistics 25软件将F(t)与t值代入上述公式,运用非线性拟合对原始数据进行拟合求解,得到压缩段σmax、E和松弛段E0、E1、T、η参数。
1.3.7 质地特性测定 运用CT3-25K质构分析仪对不同新鲜果蔬样品的质构进行测定,选用TPA模式进行二次压缩。
1.4 数据处理
试验数据由IBM SPSS Statistics 25软件进行Duncan方差分析,显著性水平P<0.05,采用Origin 2021软件作图。
2 结果与分析
2.1 不同果蔬基本化学成分
由表1可知,6种果蔬样品中水分含量最高为青萝卜(91.55 g·100 g-1),水分含量较低为马铃薯(81.13 g·100 g-1)和山药(81.68 g·100 g-1);淀粉含量较高的是马铃薯(14.57 g·100 g-1)和山药(13.98 g·100 g-1),分别占总固形物含量的77.21%和76.31%;脂肪含量较高为苹果(0.15 g·100 g-1)和青萝卜(0.12 g·100 g-1);山药所含蛋白质和灰分含量较高;桃的总酸含量最高,为0.29 g·100 g-1。
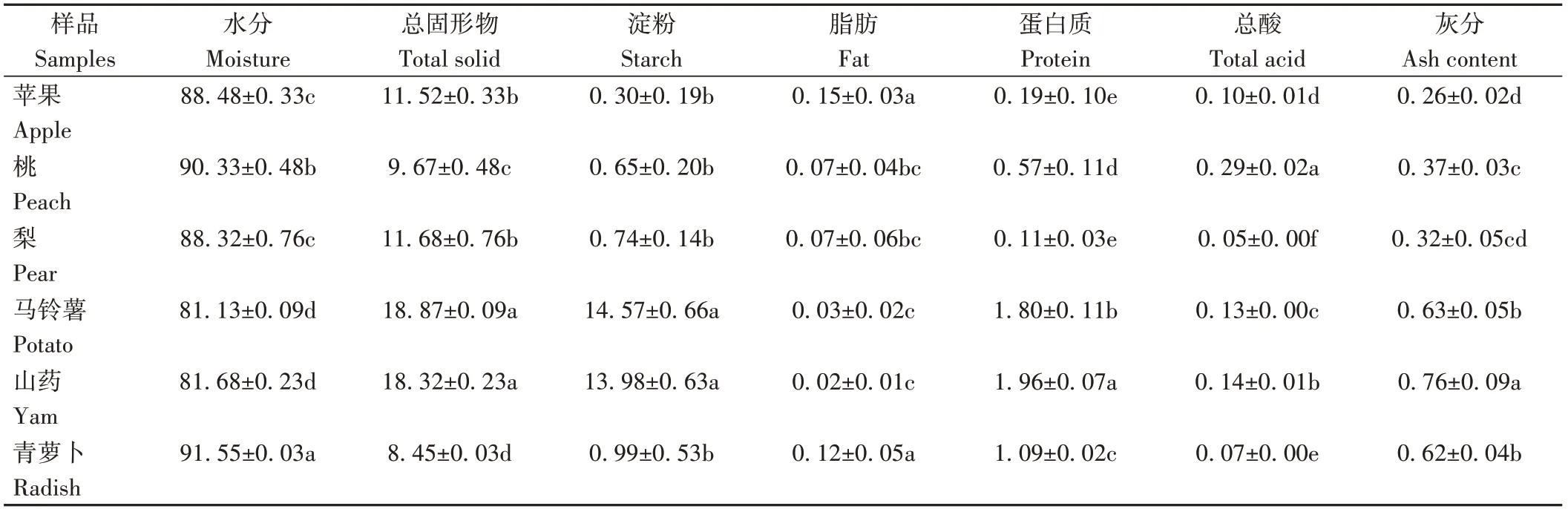
表1 不同果蔬化学成分含量Table 1 Basic chemical components content of different fruits and vegetables/(g·100 g-1)
由表2可知,不同果蔬之间的可溶性糖组分含量存在明显差异。苹果中果糖含量最高,占总糖含量的62.63%,其次是葡萄糖,最少的是蔗糖;桃中蔗糖含量最高,占总糖含量的71.08%,与其他果蔬差异较大;梨中果糖含量最高,占总糖含量的67.08%。蔬菜组中的可溶性糖含量为5.14~25.64 mg·g-1,较水果组含量低,青萝卜可溶性糖含量在蔬菜组中较高,马铃薯与山药的总糖含量较低且差异不显著(P>0.05)。
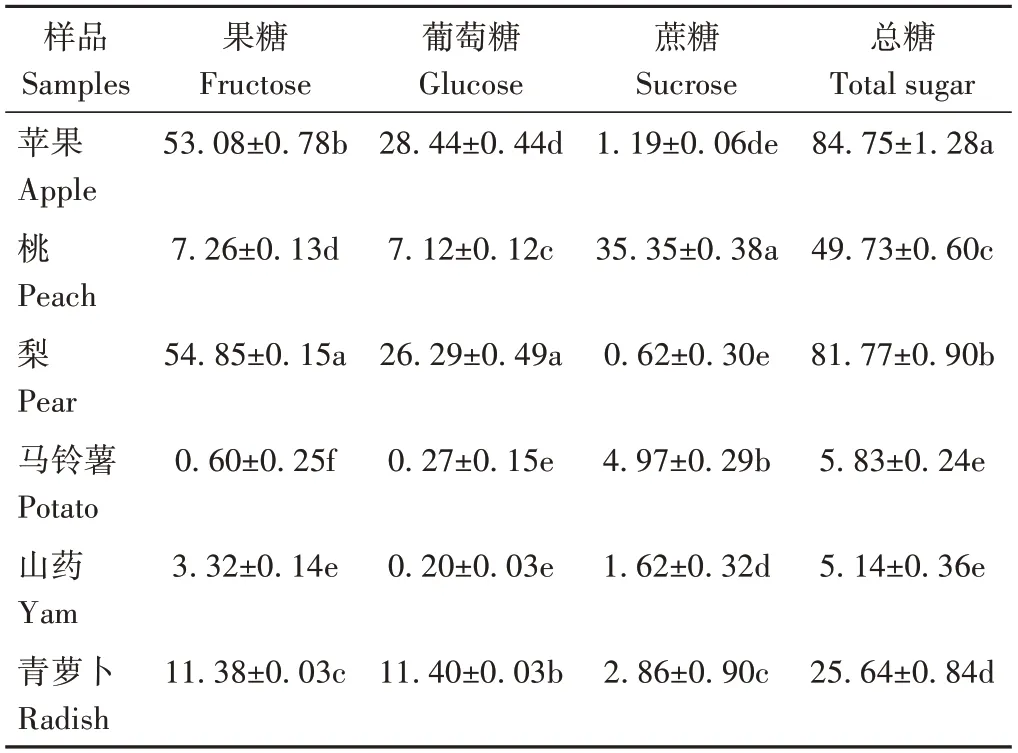
表2 不同果蔬可溶性糖含量Table 2 Soluble sugar content of different fruits and vegetables/(mg·g-1)
2.2 不同果蔬细胞壁物质及其各组分含量
由表3可知,蔬菜的CWM含量显著高于水果(P<0.05)。桃果实的WSP含量为2.22 mg·g-1,显著高于其他果蔬(P<0.05),而青萝卜的WSP含量最低。青萝卜的CSP含量最高,山药的CSP含量最低。苹果中NSP的含量最高,马铃薯中NSP含量最低。水果中桃的总果胶含量最高,梨的总果胶含量最低;蔬菜中青萝卜的总果胶含量最高,马铃薯和山药的含量较低。蔬菜组的HC、CEL和总纤维含量均显著高于水果组(P<0.05),其中马铃薯的HC、CEL和总纤维含量最高;水果组中梨的HC含量最低,为0.68 mg·g-1,苹果与桃的HC含量无显著差异(P>0.05);不同水果的CEL含量存在显著差异(P<0.05),其中苹果CEL含量最高,桃含量最低。
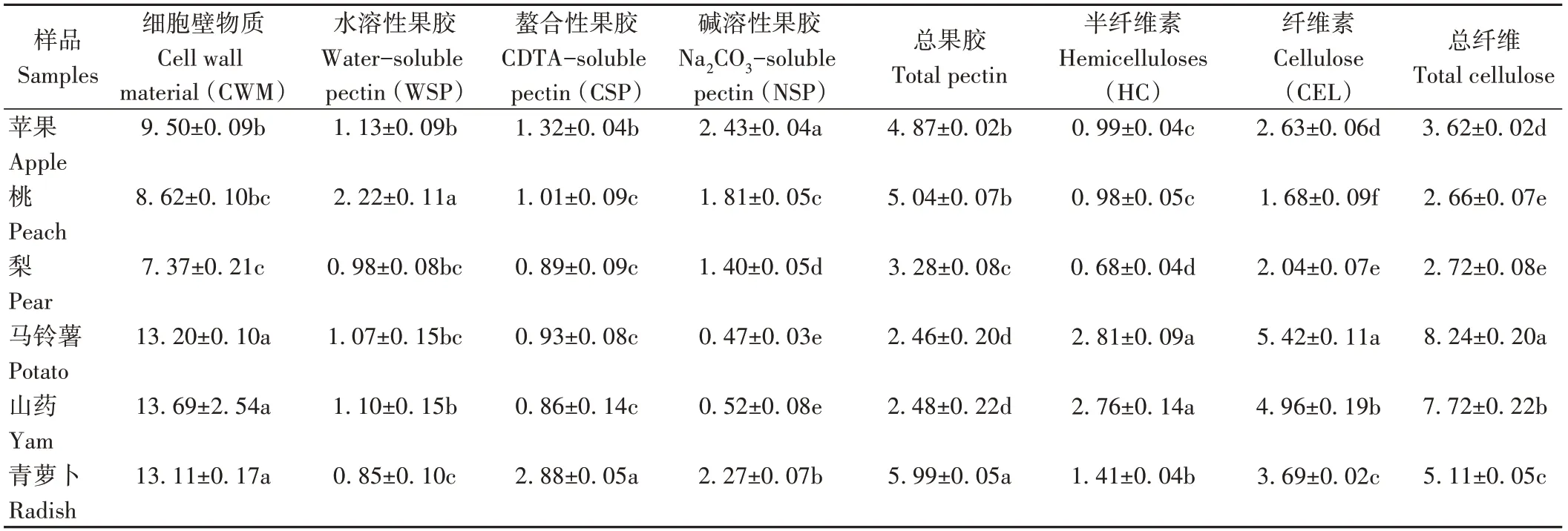
表3 不同果蔬中细胞壁物质及其组分含量Table 3 Cell walls and their components content of different fruits and vegetables/(mg·g-1)
2.3 不同果蔬细胞微观结构
2.3.1 不同果蔬细胞结构 由图1可知,新鲜果蔬的组织结构较为紧密,细胞边界清晰,形态较为饱满,细胞间孔隙较少,排列较为规则。但不同果蔬间的细胞结构差异较为明显,由图1-A可知,苹果细胞较大,细胞大小不均一,细胞间存在较大空隙[22];由图1-B可知,桃的细胞最小,各细胞紧密连接在一起,排列规则性较低;由图1-C可知,梨的细胞大小分布不均匀,较大细胞呈现多边形,较小细胞呈现椭圆形状态,排列较为紧密;由图1-D、E可知,马铃薯与山药细胞轮廓清晰,排列紧密,细胞中均存在淀粉颗粒,颗粒呈椭圆形,均匀地分布在细胞中,与山药相比,马铃薯细胞中存在少量较大的淀粉颗粒,而山药细胞中存在大量较小的淀粉颗粒;由图1-F可知,青萝卜的细胞排列紧密,细胞呈椭圆形,但细胞大小分布不均匀,存在多个细胞聚集在一起的现象。
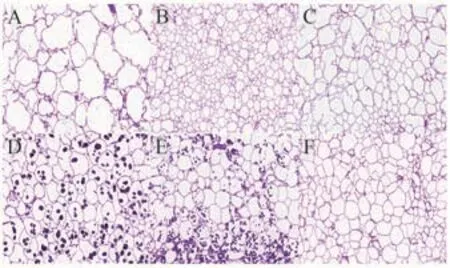
图1 不同果蔬PAS染色图(放大倍数6.5×,标尺200 μm)Fig.1 PAS staining diagrams of different fruits and vegetables(magnification:6.5×,scaleplate:200 μm)
2.3.2 不同果蔬细胞结构量化指标差异 将图1中不同果蔬的PAS染色图经处理并计算后,得到不同果蔬的细胞结构指标,如表4所示。不同果蔬之间的细胞差异较大,苹果的细胞截面面积、细胞截面周长及细胞当量直径均值均为最大,细胞圆度均值最小,为0.55,表明苹果细胞较大,但细胞形态较不稳定、不规则;桃的细胞截面面积、细胞截面周长及当量直径均值最小,表明桃的细胞较小,细胞形态较规则;梨细胞截面面积、细胞截面周长和当量直径的变异系数最高,说明梨细胞之间差异较大,细胞大小分布不均匀,但梨细胞圆度均值最高,表明梨细胞较为规则,细胞形态接近圆形。除细胞圆度外,马铃薯、山药和青萝卜的细胞各参数均值处于苹果与桃之间,其中马铃薯细胞截面面积的变异系数最小,表明马铃薯细胞大小分布较为均匀;山药细胞大小与形态处于马铃薯与青萝卜之间;青萝卜细胞圆度较高,细胞形态较稳定,细胞形态较规则。
2.3.3 不同果蔬超微结构 不同细胞结构的细胞壁在组成和尺寸厚度上存在一定差异。结合图1-A~C与图2-A~C可知,苹果、桃、梨细胞壁连接较为松散,存在断裂情况,其中苹果细胞壁孔隙较大,这是由于果实中胶层组织被破坏,细胞壁之间的聚合力下降,黏附能力降低,对孔隙大小存在一定影响,而孔隙又与果蔬的弹性存在相关性[23];由图1-D~F和图2-D~F可知,马铃薯、山药、青萝卜的细胞壁排列相对紧密,边界较为清晰,组织状态更加饱满。由图3可知,苹果、马铃薯与青萝卜的细胞壁较厚,其中马铃薯细胞壁最厚;梨与山药的细胞壁较薄,无显著差异(P>0.05)。
2.4 不同果蔬孔隙特性
有研究表明,孔隙占比决定着物料物理性质和强度[24]。由图4可知,不同果蔬孔隙度之间存在较大差异,苹果与青萝卜的孔隙度较高,且两者间无显著差异(P>0.05),桃的孔隙度显著低于其他果蔬(P<0.05)。孔隙度与体积密度呈反比,苹果与青萝卜的体积密度较低,其他4种果蔬体积密度差异不显著(P>0.05);桃的颗粒密度显著低于其他果蔬(P<0.05)。
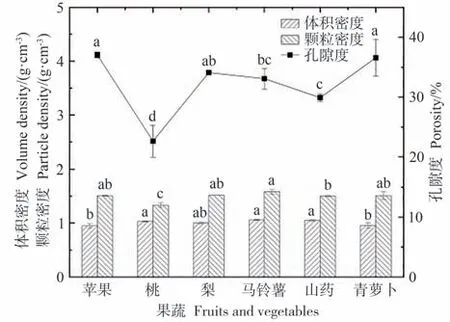
图4 不同果蔬的孔隙特性Fig.4 Pore characteristics of different fruits and vegetables
2.5 不同果蔬应力-松弛特性
表5为不同果蔬应力-松弛特性参数,不同果蔬之间的特性参数具有明显差异。其中应力-松弛特性参数中的σmax与硬度有关;E0代表果实果肉的弹性,其值越大,细胞壁弹性越强,果肉的硬度越高;T与η代表果实果肉的黏性部分,其值越大,代表果肉的黏性越低。由表5可知,马铃薯的E值最高,桃的σmax、E、E0、E1值较低,青萝卜的E0、E1值较高。这是由于马铃薯细胞壁较厚,结构紧密,细胞壁结构中含有的纤维素微纤维会通过抵抗应变并限制细胞膨胀,导致不连续性或曲率的形成,进而使应力增加[25];而桃中水溶性果胶含量较高,会降低细胞间的黏附作用,使得桃果实刚性较低[26];青萝卜的弹性较高,是由于细胞壁较厚影响着样品的机械强度[27]。马铃薯与山药的T值较高,桃的T、η值较低,说明马铃薯与山药的黏性较低,桃的黏性较高,这是由于马铃薯与山药的果胶含量较低,而果胶具有控制细胞壁黏附的作用。
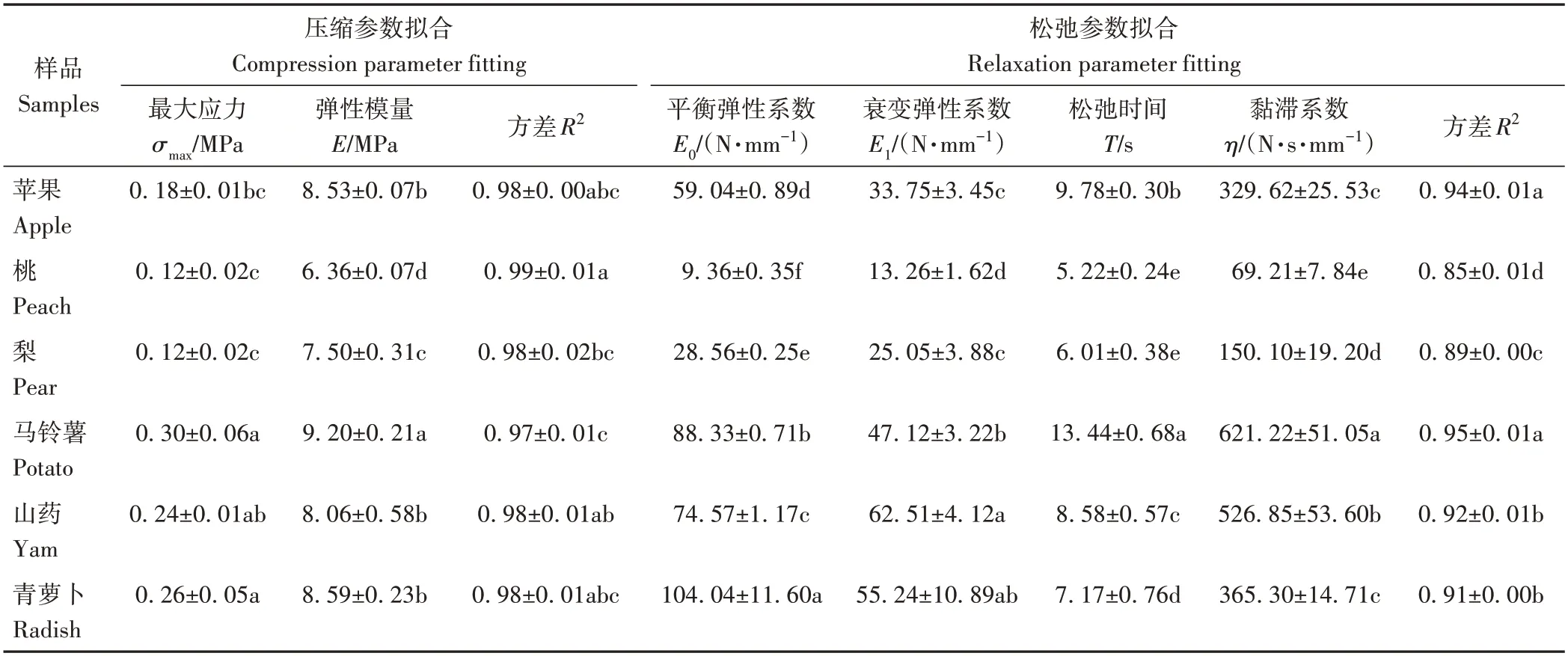
表5 不同果蔬应力-松弛特性参数Table 5 Stress-relaxation characteristic parameters of different fruits and vegetables
2.6 不同果蔬质地特性
质地特性是影响消费者选择的重要指标。由表6可知,6种果蔬在硬度方面存在着较大差异,青萝卜的硬度、胶着性、咀嚼性在6种果蔬中较高;桃的质地特性参数显著低于其他果蔬(P<0.05)。在水果组中,苹果的质地特性参数高于桃与梨,主要表现在硬度、弹性、胶着性与咀嚼性方面;梨的各项参数略低于苹果。蔬菜的硬度远高于水果,马铃薯和苹果的弹性、胶着性、咀嚼性之间无显著差异(P>0.05);在蔬菜组中,山药的各指标低于马铃薯与青萝卜,但在内聚性方面与马铃薯差异不显著(P>0.05)。
2.7 相关性分析
由图6可知,部分化学组分及应力-松弛、质地特性参数之间存在较强的相关性。淀粉含量与σmax、E1、T、η呈极显著正相关(P<0.01),因此马铃薯与山药的硬度较高、黏弹性较低;蛋白质含量与T、硬度呈显著正相关(P<0.05),与σmax、E0、E1、η呈极显著正相关(P<0.01);总酸含量与E0、硬度呈显著负相关(P<0.05),与E、内聚性、弹性、胶着性、咀嚼性呈极显著负相关(P<0.01);脂肪含量与应力-松弛、质地特性参数之间的相关性不显著(P>0.05)。可溶性糖中,果糖含量与σmax呈显著负相关(P<0.05);葡萄糖含量与σmax、η呈显著负相关(P<0.05);蔗糖含量与η呈显著负相关(P<0.05),与E、E0、E1、质地特性参数均呈极显著负相关(P<0.01),说明可溶性糖组分中,蔗糖对质地的影响较大。
细胞壁及其组分中,CWM含量与大部分应力-松弛特性参数(E、σmax、E0、E1、η)和部分质地特性参数(硬度、胶着性、咀嚼性)呈极显著正相关(P<0.01);WSP含量与部分应力-松弛特性参数、质地特性参数呈极显著负相关(P<0.01);CSP含量与E0呈显著正相关(P<0.05),与硬度、胶着性、咀嚼性呈极显著正相关(P<0.01);HC含量与部分应力-松弛特性参数呈极显著正相关(P<0.01);CEL含量与弹性呈显著正相关(P<0.05),与应力-松弛特性参数、胶着性、咀嚼性呈极显著正相关(P<0.01)。
在细胞微观结构中,细胞壁厚度与σmax、T、胶着性、咀嚼性呈显著正相关(P<0.05),与E、η、弹性呈极显著正相关(P<0.01);细胞截面面积和细胞截面周长均与T、弹性呈极显著正相关(P<0.01);当量直径与E、T、内聚性、弹性呈极显著正相关(P<0.01);细胞圆度与T、η呈极显著负相关(P<0.01);分形维数与质地特性之间的相关性不显著(P>0.05)。
颗粒密度与大部分应力-松弛、质地特性参数呈极显著正相关(P<0.01),进一步说明颗粒密度是影响质地的重要参数;体积密度与内聚性呈显著负相关(P<0.05);孔隙度与E、E0、质地特性参数呈极显著正相关(P<0.01);其中应力-松弛特性参数与部分质地特性参数之间存在极显著正相关性(P<0.01)。
2.8 主成分及聚类分析
主成分分析主要通过降维的方式将多指标转化为少数综合性指标[28]。用SPSS软件对不同果蔬化学成分、组织结构、质地特性进行主成分分析,特征值大于1的主成分共3个,其累计方差贡献率为90.3%,可代表原数据的变化趋势,所以抽取3个主成分进行分析,详见图6。图6-A为主成分分布3D图,由图6-A可知,PC1、PC2、PC3的贡献率分别为47.9%、29.9%和12.5%。图6-B、C、D分别为图6-A的切面图。结合图6-B与图5可知,PC1反映的指标有η、CEL、σmax、E、E0、E1、CWM、硬度、颗粒密度、HC、T,其中CEL、σmax、E、E0、E1、CWM、硬度、颗粒密度、HC、T等均与η呈极显著正相关(P<0.01),因此选择η作为第一主成分。PC2反映的指标有体积密度、脂肪、葡萄糖、内聚性、孔隙度(图6-C),其中脂肪、葡萄糖含量、内聚性、孔隙度与体积密度呈极显著(P<0.01)或显著负相关(P<0.05),因此选择体积密度作为第二主成分。由图6-D可知,PC3主要以CSP影响为主,绝对值权重高达0.855,因此选择CSP作为第三主成分。综上所述,选择η、体积密度、CSP含量作为核心评价指标。
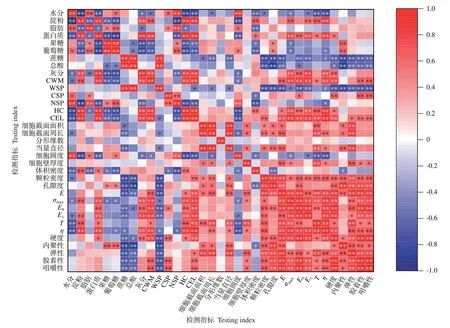
图5 相关性分析Fig.5 Correlation analysis
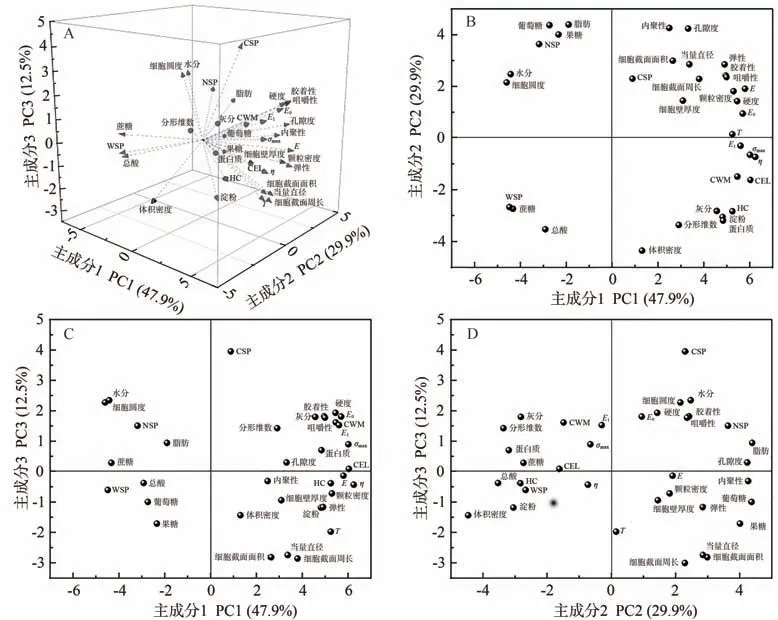
图6 不同果蔬PCA图Fig.6 PCA chart of different fruits and vegetable
由图7可知,马铃薯和山药被聚为一类,说明它们差异较小,其淀粉、HC含量、硬度较高,可溶性糖含量和黏性较低,主要差异在于组织结构不同,其中马铃薯的细胞壁较厚并存在较大淀粉颗粒,而山药细胞壁较薄并存在较小淀粉颗粒。
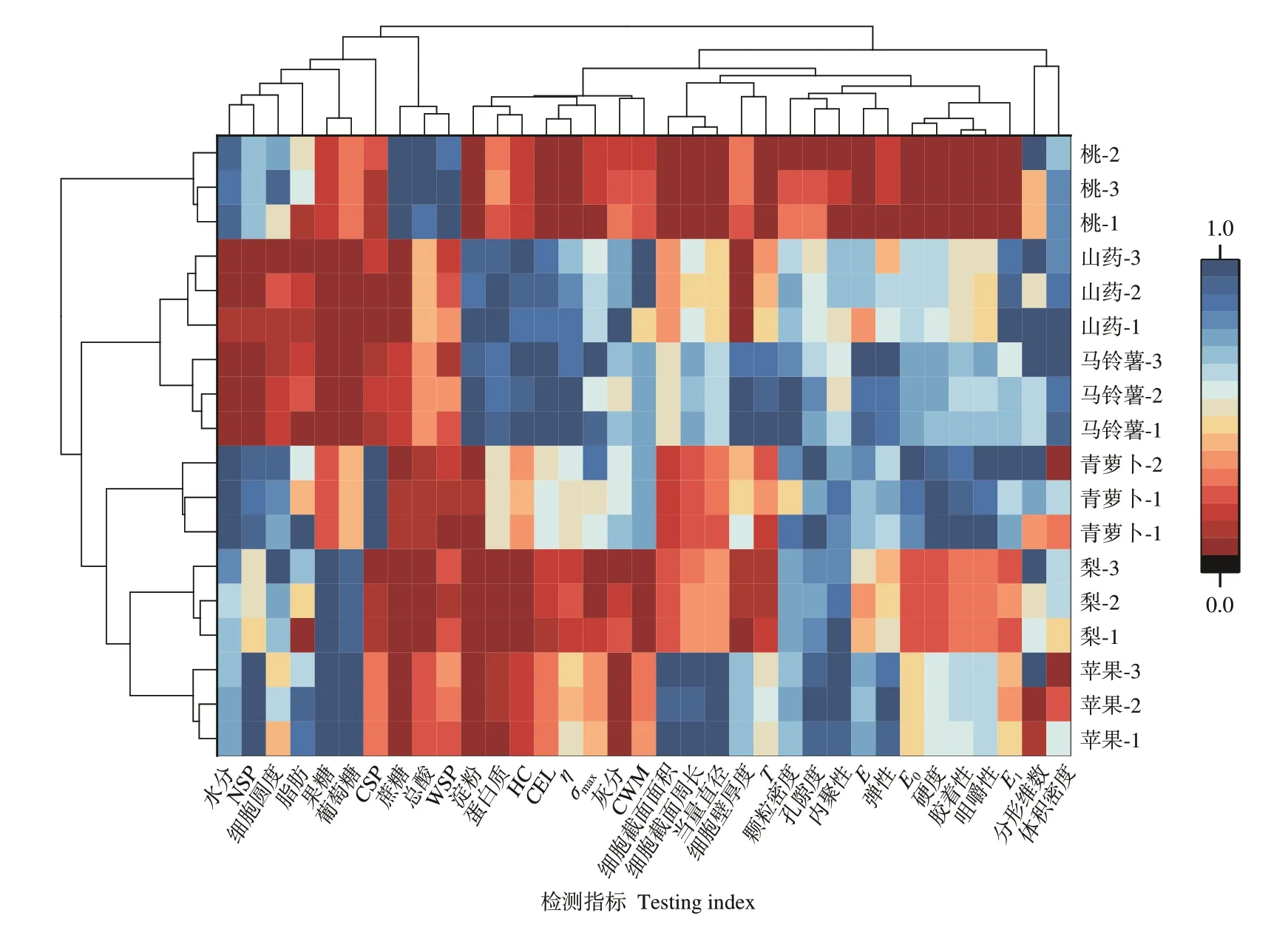
图7 聚类分析热图Fig.7 Cluster analysis heatmap
3 讨论
本研究发现,不同基质果蔬的质地特性与化学成分和细胞结构有关。在化学成分中,细胞壁组分纤维素与果胶含量对质地影响较大,蔬菜的纤维素含量要高于水果,通过对比应力-松弛特性与质地特性,可以发现,蔬菜组的应力-松弛特性与硬度要明显高于水果组,其中青萝卜硬度最高,HC和CEL含量与质地特性指标呈正相关。纤维素和半纤维素构成了细胞壁的主要“骨架”,主要起力学支撑作用[29]。Ranganathan等[30]研究发现,植物材料中的纤维素等细胞壁组成成分直接影响最终产品的质地特性。Yao等[31]研究表明,纤维素分子聚合时链状多糖分子形成微纤维,HC可与纤维素微纤维的表面相互连接,形成稳定的网络结构,增加细胞壁机械强度。本研究发现,桃的WSP和NSP含量较高,CSP含量较低,应力-松弛特性指标与硬度最低,WSP含量与质地特性指标呈极显著负相关,CSP含量与部分质地特性指标呈极显著正相关。这是由于果胶主要起连接与维持细胞结构的作用[32],WSP通过非共价键和非离子键松散地结合到细胞壁上,CSP含量内部结合力较大,有利于细胞壁结构的稳定[33];NSP对维持细胞之间的黏连和果蔬质地具有重要作用[34]。陈丹等[35]研究发现,超高压竹笋有更高的CSP和NSP以及更低的WSP含量,表现出更高的硬度。Wang等[36]研究发现,随着猕猴桃采后时间进程的推移,WSP含量增加,细胞结构被破坏,导致猕猴桃软化。Liu等[37]研究发现,在莲藕加工过程中加入醋酸可以增加CSP含量,使莲藕保持较高的硬度与细胞壁完整性。
在细胞微观结构中,细胞截面面积、周长、当量直径、细胞壁厚度与部分力学特性、质地特性相关性较强,呈正相关,细胞圆度与部分力学特性指标呈负相关;孔隙中的颗粒密度和孔隙度与质地特性指标呈极显著正相关,体积密度与部分质地指标呈显著负相关。由于细胞存在一定的圆度,相邻细胞间会形成细胞间隙,即多孔物料的孔隙,这些细胞间隙是水分和气体运输的最佳通道,从而影响果蔬质地。白岚莎[38]研究发现,桃在贮藏期间出现了细胞结构坍塌、不规则程度增加、细胞膜破坏、细胞内容物溶出等现象,细胞形态变化明显,果肉硬度随之下降。Wu等[39]研究发现,胡萝卜经处理后,内部细胞结构外壳塌陷,细胞面积、周长增加,圆度系数降低,从而使硬度降低。
本研究证明了果蔬的化学成分(可溶性糖,细胞壁及其组分)含量、细胞微观结构、孔隙度对质地影响较大。也有研究表明,果蔬的质地由多指标共同作用,包括内部膨胀压力、细胞腔内水的特性、细胞壁的机械强度与厚度、细胞和孔的大小等[40],在这一方面还有待进一步研究。
4 结论
本研究发现,苹果与梨中果糖含量较高,桃中蔗糖、WSP含量较高,马铃薯与山药淀粉含量较高,且水分含量均较低;在细胞结构上,苹果细胞面积最大,桃细胞面积最小且排列密集,孔隙度较低,梨的细胞形态分布不均匀,马铃薯存在少量的大淀粉颗粒,细胞壁较厚,山药存在大量较小的淀粉颗粒,细胞壁较薄;在质地特性上,桃的硬度较低,马铃薯的硬度较高,青萝卜的硬度与弹性均较高。相关性分析表明,应力-松弛特性与部分质地特性呈极显著正相关(P<0.01),CEL含量与应力-松弛特性参数均呈极显著正相关(P<0.01),蔗糖、WSP含量与质地特性参数均呈极显著负相关(P<0.01);颗粒密度、孔隙度与部分应力-松弛、质地特性参数呈极显著正相关(P<0.01);细胞结构中,细胞壁厚度、细胞大小与部分质地特性参数呈正相关(P<0.05),主成分分析共提取到3个主成分,累计贡献率为90.3%,筛选出3个核心指标,即η、体积密度、CSP;在6种果蔬中,马铃薯与山药差异较小,二者间主要差异体现在细胞结构与细胞壁厚度上。

