乳山长牡蛎共附生可培养细菌的多样性和副溶血性弧菌拮抗菌的筛选
蒋之琛,刘明坤,3,王文岐,吴富村,3,李莉,3,张德超,3
(1.中国科学院海洋研究所,山东 青岛 266071;2.中国科学院大学,北京 100049;3.中国科学院海洋大科学中心,山东 青岛 266071;4.青岛农业大学海洋科学与工程学院,山东 青岛 266237)
长牡蛎(Crassostrea gigas)肉质富含蛋白质、牛磺酸和维生素及许多有利于人体健康的微量元素,具有极高的食用价值[1],是我国近岸沿海的重要海水养殖种类。威海乳山地区位于山东半岛的东南端,天然的地理环境优势使乳山成为我国北方主要牡蛎养殖区,年产量居全国首位[2],全产业链产值过百亿元,是乳山渔业经济的支柱产业,具有非常大的经济价值和开发潜力。
牡蛎属于滤食性双壳纲贝类,能滤食周围水体中直径低于50 μm 的几乎所有微粒,包括微生物和病毒,进食时大量海洋微生物进入牡蛎的滤食及消化器官[3]。牡蛎的胃和鳃含有丰富的共附生微生物,可作为几种双壳纲贝类幼虫变态的诱导剂[4]。共附生微生物还可以为双壳纲贝类宿主提供生长因子,如维生素和氨基酸,有助于食物消化;产生保护宿主免受病原体感染的抗菌剂[5]。很多双壳类软体动物在抵御致病细菌的同时,也会选择与某些细菌进行特异性互惠共生,在长久的共同演化中,牡蛎等双壳纲贝类与共附生细菌形成了复杂多样的种间关系[6]。
目前关于长牡蛎共附生微生物的研究较少,主要集中在养殖环境或养殖模式等因素对牡蛎的影响[7-9]。本文研究了乳山长牡蛎养殖区内长牡蛎胃部与鳃部可培养的共附生细菌多样性,同时筛选副溶血性弧菌(Vibrio parahemolyticus)拮抗菌,可为乳山牡蛎的生产管理及弧菌防治提供相关参考。
1 材料与方法
1.1 材料
1.1.1 样品采集
2020 年6 月7 日、7 月10 日、7 月30 日、8 月25 日和9 月25 日采集了山东省威海市乳山牡蛎养殖区的长牡蛎样品(每批次7~10 只),放入保温箱内冷藏运回实验室。用灭菌海水清洗外壳后,在超净台无菌条件下用灭菌刀具提取牡蛎胃和鳃。
1.1.2 培养基和主要试剂
R2A固体培养基:蛋白胨0.5 g/L,酵母粉0.5 g/L,葡萄糖0.5 g/L,淀粉0.5 g/L,K2HPO40.3 g/L,MgSO40.05 g/L,丙酮酸钠0.3 g/L,琼脂20 g/L。过滤海水配制,pH 7.0,高压蒸汽灭菌(115 ℃,30 min)。
2216E 固体培养基:蛋白胨5 g/L,酵母粉1 g/L,琼脂粉20 g/L,过滤海水配制,pH 7.6~7.8,高压蒸汽灭菌(121 ℃,20 min)。
M1 固体培养基:蛋白胨2 g/L,酵母粉1 g/L,淀粉10 g/L,琼脂20 g/L。过滤海水配制,pH 7.0,高压蒸汽灭菌(121 ℃,20 min)。
主要试剂:细菌基因组DNA 提取试剂盒及PCR 相关试剂购自天根生化科技(北京)有限公司。
1.1.3 指示菌及培养条件
供试指示菌副溶血性弧菌购自中国普通微生物菌种保藏管理中心,编号为CGMCC 1.1997。使用2216E 海水培养基25 ℃恒温培养。
1.2 方法
1.2.1 乳山长牡蛎共附生细菌的分离培养、鉴定和系统进化分析
将长牡蛎胃和鳃分别置于灭菌的玻璃匀浆器中,加入1 mL 无菌生理盐水磨成浆,用生理盐水进行10 倍系列梯度稀释,涂布在三种不同的固体培养基上,25 ℃倒置培养7 d,根据菌落形态、颜色等特征挑取不同单菌落,每个菌落至少纯化2 次。
采用细菌基因组DNA 提取试剂盒提取分离菌株的DNA,以27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1541R(5’-AAGGAGGTGATCCAGCCGCA-3’)为引物,PCR 扩增得到16S rRNA 基因。PCR 反应体系为40 μL,其中含1 μL 27F,1 μL 1541R,20 μL 2×Taq PCR Mastermix,16 μL ddH2O,2 μL 细 菌DNA模板。反应条件为:94 ℃预变性5 min 之后,94 ℃1 min,55℃1 min,72℃1.5 min,30 次循环,72 ℃延伸1.5 min,4 ℃保藏。PCR 产物送至北京擎科生物有限公司测序分析,经过与NCBI 数据库比对,明确细菌的分类地位。利用MEGA 软件采用邻接法构建系统进化树。
1.2.2 副溶血性弧菌拮抗菌的筛选
采用纸片扩散法[10]检测抗菌效果。胃鳃分离到的不同共附生细菌与副溶血性弧菌指示菌CGMCC 1.1997 的培养:分别从各自斜面接种到2216E 液体培养基中,摇床25 ℃,160 r/min 培养36 h。在超净工作台,吸取120 μL 副溶血性弧菌指示菌菌液,用一次性无菌涂布棒均匀涂在2216E 固体培养基平板,静置0.5 h。将滤纸片(灭菌烘干)浸入待测菌株发酵液,轻轻放在涂布弧菌指示菌的2216E 平板上,将浸入灭菌2216E 液体培养基中的滤纸片(灭菌烘干)放在同一个平板上作为空白对照。25 ℃下恒温培养,如果平板出现抑菌圈,而空白对照无抑菌圈,则表明待测菌株对副溶血性弧菌具有拮抗作用。
1.2.3 副溶血性弧菌拮抗菌与副溶血性弧菌发酵液的OD 值和对应活菌数预实验
将副溶血性弧菌拮抗菌和副溶血性弧菌CGMCC 1.1997 分别接种于25 mL 2216E 液体培养基,摇床25 ℃,160 r/min 培养24~36 h。选用600 nm 波长紫外可见分光光度计,以灭菌后未接种的2216E 培养基为空白对照,测定两者发酵液的OD 值,用平板计数法检测两者发酵液OD 值对应的活菌数。
1.2.4 副溶血性弧菌拮抗菌与副溶血性弧菌不同比例混合竞争培养
将副溶血性弧菌拮抗菌和副溶血性弧菌CGMCC 1.1997 分别接种于25 mL 2216E 液体培养基,摇床25 ℃,160 r/min 培养,测定两者发酵液的OD 值。根据预实验结果,将副溶血性弧菌拮抗菌和副溶血性弧菌CGMCC 1.1997 发酵液浓度调整为109CFU/mL。
将副溶血性弧菌拮抗菌和副溶血性弧菌CGMCC 1.1997 的两种发酵液分别按1∶1 和1∶10 体积比,加入对应的2216E 液体培养基中,以不加副溶血性弧菌拮抗菌为对照组,每组三个重复,振荡培养24 h 后,稀释涂布,计算副溶血性弧菌拮抗菌和副溶血性弧菌CGMCC 1.1997 浓度。
2 结果与分析
2.1 乳山长牡蛎共附生细菌的分离鉴定
从乳山5 次采集的长牡蛎样品中,共分离获得422 株共附生细菌,经过形态观察和16S rRNA 基因测序,剔除同批次重复菌株后共获得258 株细菌,筛选后得到119 种不同菌株的16S rRNA 基因序列(系统发育关系如图1),上传至NCBI GenBank数据库。其中,从长牡蛎鳃和胃分别分离到4 种和13 种弧菌,弧菌16S rRNA 基因序列登录号分别为MW559525~MW559528 和MW559496、MW559498、MW559499、MW559503、MW559504、MW559507、MW559509、MW559510、MW559514、MW559516、MW559518、MW559521、MW 559523;除弧菌外,长牡蛎鳃和胃分别分离获得54 种和71 种共附生细菌,16S rRNA 基因序列登录号分别为OP522051~OP522104 和OP521932~OP522002。

图1 长牡蛎胃和鳃共附生菌的系统发育树Fig.1 Neighbor-joining (NJ) phylogenetic tree of symbiotic bacteria isolated from stomach and gill of Pacific oyster Crassostrea gigas
2.1.1 长牡蛎鳃部共附生菌多样性分析
5 批次的乳山长牡蛎鳃部共分离共附生细菌89 株,囊括了5 个纲39 个属和58 个种,包括一个潜在新种ML-310。形态观察发现,菌落颜色以橘黄、米黄和白色为主,部分菌落呈现透明状或半透明状,一些菌落表面褶皱。有1 株噬琼胶假交替单胞菌(Pseudoalteromonas agarivorans)有降解琼脂的现象(图2);有2 株产黑假交替单胞菌(P.nigrifaciens)和水蛹假交替单胞菌(P.undina)可产生色素(图2)。
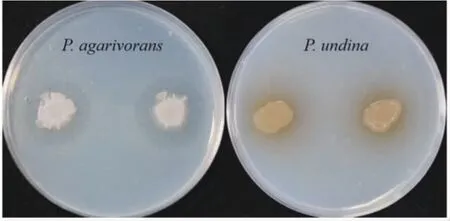
图2 部分菌株降解琼脂效果与产色素情况Fig.2 Agar degradation and pigment production for some strains
主要类群包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)4 大类群。变形菌门为主要共附生细菌类群,占比约60.7%,其余三种分别占比15.7%、20.2% 和3.4% 。其 中,γ-变形菌纲(Gammaproteobacteria)占比44%,为主要优势菌类群,其次为放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)、芽孢杆菌纲(Bacilli)和黄杆菌纲(Flavobacteriia)(图3-A)。属水平的多样性如图3-C 所示,其中塩屋埼假交替单胞菌(P.shioyasakiensis)、特基拉芽胞杆菌(Bacillus tequilensis)和藤黄微球菌(Micrococcus luteus)在3个批次以上的长牡蛎鳃部样品中都分离到,可能是乳山长牡蛎鳃部优势共生菌。长牡蛎鳃部共发现4株不同的弧菌(图1),分别为海滨弧菌(Vibrio litoralis)、波氏弧菌(V.pomeroyi)、塔斯曼尼亚弧菌(V.tasmaniensis)和巴西弧菌(V.brasiliensis)。

图3 长牡蛎可培养共附生细菌多样性Fig.3 Diversity of cultured symbiotic bacteria isolated from Pacific oyster Crassostrea gigas
2.1.2 长牡蛎胃部共附生细菌多样性分析
从5 批次的乳山长牡蛎胃部共分离共附生细菌169 株,囊括了6 个纲45 个属和84 种。形态观察发现,菌落以米黄、黄、橘色和白色为主,部分菌落呈透明或半透明状,一些菌落表面褶皱。有4 株细菌可以产生色素,4 株细菌有降解琼脂的现象(图2),分别为假交替单胞菌(P.hodoensis)、海滨噬琼胶菌(Agarivorans litoreus)、白色噬琼胶菌(A.albus)和河口噬琼胶菌(A.aestuarii)。胃部分离的共附生细菌主要类群包括变形菌门、厚壁菌门、放线菌门和拟杆菌门4 大类群。变形菌门为主要类群,占比约77.7%,其余三种分别占11.5%、7.2%和3.6%。γ-变形菌纲为主要优势类群,占63%(图3-B),属水平的多样性见图3-C。
共有4 批长牡蛎样品的胃部分离到13 种弧菌。新喀里多尼亚弧菌(V.neocaledonicus)、灿烂弧菌(V.splendidus)、巴西弧菌(V.brasiliensis)和V.cortegadensis 出现批次均在3 次及以上。系统发育关系及多样性分析结果表明,本研究分离培养方法获得的绝大部分弧菌均来自于长牡蛎的胃(图1),表明胃部分布的弧菌远多于鳃部。
2.2 副溶血性弧菌拮抗菌的筛选及混合竞争培养结果
纸片扩散法检测的119 株不同乳山长牡蛎胃鳃共附生细菌的抗弧菌效果发现,ML-231 杀鱼假交替单胞菌(P.piscicida)对副溶血性弧菌指示株有较强的拮抗作用(图4)。混合竞争培养后,杀鱼假交替单胞菌ML-231 能明显抑制副溶血性弧菌的生长(表1)。当杀鱼假交替单胞菌ML-231 和副溶血性弧菌按照1∶1 的浓度混合培养后,副溶血性弧菌的浓度由对照组的109CFU/mL 降至107CFU/mL,当菌株ML-231 和副溶血性弧菌按照10∶1 的浓度混合培养后,副溶血性弧菌的浓度由对照组的109CFU/mL 降至106CFU/mL。

表1 杀鱼假交替单胞菌ML-231 与副溶血性弧菌混合竞争培养Tab.1 Mixed culture of P.piscicida ML-231 and V.parahemolyticus
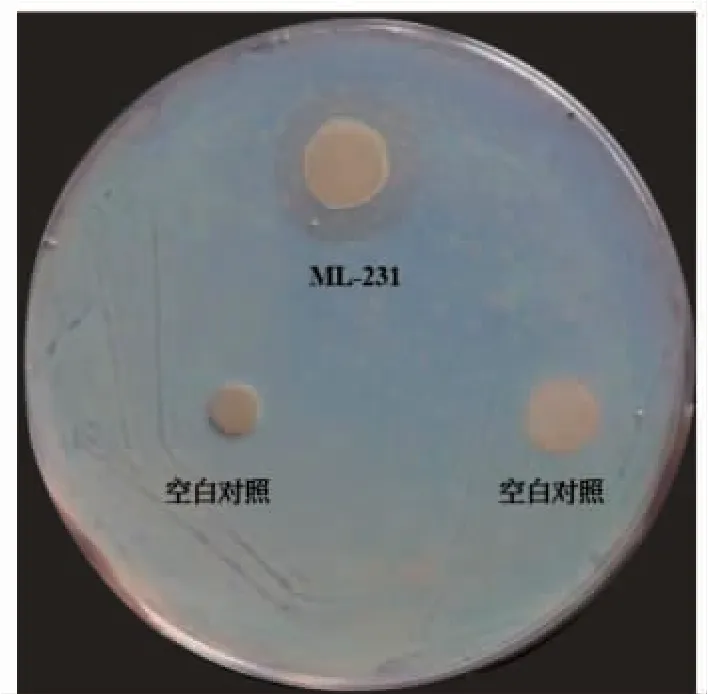
图4 杀鱼假交替单胞菌ML-231 对副溶血性弧菌的抑制圈Fig.4 Inhibition zones produced by P.piscicida ML-231 to V.parahemolyticus
3 讨论
3.1 乳山长牡蛎共附生细菌多样性
长牡蛎是世界上养殖量最大的经济贝类之一。长期高密度养殖及人为活动的严重污染等导致近海区域内养殖水域环境的恶化,使牡蛎等贝类对病原抵抗力下降,外界环境因子的变化和刺激同样使得牡蛎共附生微生物群落结构和丰度发生改变。本研究分离培养了乳山长牡蛎胃和鳃的共附生细菌,发现长牡蛎共附生细菌主要优势类群为变形菌门。Yu 等[11]采用16S rDNA 序列V3-V4 区高通量测序手段,分析广东省三个城市(广州、珠海和江门)水产市场的长牡蛎微生物群落结构,发现变形菌门为主要门。该门5 个最主要的属包括弧菌属和希瓦氏菌属(Shewanella),本研究均分离得到这2 个属的菌株。一般认为,希瓦氏菌是牡蛎冷藏运输中产生的腐败菌。本结果表明,希瓦氏菌存在于长牡蛎体内,可能更适应在低温环境下生长繁殖,而不是外部污染的杂菌。王焕南等[12]从日照海域野生牡蛎中分离得到62 株共生细菌,大部分为变形菌门的假交替单胞菌属,其余为弧菌属、芽孢菌属和交替单胞菌属等,与本研究分离结果相似。它们可能是普遍的牡蛎共附生细菌种类。
本研究中,长牡蛎胃部共附生细菌种类较鳃部更为丰富,可能与该时期摄食的藻类等浮游生物种类丰富有关,有23 种共附生细菌在牡蛎胃部与鳃部均有存在。从胃部分离到的3 种噬琼胶菌和1 种假交替单胞菌,具有降解琼脂的能力。这些菌株通过产琼胶酶降解琼脂多糖,可能有助于牡蛎消化吸收摄食的藻类。从胃中分离的菌株ML-310,同分离自中国南海石磺属无脊椎动物的海藻杆菌(Algibacter onchidii)16S rRNA 基因序列的相似性为94.9%[13],推测其为海藻杆菌属的一个新种。
近些年,我国和其他很多国家面临养殖牡蛎在夏季大规模死亡的问题,给相关养殖业带来沉重打击,因而调查牡蛎死亡的原因至关重要。弧菌作为长牡蛎养殖中的常见机会性致病细菌类群,分布区域广,海水温度升高更利于其生长繁殖与毒力因子表达,通常与夏季牡蛎的高死亡率有关[14]。本研究连续跟踪乳山牡蛎养殖区夏季高温期6—9 月份5个批次的长牡蛎样品,所分离到的弧菌主要分布在长牡蛎的胃部,加之鳃部,共分离到16 种弧菌,其中很多弧菌为已报道或潜在的牡蛎病原菌,可能导致牡蛎染病甚至死亡[15]。据报道,胃部出现频次较高的灿烂弧菌与影响全球范围内长牡蛎产量的夏季高死亡率有关[16],从遭受“夏季死亡综合症”的牡蛎中分离出的灿烂弧菌GP32,注射到双壳类动物时显示出高致病性并导致死亡[17]。高晓建等[18]发现,哈维氏弧菌(V.harveyi)是引起连云港养殖长牡蛎大规模死亡的主要病因。Wang 等[19]报道了中国北方长牡蛎夏季高温期死亡的主要致病菌有巴西弧菌、维氏弧菌、灿烂弧菌和欧文弧菌(V.owensii)等。上述弧菌均在本研究中分离得到,其中巴西弧菌在胃和鳃均分离得到。胃分离的其他弧菌,如新喀里多尼亚弧菌(V.neocaledonicus)、沙氏弧菌(V.chagasii)和施罗氏弧菌(V.shilonii)均为水产养殖动物常见致病菌[20,21],是长牡蛎生长过程中的潜在威胁。鳃部分离的弧菌有塔斯曼尼亚弧菌(V.tasmaniensis)能作为牡蛎血细胞的兼性细胞内病原体,在牡蛎幼虫死亡事件中有报道[22]。
3.2 副溶血性弧菌拮抗菌
副溶血性弧菌是贝壳常见的主要致病菌,尽管本文在长牡蛎样品中没有分离到这种致病菌,但从牡蛎的胃中分离的一株杀鱼假交替单胞菌ML-231对副溶血性弧菌有很强的抑制作用。ML-231 与副溶血性弧菌不同比例混合竞争培养时,能有效抑制副溶血性弧菌的生长繁殖,推测杀鱼假交替单胞菌ML-231 可能通过分泌胞外代谢产物,并利用营养竞争作用,抑制副溶血性弧菌的生长。有研究发现,假交替单胞菌某些类群对弧菌具有良好的拮抗作用[23]。王枫林等[24]报道了一株杀鱼假交替单胞菌2515 对鳗弧菌(V.anguillarum)和副溶血性弧菌有拮抗作用。本研究的ML-231 为长牡蛎弧菌病生物防控提供了菌种资源。
3.3 结论
本研究通过分离培养的方法,分析了高温期乳山长牡蛎胃和鳃可培养共附生细菌多样性。分离菌株主要为变形菌门、厚壁菌门、放线菌门和拟杆菌门4 个类群,囊括了6 个纲,63 个属,119 个种;长牡蛎胃部共附生细菌多样性高于鳃部,共分离到16种弧菌。多种弧菌为已报道或潜在的牡蛎病原性细菌,可能与夏季长牡蛎的高死亡率有关;筛选出1株副溶血性弧菌拮抗菌,可对于今后乳山长牡蛎的生产管理及弧菌防治提供一定的参考意见。

