碳酸盐碱度胁迫对乌苏里白鲑幼鱼生长、抗氧化能力和生长基因表达的影响
刘雪峰,黄天晴,刘恩慧,徐革锋,史秀兰,董福霖,李文文,纪凯,谷伟,潘玉财,王炳谦
(1.哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150025;2.中国水产科学研究院黑龙江水产研究所,农业农村部淡水水产生物技术与遗传育种重点实验室,黑龙江 哈尔滨 150070)
中国约有3.067×107hm2的盐碱水域,主要分布在东北、华北、西北等地区。在这些水域中,碱度一直是影响鱼类生长性能的重要因素[1]。高碳酸盐碱度会干扰鱼体渗透调节和生理稳态,仅有少部分种类的鱼可以正常生存,生物多样性显著降低[2,3]。同时,全球气候变暖等因素,内陆区域很多湖泊的水质盐碱化不断加重,可利用的淡水资源在不断减少,这给水产养殖和渔业发展带来了巨大的冲击[4]。为了提高对盐碱水的利用效率,采用“以渔改碱”的方法,尝试在中低浓度的碱水中养殖鲤(Cyprinus carpio)、鲢(Hypophthalmichthys molitrix)等一些抗逆性较强的鱼类,但仅限于在碱度小于10 mmol/L的水域[5]。为了能在中高碱度水域养殖鱼类,近几年,探究了鱼体在适应碱胁迫过程中产生的生理生化反应、以及耐碱基因的表达等方面,并努力收集种质资源,积极培育耐高碱度的鱼类优良品种,以充分利用碱性水域资源,提高物种多样性[6-9]。
生长性能是鱼类水产养殖过程中的关键性状,其中胰岛素样生长因子-I(Insulin-like growth factor-1,IGF-1)和生长激素(Growth hormone,GH)为调控生长作用的关键基因[10]。IGF-1 主要在肝脏中表达,具有加速细胞生长、促进细胞分裂分化以及减缓细胞衰亡等多种作用[11];GH 主要在脑垂体前叶中表达。其表达水平还可以影响大麻哈鱼(Oncorhynchus keta)在海水中的渗透压调节[12]。IGF-1的合成依赖于垂体GH 的分泌状况[11]。沈立等[13,14]在碱度胁迫异育银鲫(Carassius auratus gibelio)的过程中发现,IGF-1 和GH 表达量均升高;Shepherd等的实验也得到相同的结论。这表明IGF-1/GH 生长因子的表达水平,会影响鱼体在压力环境中的生长性能。除此以外,王卓等[15]的研究表明,长期的碱度压力环境还会引发过量活性氧的氧化损伤。柳飞等发现,鱼体可通过超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH)等来清除过量的活性氧。丙二醛(malondialdehyde,MDA)水平能体现脂质过氧化程度,同时也可反映鱼体损伤情况[16,17]。因此,在对鱼类慢性胁迫实验中加入对IGF-1/GH 表达和抗氧化酶活性的探究,可能是探究该鱼种抗逆性能较为合适的方法。
乌苏里白鲑(Coregonus ussuriensis Berg)是一种具有较高营养价值和经济价值的冷水性鱼类,主要分布于中国黑龙江流域及俄罗斯西伯利亚、萨哈林等水域[18]。近几十年来,由于过度捕捞、生存环境恶化以及水利水电工程建设,乌苏里白鲑的生存空间受到持续挤压,其资源量呈显著下降,目前已被列入《中国濒危动物红皮书鱼类》名录[19]。本研究通过分析乌苏里白鲑慢性碱胁迫的生长性能和抗氧化酶活性变化,及生长相关基因表达量的变化,以期为探究乌苏里白鲑在中低盐碱环境中的适应能力奠定基础,也为乌苏里白鲑生境的扩大、保护增产以及提高碱水域中物种多样性等提供参考。
1 材料与方法
1.1 材料
实验用乌苏里白鲑来自黑龙江水产研究所渤海冷水性鱼类试验站。正式实验前在循环控温玻璃水族箱中淡水暂养两周。水温18 ℃,水中溶氧量8.0 mg/L,氨氮含量小于0.2 mg/L,pH 为7.5±0.2,亚硝酸盐含量<0.001 mg/L。选择150 尾初始平均体质量(60.43±2.45)g,平均体长(17.19±1.50)cm的健康乌苏里白鲑进行实验。实验时除了碳酸盐碱度不同外,温度、溶氧量和pH 等水质条件均保持不变。
1.2 方法
实验在180 cm×60 cm×47 cm 的循环控温水族箱中进行,水中碳酸氢钠碱度分别为0 mmol/L(对照组)、5 mmol/L、10 mmol/L、20 mmol/L 和30 mmol/L(碱度组),每个缸分成三个平行组(每个平行n=10),每个碱度组30 尾鱼,逐步升碱,最后一天各组均达到预计碱度后投喂。pH 控制在8.5 左右[2],生长实验42 d。每日上午9:00 和下午4:00 饱时投喂两次,投喂量为体质量的2%~4%。捞出残饵晒干称重,每日记录摄食量,根据摄入量调整日投喂量。每3 d 换水1/3,换水前后测定碱度,保持碱度不变。
每7 d 测量鱼体长和体质量,精确至小数点后两位,直至实验结束。最后一次采样前鱼禁食24 h,每个平行组取3 尾,每个碱度组取9 尾,用MS-222(200 mg/L)麻醉、测量鱼体长和体质量,解剖取脑和肝脏样品迅速放在液氮中,-80 ℃储存。
用下列公式计算不同碳酸盐碱度下胁迫6 周的乌苏里白鲑的生长性能:平均日增重(ADG)、增重率(WGR)、饲料系数(FCR),及特定生长率(SGR)。
其中,W1和W2分别为每组鱼的平均初始体质量和最终体质量(g);T 为实验时间(d);Wf为实验期间的平均每尾鱼的食物摄入量(g)。
酶活力测定:每组随机取3 尾鱼的肝组织用冰冷生理盐水冲洗后称量0.1 g,加入9 倍体积的冷生理盐水(7.5 g/kg 氯化钠,pH=7.0),高通量研磨仪制成匀浆。在4 ℃、3 000 r/min 下离心10 min,取上清测定抗氧化酶GSH、CAT 和SOD 活性及MDA 浓度,最终取三次重复测定值的平均值,具体步骤参照试南京建成生物科技有限公司剂盒说明书进行。
总RNA 提取、cDNA 合成、荧光定量PCR:每个碱度组取三尾鱼的脑和肝脏组织各0.4 g。根据说明书使用RNA 试剂盒(美国康宁,AP-MN-MS-RNA-250)提取,再用分光光度计检测吸光度(比率260/280 和260/230)确定RNA 的质量;用1%琼脂糖凝胶电泳检测RNA 完整性。按说明书将合格的RNA通过TaKaRa 公司的PrimeScript RT 试剂盒进行反转录,加入500 ng 的Total RNA 和2 μL 5×Prime-Script RT Master Mix 混匀后进行反转录:37 ℃,15 min;85 ℃,5 s;4 ℃,1 min。用Prime Premier5.0 设计引物,IGF-1、GH 引物序列如表1 所示。用β-actin作为内参,RT-qPCR 反应体系为2×S6 Universal SYBR qPCR mix 5 μL,上下游引物各0.2 μL,cDNA 1 μL,ddH2O 3.6 μL。PCR 反应条件如下:95 ℃,30 s,40 个循环(95 ℃,5 s;60 ℃,34 s),最后95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。荧光定量PCR 反应结果使用2-ΔΔCT方法进行数据分析。

表1 qRT-PCR 所用的引物及序列Tab.1 Primers and sequences for quantitative RT-PCR
1.3 统计分析
图中所有数据均表示为平均值±标准偏差(SD)。采用SPSS 19.0 软件进行方差同质性检验实验数据,然后进行单向方差分析;使用邓肯检验的多重比较来确定组间显著差异,P<0.05 时表示差异显著;使用GraphPad Prism 8.0 软件绘图。
2 结果与分析
2.1 碳酸氢钠碱度胁迫对乌苏里白鲑存活和生长的影响
5 mmol/L和10 mmol/L碳酸氢钠碱度下,乌苏里白鲑的终末体质量分别比对照组高5.4%(P<0.05)和10.3%(P<0.05),而20 mmol/L、30 mmol/L两组仅为对照组的91.5%(P<0.05)和88.9%(P<0.05)(图1)。各碱度组体质量增长速度由高到低依次为:10 mmol/L、5 mmol/L、20 mmol/L、30 mmol/L。各组乌苏里白鲑的生长性能见表2。5 mmol/L、10 mmol/L碱度组乌苏里白鲑摄食总量显著高于对照组(P<0.05),20 mmol/L、30 mmol/L组中摄食总量与对照组无显著差异(P>0.05)。淡水对照组幼鱼的增长速度介于5 mmol/L和20 mmol/L组之间,10 mmol/L碱度组中ADG、SGR 和WGR 最高(P<0.05)。当碱度大于20 mmol/L时,生长性能开始降低,30 mmol/L组最低(P<0.05),而饲料系数最高,是对照组的1.23 倍,20 mmol/L组的饲转率与对照组无显著差异(P>0.05)。

图1 不同碱度的NaHCO3 对乌苏里白鲑体质量增长的影响Fig.1 Effect of different NaHCO3 alkalinities on body weight of juvenile Usscuri whitefish C.ussuriensis
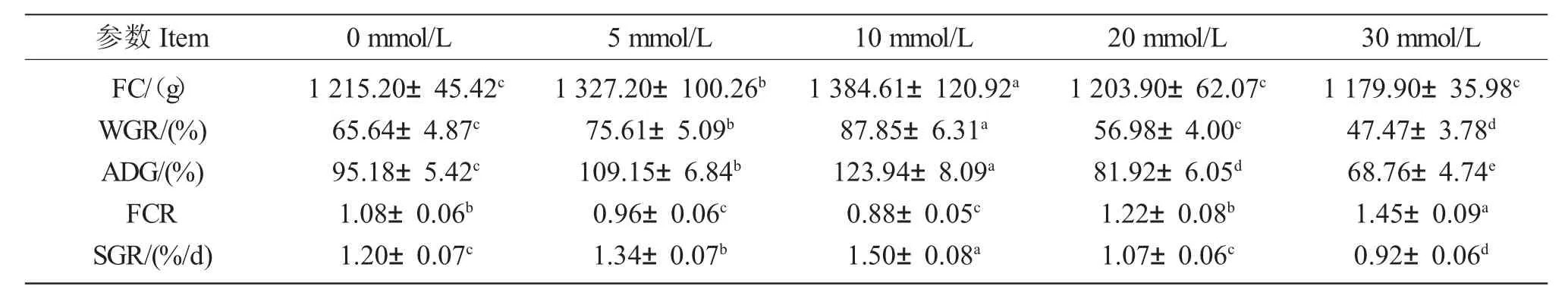
表2 不同碱度处理组乌苏里白鲑生长性能及饲料系数Tab.2 Growth performance and feed utilization of Usscuri whitefish C.ussuriensis exposed to different alkalinity levels
2.2 碳酸氢钠碱度胁迫对乌苏里白鲑抗氧化酶与丙二醛活性的影响
5 mmol/L组乌苏里白鲑肝脏中SOD、GSH 和CAT活性与MDA 活性与对照组无显著差异(P>0.05);10 mmol/L 组中SOD 酶活性比对照组高16%(P<0.05),CAT、GSH、MDA 三种酶与对照组无显著差异(P>0.05);20 mmol/L组中SOD、CAT、MDA 的酶活性显著升高(P<0.05),30 mmol/L组中SOD、CAT酶活性和MDA 含量达峰值(P<0.05)。GSH 活性最高的处理组为20 mmol/L,30 mmol/L次之(P<0.05)(图2)。
2.3 碳酸氢钠碱度胁迫对乌苏里白鲑IGF-1 和GH 基因表达的影响
5 mmol/L组乌苏里白鲑肝组织中IGF-1 mRNA表达水平与对照组无显著差异(P>0.05),垂体中的GH 表达水平是对照组的2.26 倍(P<0.05);在10 mmol/L组中,IGF-1 和GH 的表达量达最大值(P<0.05)。从20 mmol/L组起,表达量随碱度增加而降低,20 mmol/L组中IGF-1 的表达量仅为对照组的41%(P<0.05),GH基因表达量则降低至对照组的50%(P<0.05)。30 mmol/L组两种基因的表达量最低(P<0.05,图3)。

图3 不同NaHCO3 碱度组乌苏里白鲑肝脏中IGF-1 和垂体中GH 基因表达水平的变化Fig.3 Changes in IGF-1 expression in the liver and GH expression in the pituitary of Usscuri whitefish C.ussuriensis exposed to different levels of NaHCO3 alkalinity
3 讨论
碱度显著影响鱼类的生长、生理过程和相关基因的表达[20,21]。本实验发现,暴露于低NaHCO3碱度(5 mmol/L、10 mmol/L)中的乌苏里白鲑生长性能(ADG、SGR、FCR、WGR)显著高于对照组和高NaHCO3碱度(20 mmol/L、30 mmol/L)组。在30 d 的生长实验中,卡拉白鱼(Alburnus chalcoides)在7 mmol/L 中的增重率和增长率最高[22];4 mmol/L的碱度可以提高异育银鲫(Carassius auratus gibelio)的生长率[23]。根据前期池塘养殖经验,乌苏里白鲑在体质量达200 g 之前,生长速度受温度影响较大,北方池塘中水温变化幅度大,生长速率较低,6 周的生长速率仅为40.0%左右。本研究中,水温为乌苏里白鲑最适生长温度18 ℃,各组鱼的生长速率显著高于池塘。20 mmol/L、30 mmol/L两组摄食总量与对照组无显著差异,生长性能较低的原因并非高碱度使乌苏里白鲑食欲降低所致,可能是从饲料中吸收的能量转化为体质量的部分减少。伍德等将生长性能下降归因于渗透压调节对能量的要求,整个生长阶段需要大量能量来适应压力条件[24,25]。为适应高渗环境,鱼类需要进行大量生理活动,这会影响新陈代谢和生长活动,导致生长性能降低甚至死亡[26]。总之,碱度对乌苏里白鲑的影响具有剂量效应,碱度过高会抑制其生长性能。
活性氧(ROS)是氧代谢的副产物,压力条件会导致鱼体活性氧急剧升高[26]。过量的ROS 能氧化损伤细胞和组织,生物激活抗氧化防御系统,以防止过量的活性氧对身体的氧化损伤[27,28]。GSH、SOD 和CAT 等抗氧化酶可以去除活性氧,增强机体防御能力[30]。在急性碳酸盐碱度胁迫下,白虾(Echinocereus bonkerae)的抗氧化酶系统可以被激活以适应外部环境[31];在赵岩等的碱度胁迫研究中发现,当罗非鱼(Oreochromis mossambicus)的抗氧化系统受损时,胁迫后组织细胞会产生氧化损伤[27]。在本研究中,20 mmol/L和30 mmol/L组乌苏里白鲑肝组织三种抗氧化酶均显著上升(P<0.05),说明高碱性时机体的抗氧化酶系统会及时消除过量活性氧,保护机体不受氧化损伤。肝组织中三种抗氧化酶的活性变化趋近相似,这说明在乌苏里白鲑体内抗氧化酶在应对碱度胁迫时相互协调共同作用,这与碱度胁迫下的中华绒螯蟹(Eriocheir sinensis)抗氧化酶活性研究结果相似[32]。而5 mmol/L、10 mmol/L两组抗氧化酶活性与对照无差异,均维持在一个正常范围内,说明乌苏里白鲑能适应中低碱度的水中产生的少量活性氧,这与张琴星等的研究结论一致[33]。
活性氧的积累会导致脂质过氧化的产物MDA含量升高[34]。范泽等在碳酸盐碱胁迫松浦鲤(Cyprinus carpio Songpu)的实验中发现,高碱度组中鲤肝组织中MDA 含量显著升高[34]。本研究中,30 mmol/L碱度组乌苏里白鲑肝组织中MDA 含量达到峰值,说明在该碱度下,乌苏里白鲑肝组织中抗氧化酶活力升高不足以缓解该鱼体内的氧化损伤。5 mmol/L、10 mmol/L碱度组下,该鱼肝脏中未见MDA活性升高,这表明低碱度不会引起鱼体内脂质过氧化现象。
IGF-1/GH 生长轴基因在不同环境中表达量差异可能是生长相关的重要生物标志物[35]。从垂体释放的GH 通过门静脉血液循环并与肝脏GH 受体结合,刺激IGF-1 的合成和释放,最后IGF-1 以负反馈作用于垂体[36]。尽管越来越多的研究支持IGF-1/GH系统在调节鱼类生长中的作用,但对其在碱水环境中的表达水平研究十分有限。IGF-1/GH 系统在渗透压变化过程中维持鱼类生理平衡方面发挥关键作用[37]。毕保良等实验发现,虹鳟(Oncorhynchus mykiss)在半咸水中GH 表达水平最高[38];沈立等在6 d 的碱度胁迫实验中发现,异育银鲫IGF-1 和GH激素水平均显著高于对照组[20],这与本研究的结果相一致。在本研究中,5 mmol/L和10 mmol/L组中乌苏里白鲑的IGF-1/GH 两种基因均显著上调(P<0.05)。这表明IGF-1/GH 生长轴可以通过参与乌苏里白鲑的渗透压调节机制帮助其适应中低碱水环境而表现出更好的生长性能。
当鱼类处于高渗环境中时,会影响GH 水平和食物摄入及生长[38]。在本研究中,相比于对照组,20 mmol/L和30 mmol/L组中,GH 的表达量和生长性能均显著降低,可能是生长因子在较高碱度下的合成受到抑制,这与迪恩等[39]的研究结论相同。除了加速鱼体生长之外,IGF-1 的表达量还可以影响鲑适应海水环境的能力[40],在20 mmol/L、30 mmol/L两组乌苏里白鲑中观察到IGF-1 表达量显著下降(P<0.05),这说明碱度过高,乌苏里白鲑肝组织中IGF-1 表达受到抑制,持续维持在较低水平,影响鱼生长。本研究结果表明,在较高的碱度中,乌苏里白鲑IGF-1/GH 系统受到抑制,影响其生长,这为长期碱度生长实验结论提供了参考。
综上所述,较高的碱度环境使乌苏里白鲑增加肝脏中GSH、SOD 和CAT 三种抗氧化酶活性来消除细胞中的活性氧,并通过抑制其垂体中GH 的表达以及肝脏中IGF-1 的表达而降低生长性能。乌苏里白鲑在10 mmol/L的低碱度环境中生长较好,与对照组相比具有更高的增重率及更低的饲料系数。尽管在30 mmol/L碱度环境中MDA 含量显著升高,不利于乌苏里白鲑生长,但并不影响其生存。本研究为探究乌苏里白鲑适应碱性环境的生理机制提供了基础理论依据,有助于制定在碱度环境中养殖的策略,对这一物种资源量的恢复以及中低碱度水域开发利用具有参考价值。
——乌苏里白鲑

