河川沙塘鳢病原杀鲑气单胞菌致病性及感染后宿主免疫相关基因差异表达分析
李 杰,刘国兴,2,钱且奇,朱玉洁,陈 圳,姜 群,王 骏,张晓君,高晓建
(1.扬州大学动物科学与技术学院 ,江苏扬州 225009;2.江苏省淡水水产研究所,南京 210017)
河川沙塘鳢(Odontobutispotamophila)属于鲈形目(Perciformes)鰕鯱鱼亚目沙塘鳢科(Odontobutidae)沙塘鳢属(Odontobutis),常见于我国长江中下游、钱塘江、闽江等[1-2],该品种味道鲜美、营养丰富,深受广大消费者的欢迎,已成为我国水产业极具发展潜力的特色养殖品种。自2009年河川沙塘鳢开始规模化繁育以来,其人工养殖规模不断扩大,已在多个省市的养殖区开展了混养和套养[3]。但是随着养殖规模的扩大以及水环境的恶化,河川沙塘鳢病害问题也逐渐严重,制约着其产业的健康发展。目前已报道的河川沙塘鳢病原有维氏气单胞菌(Aeromonasveronii)[4]、嗜水气单胞菌(A.hydrophila)[5]、溶血性苏云金芽孢杆菌(Bacillusthuringiensis)[6]、两性绵霉(Achlyabisexualis)[7]等。
2021年3月江苏常熟市某养殖场河川沙塘鳢出现大规模死亡现象,发病水温为12~15 ℃,其主要症状为体表不同程度的溃疡,并且鳍条充血、出血。本研究从濒死的河川沙塘鳢分离到优势生长细菌,命名为G2-4-1,经理化特性和分子特征确定其为杀鲑气单胞菌(A.salmonicida)。通过对分离菌人工感染健康的河川沙塘鳢和组织病理分析以确定其致病性,并对其进行了致病菌毒力因子检测、耐药性检测以及感染后宿主免疫相关基因表达变化分析,探寻河川沙塘鳢对杀鲑气单胞菌感染的免疫应答规律,为进一步研究河川沙塘鳢细菌性疾病防控奠定了前期基础。
1 材料与方法
1.1 病原菌分离
患病河川沙塘鳢(60±5)g采自江苏常熟市河川沙塘鳢养殖场,将濒死的河川沙塘鳢用75%的酒精体表消毒后,无菌条件取肝脏、肾脏及脾脏组织,并划线接种至普通营养琼脂平板,20 ℃培养24~48 h,挑取单个优势菌落进行纯化培养,并将纯化后的菌液加入等体积的20%(V/V)甘油,-80 ℃保存备用。
1.2 人工感染试验
将分离菌G2-4-1接种于普通营养肉汤中,20 ℃培养36 h制成菌悬液,并用生理盐水进行梯度稀释至1.8×108、1.8×107、1.8×106、1.8×105、1.8×104CFU/mL。将健康的河川沙塘鳢[(15±1.5)g]暂养一周后,随机分为5个感染组和1个对照组,感染组每组15尾鱼,分别腹腔注射0.1 mL的不同浓度的菌液,对照组按照同样方式注射等量无菌生理盐水。感染试验期间,水温18~20 ℃,溶氧5.0 mg/L以上。连续观察7 d,记录河川沙塘鳢发病与死亡情况,同时将死亡的河川沙塘鳢重新分离细菌并鉴定,半数致死浓度(LD50)计算参考张庆萍等[8]方法进行。
1.3 组织病理观察
取对照组和G2-4-1菌株感染组河川沙塘鳢的肝脏、鳃、脾脏和肾脏组织于Bouin’s液固定24 h后,用70%酒精保存。将固定的样品经脱水、透明、打蜡、石蜡包埋后,用切片机切片(3~6 μm),然后苏木精-伊红(HE)染色,中性树脂胶密封后于光学显微镜观察拍照。
1.4 分离菌形态观察和理化特性测定
取分离菌G2-4-1进行革兰氏染色,同时将分离菌G2-4-1滴于经聚醋酸甲基乙烯脂膜包被的铜网上并静置1 min,用0.5%磷钨酸水溶液负染1 min,最后自然干燥后利用Tecnai 12透射电子显微镜进行观察。另外将分离菌G2-4-1接种于微量生化管测定精氨酸水解酶、赖氨酸脱羧酶、纤维二糖、麦芽糖等理化指标,并对照《Bergey’s Manual of Systematic Bacteriology》[9]对分离菌进行种属判定。
1.5 gyrB序列测定与系统发育学分析
采用煮沸法提取分离菌的DNA作为模板,对菌株gyrB基因进行扩增。PCR反应条件为:94 ℃预变性 3 min;94 ℃变性30 s,56 ℃复性 30 s,72 ℃延伸90 s,循环30次;72 ℃延伸10 min。PCR产物由南京擎科生物有限公司进行序列测定。应用NCBI 中BLAST对测得的基因序列进行比对,选择相关序列,利用 ClustaW进行同源性比对,通过 Mega4 软件中邻接法构建系统发育进化树。
1.6 毒力基因检测
选择气单胞菌的气溶素(aer)、溶血素(hly)、封闭带毒素(zot)、DNA酶(exu)、丝氨酸蛋白酶(ser)、磷脂酶(lip)、S层蛋白(sp)、热不稳定性细胞兴奋性肠毒素(alt)和细胞毒性肠毒素(act)共9个毒力相关基因,采用Primer 5.0软件设计特异性引物,由南京擎科生物有限公司合成(表1),进行PCR扩增;PCR反应体系:2 × EasyTaq PCR SuperMix 12.5 μL,引物各0.5 μL,DNA模版1 μL,最后加ddH2O至25 μL,并以ddH2O替代DNA模板作为空白对照;扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,循环35次;最后72 ℃延伸5 min。1.0 %琼脂糖凝胶电泳进行检测,以扩增片段的有无及大小判断相应毒力基因的存在情况。

表1 杀鲑气单胞菌毒力基因引物序列Tab.1 Primer sequences of virulence genes of A.salmonicida
1.7 分离菌G2-4-1胞外酶与溶血素的测定
参考周丽颖等[10]采用平板法测定分离菌G2-4-1的蛋白酶、明胶酶、脂酶、卵磷脂酶、淀粉酶、DNA酶以及溶血素活性。
1.8 耐药性分析
采用纸片扩散法(K-B)对分离菌G2-4-1进行药物敏感性测定,将分离菌G2-4-1的浓度调整至1.5 × 108CFU/mL,吸取100 μL菌液涂布于营养琼脂平板,将药敏纸片(杭州天和微生物试剂有限公司产品)贴于平板上,28 ℃中培养24 h后测量抑菌圈直径(mm)。根据杭州天和微生物试剂有限公司产品说明书:抑菌圈直径大于等于17(mm)为敏感,抑菌圈直径大于等于14(mm)小于17(mm)为中介,抑菌圈直径小于14(mm)为抗性,根据抑菌圈直径判定分离菌G2-4-1的耐药性。
1.9 河川沙塘鳢感染杀鲑气单胞菌后免疫相关基因的表达分析
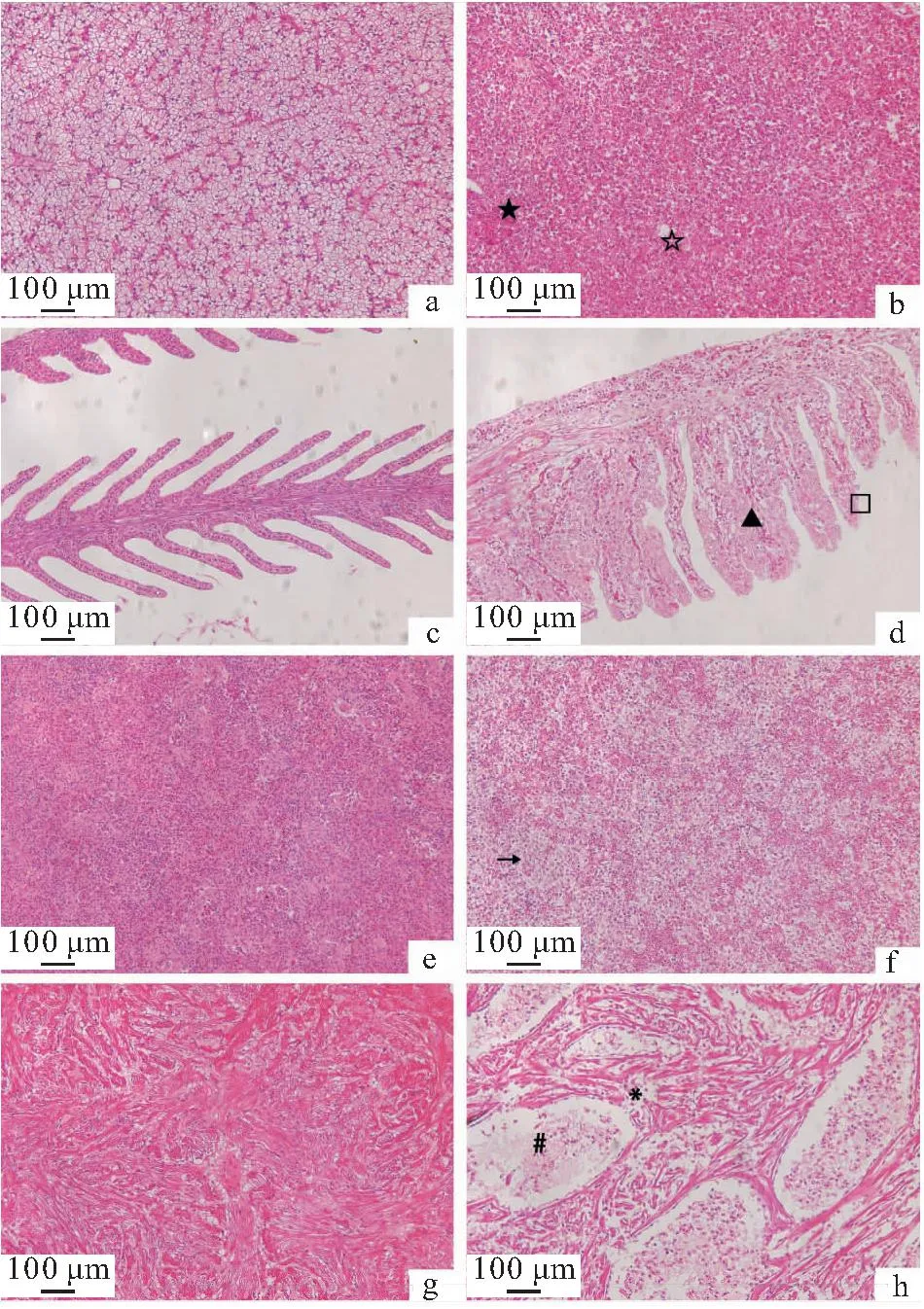
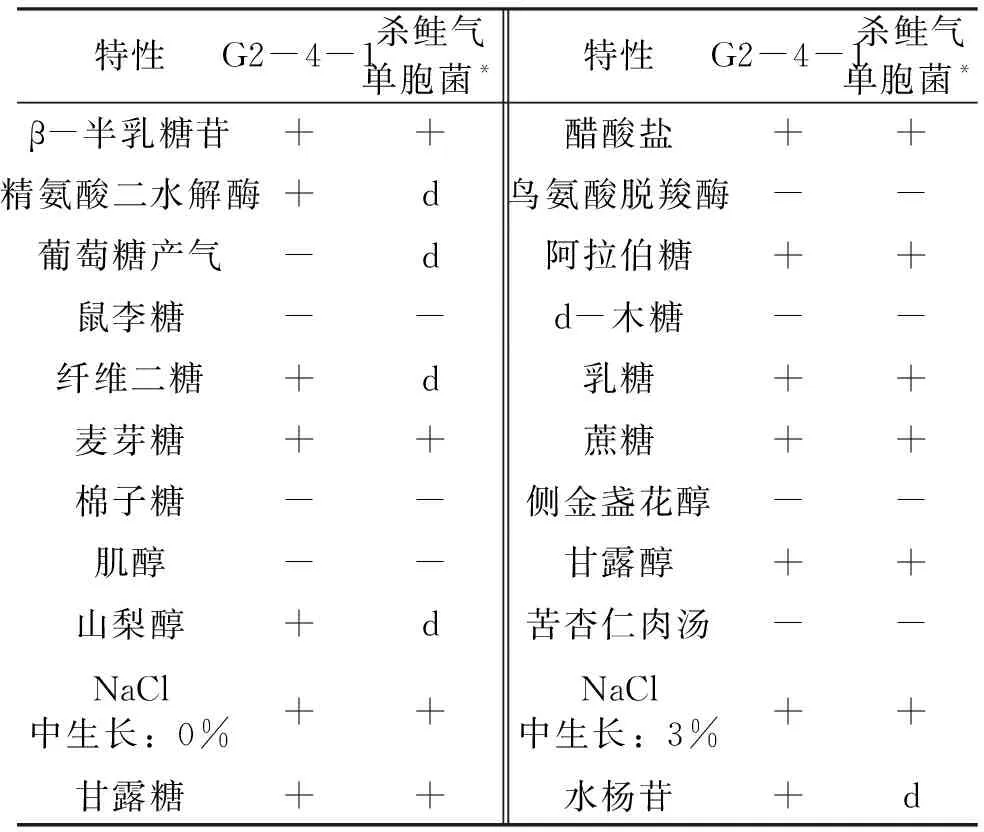
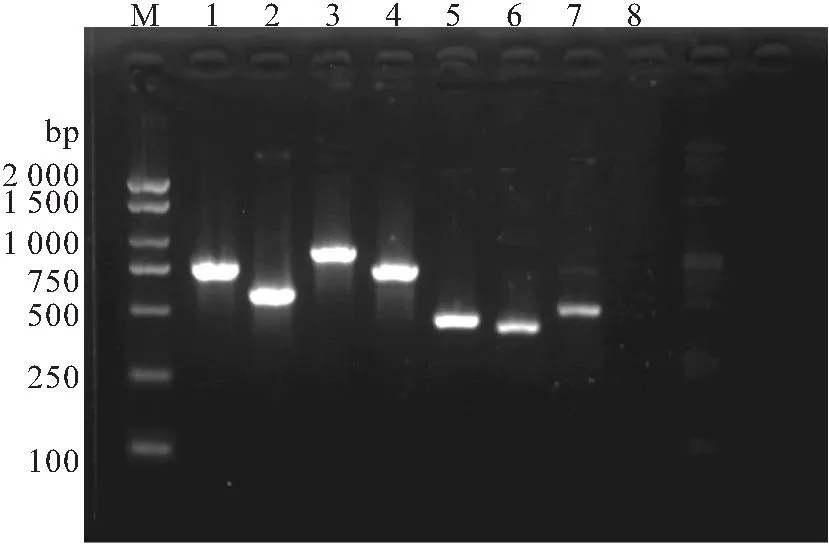
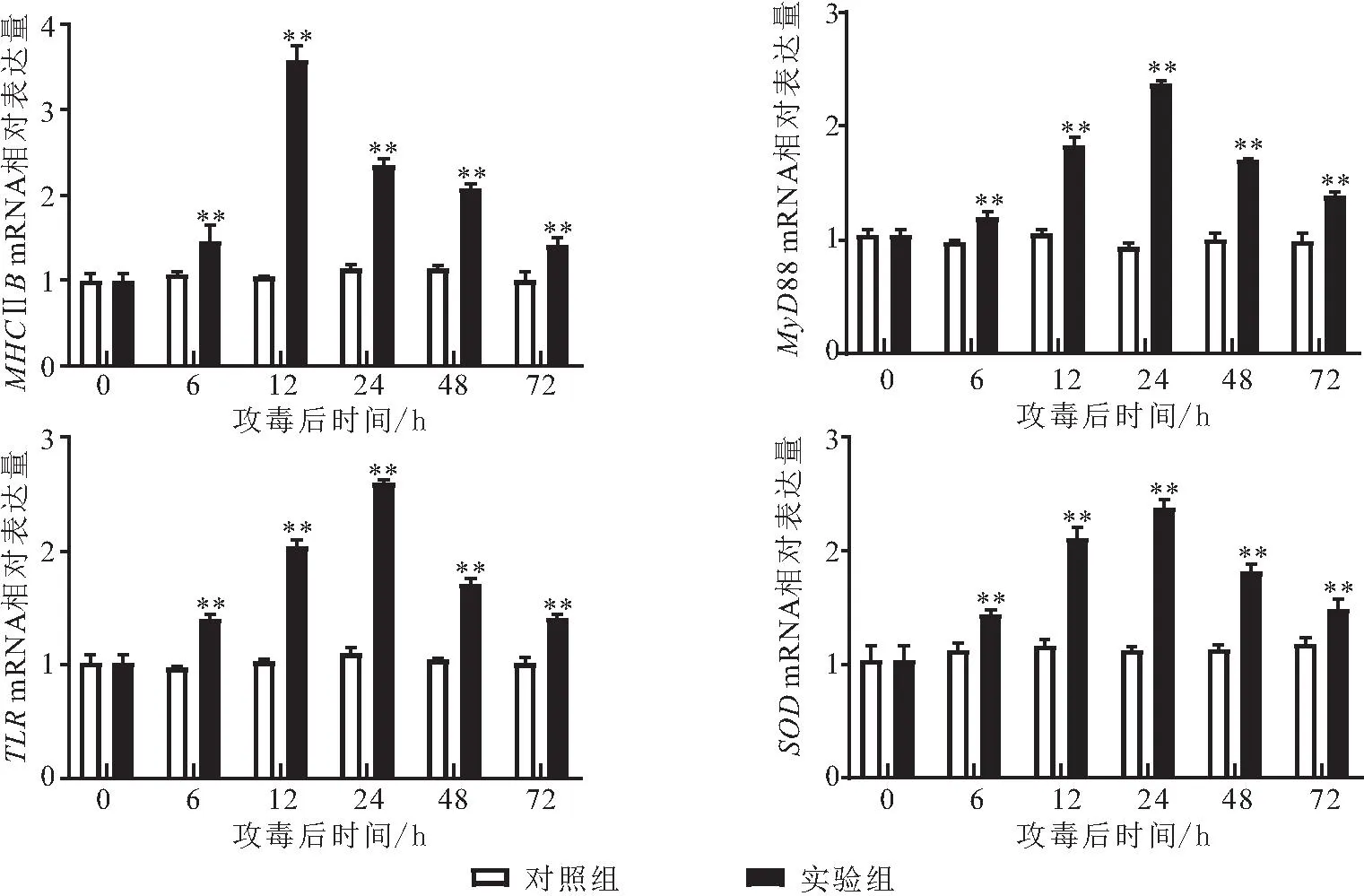
将健康的河川沙塘鳢分为感染组和对照组,每组50尾,实验组每尾鱼腹腔注射100 μL杀鲑气单胞菌菌液,浓度为1.8×105CFU/mL。对照组按同样的方式和剂量注射无菌生理盐水,在注射6、12、24、48和72 h后,分别取实验组与对照组的鳃、脾脏和肾脏组织,利用Trizol法提取RNA,并将RNA反转录为cDNA;qRT-PCR在实时荧光定量PCR仪进行,采用ChamQ Universal SYBR qPCR Master Mix试剂盒;本实验以β-actin为内参基因,免疫相关引物信息见表2,并通过解离曲线分析确定引物特异性,每个样品重复3次,用2-ΔΔCt法计算基因的相对表达量,所得数据以平均值±标准差(x±SD)表示,用SPSS 17.0软件进行单因素方差分析(One-way ANOVA),0.01 表2 荧光定量PCR相关引物序列Tab.2 Fluorescence quantitative PCR related primer sequence 患病河川沙塘鳢表现为体表严重溃疡,体表严重溃烂,泄殖孔红肿、溃疡,解剖发现肝脏严重出血。从肝脏分离获得的优势菌株G2-4-1为革兰氏阴性短杆菌,在琼脂培养基上菌落圆形、边缘整齐、中间凸起、白色不透明、表面湿润、直径为1~2 mm;经负染色后,透射电子显微镜下观察菌株G2-4-1呈杆状,两端钝圆,无芽孢,单鞭毛(图1),大小多为0.5~1.0 μm。 图1 自然感染河川沙塘鳢的发病症状及分离菌形态特征Fig.1 Clinical signs of naturally infected A.salmonicense and colony morphologies of the isolatea.背部溃疡的河川沙塘鳢(△),b.泄殖孔红肿、溃疡(★),c.肝脏严重出血(□),d.分离菌G2-4-1革兰氏染色 e.优势菌株G2-4-1在营养琼脂上的菌落形态,f.分离菌G2-4-1电镜照片 分离菌G2-4-1腹腔注射感染健康的河川沙塘鳢数小时后,河川沙塘鳢出现游泳迟缓、体色发暗等体征,背部出现溃疡,鳃严重受损,泄殖孔肿胀等症状(图2),并陆续死亡,其发病症状与自然条件下发病河川沙塘鳢的症状相似,死亡情况见表3;对照组河川沙塘鳢在7 d内均正常。分离菌G2-4-1对河川沙塘鳢的7 d LD50为1.8×106CFU/mL。从人工感染杀鲑气单胞菌中重新分离菌株进行鉴定,结果均与原感染菌一致。以上结果表明可确定该菌株为患病河川沙塘鳢的病原菌。 图2 人工感染河川沙塘鳢的发病症状Fig.2 Clinical signs of artificially infected A.salmonicensea.背部溃疡的河川沙塘鳢(△),b.背部溃疡(□),鳃严重受损,c.泄殖孔红肿、溃疡(☆) 表3 分离菌G2-4-1人工感染河川沙塘鳢试验Tab.3 Results of artificial infection of the strain G2-4-1 to healthy O.potamophilus 健康对照组和患病感染组河川沙塘鳢的组织切片结果如图3。对照组肝细胞结构完整,排列紧密,细胞边界明显(图3-a);感染组肝脏出血严重,细胞排列紊乱松散,细胞核染色较深,部分肝脏细胞溶解坏死,细胞核溶解消失(图3-b)。对照组的鳃丝表面舒展平滑,细胞分布均匀,排列紧密(图3-c);感染组的鳃小片呼吸上皮细胞肿胀变性,出现坏死脱落,鳃细胞排列疏松紊乱,出现炎症细胞浸润,细胞空泡化(图3-d)。对照组的脾脏细胞分布均匀、排列紧密,细胞结构完整(图3-e);感染组的脾脏细胞排列松散紊乱,部分细胞出现肿胀、空泡、坏死(图3-f)。对照组的肾脏细胞排列紧密,结构完整,肾间质未见炎性细胞浸润(图3-g);感染组的部分肾小管上皮细胞肿胀、坏死、脱落,细胞排列疏松,肾间组织细胞空泡,出现大片坏死(图3-h)。 图3 杀鲑气单胞菌感染河川沙塘鳢的组织病理学变化(×200)Fig.3 The histopathological changes of A.salmonicida infection in O.potamophilus(×200)a.健康鱼肝脏,b.患病鱼肝脏,c.健康鱼鳃,d.患病鱼鳃,e.健康鱼脾脏,f.患病鱼脾脏,g.健康鱼肾脏,h.患病鱼肾脏 ★表示细胞核染色较深。☆表示肝细胞溶解坏死,细胞核溶解消失。□表示细胞肿胀变性,坏死脱落。▲表示细胞空泡化。→表示细胞肿胀、空泡、坏死。*表示细胞肿胀、坏死、脱落,细胞排列疏松。#表示细胞空泡,大片坏死。 分离菌G2-4-1的精氨酸二水解酶呈阳性,且多项理化特性与《Bergey′s Manual of Systematic Bacteriology》[9]中描述杀鲑气单胞菌理化特性一致,详情见表4。 表4 分离菌G2-4-1的理化特性Tab.4 Physicochemical properties of the strain G2-4-1 分离菌G2-4-1的gyrB基因序列在GenBank中登录号为OM203113,所扩增gyrB基因序列长度为1 116 bp。将分离菌G2-4-1的gyrB序列在NCBI进行Blast对比,结果显示分离菌G2-4-1的gyrB序列与杀鲑气单胞菌的gyrB序列(GenBank登录号为:JN711839.1)相似性为99.63%,并且进化树分析显示分离菌G2-4-1与所选择的杀鲑气单胞菌聚为一支(图4),表明分离菌G2-4-1与杀鲑气单胞菌亲缘关系最近。 图4 基于分离菌G2-4-1和其他细菌gyrB基因序列构建的NJ系统发育树Fig.4 The neighbor joining(NJ)phylogenetic tree based on the partial gyrB gene sequences 综合供试菌株的表型特征、理化特性及gyrB基因序列的系统发育分析结果,判定分离菌G2-4-1为杀鲑气单胞菌。 毒力基因检测结果表明,分离菌G2-4-1携带aer、hly、exu、ser、alt、act和lip共7个毒力相关基因(图5);胞外酶及溶血活性检测结果表明,分离菌G2-4-1具有蛋白酶、卵磷脂酶、淀粉酶、脂酶、明胶酶和溶血素活性,但不具有DNA酶活性(图6)。 图5 杀鲑气单胞菌毒力相关基因PCR扩增结果Fig.5 PCR amplification of the virulence-related genes of A.salmonicida M.marker;1.aer;2.hly;3.exu;4.ser;5.alt;6.act;7.lip 图6 杀鲑气单胞菌胞外酶和溶血素的检测Fig.6 Determination of extracellular enzymes and hemolysin of A.salmonicida a,b:溶血素活性;c,d:蛋白酶活性;e,f:卵磷脂酶活性;g,h:明胶酶活性;i,j:淀粉酶活性;k,l:脂酶活性;a.c.e.g.i.k:实验组;b.d.f.h.j.l:对照组。 分离菌G2-4-1对青霉素G、氨苄西林、苯唑西林、头孢唑啉、头孢噻吩、麦迪霉素、多粘菌素B和克林霉素8种药物耐药,对克拉霉素和大观霉素2种药物中介,对恩诺沙星、氟苯尼考等24类药物敏感(表5)。 表5 杀鲑气单胞菌对34种抗菌药物的敏感性Tab.5 Sensitivity of A.salmonicide to 34 antimicrobial agents 2.8.1 杀鲑气单胞菌感染对鳃组织中免疫相关基因表达的影响 由图7可知,MHCⅡB免疫相关基因的相对表达量在感染6 h后显著上调表达,在48 h达到峰值,上调0.84倍,在48 h后开始逐渐下降;MyD88、TLR和SOD共3个免疫相关基因的相对表达量在感染 6 h后显著上调表达,在24 h达到峰值,分别上调1.83、1.8和1.47倍,在24 h后开始逐渐下降。结果表明河川沙塘鳢感染初期这些免疫相关基因的表达量在鳃组织中都迅速上调。 图7 河川沙塘鳢感染杀鲑气单胞菌后不同时间点(0、6、12、24、48、72 h)鳃组织中免疫相关基因的相对表达情况Fig.7 Analysis of immune-related genes expression in O.potamophilus gill in response to A.salmonicida challenge by qRT-PCR at 0,6,12,24,48,72 h post-injection**表示极显著性差异(P≤0.01) 2.8.2 杀鲑气单胞菌感染对脾脏组织中免疫相关基因表达的影响 由图8可知,MHCⅡB免疫相关基因的表达量在感染 6 h后相对显著上调表达,在12 h达到峰值,上调2.58倍,在12 h后开始逐渐下降;MyD88、TLR和SOD共3个免疫相关基因的表达量在感染 6 h后相对显著上调表达,在24 h达到峰值,分别上调1.37、1.6和1.38倍,在24 h后开始逐渐下降。结果表明河川沙塘鳢感染初期这些免疫相关基因的表达量在脾脏组织中都迅速上调。 图8 河川沙塘鳢感染杀鲑气单胞菌后不同时间点(0、6、12、24、48、72 h)脾脏组织中免疫相关基因的相对表达情况Fig.8 Analysis of immune-related genes expression in O.potamophilus spleen in response to A.salmonicida challenge by qRT-PCR at 0,6,12,24,48,72 h post-injection**表示极显著性差异(P≤0.01) 2.8.3 杀鲑气单胞菌感染对肾脏组织中免疫相关基因表达的影响 由图9可知,MyD88免疫相关基因的相对表达量在感染12 h后显著上调表达,在24 h达到峰值,上调1.13倍,然后在24 h后开始逐渐下降;MHCⅡB、TLR和SOD共3个免疫相关基因的相对表达量在感染6 h后显著上调表达,在24 h达到峰值,分别上调2.62、0.89和1.47倍,在24 h后开始逐渐下降。结果表明河川沙塘鳢感染初期这些免疫相关基因的表达量在肾脏组织中均迅速上调。 图9 河川沙塘鳢感染杀鲑气单胞菌后不同时间点(0、6、12、24、48、72 h)肾脏组织中免疫相关基因的相对表达情况Fig.9 Analysis of immune-related genes expression in O.potamophilus kidney in response to A.salmonicida challenge by qRT-PCR at 0,6,12,24,48,72 h post-injection*表示显著性差异(0.01 杀鲑气单胞菌是革兰氏阴性短杆菌,属气单胞菌属 (Aeromonas),可导致鱼类发生疖疮病或溃疡病[12]。杀鲑气单胞菌菌体主要集中在鱼的肌肉和免疫器官,特别是在鱼的脾脏、肾脏和肝脏组织,被其感染的鱼类经常出现体表溃烂,器官发黑甚至严重出血[13]。本实验中,感染杀鲑气单胞菌的河川沙塘鳢临床表现主要症状为体表不同程度地溃疡,并且鳍条充血、出血,解剖时发现肝脏出血,这与雷美华等[14]报道杀鲑气单胞菌可导致鳗鲡(Anguillajaponica)体表溃疡,皮肤出现少量变色斑点,鳃伤,严重时出现死亡一致;COSCELLI等[15]报道杀鲑气单胞菌能引起大菱鲆(Scophthatmusmaximus)肝脏出血,体表溃疡;THOMAS等[16]发现杀鲑气单胞菌引起胡鲶(Clariasbatrachus)体表粘液减少,鳃丝损伤,肝脏组织空泡化,严重时出现大量死亡等研究报道结果存在一致性,但并不完全相同,推测为同一种病原菌感染不同水产动物会出现不同的临床症状表现,也可能是因为养殖水体温度不同,病原菌理化特性存在差异性。据报道,感染杀鲑气单胞菌患病或死亡的水产动物包括杂交鲟(Hybridsturgeon)[17]、鲫(Carassiusauratus)[18]、鲤(Lyprinuscarpio)[18]、长江江豚(Neophocaenaasiaeorientalis)[18]、裸盖鱼(Anoplopomafimbria)[19]和凡纳滨对虾(Litopenaeusvannamei)[20]等,可见其致病性较强且宿主范围较广。 杀鲑气单胞菌的强致病性是由其多个毒力因子共同作用的[14],郝婧薇等[21]研究发现,杀鲑气单胞菌毒力基因主要包括aer和hly等。本研究通过检测发现分离菌G2-4-1携带aer、hly、exu、ser、alt、act和lip共7个毒力基因,具有蛋白酶、卵磷脂酶、淀粉酶、脂酶、明胶酶和溶血素活性,但不具有DNA酶活性。这与张飘等[17]在感染杀鲑气单胞菌的杂交鲟中的检测结果一致;与刁菁等[22]在感染杀鲑气单胞菌的虹鳟(Oncorhynchusmykiss)中的检测结果基本一致,其还检测出封闭带毒素,而本实验中并未检出,推测这一差异是由于感染方式、剂量不同和菌株亲缘性较远。而ser、alt、act、exu和lip同样与气单胞菌的致病性有着重要联系,ser能够帮助细菌破坏并溶解宿主蛋白,可导致宿主结构损伤[23],alt和act具有溶血性和细胞毒性,可裂解细胞和损坏组织,引发鱼源出血和败血等症状[24],同时exu和lip可激活气单胞菌的气溶素活性,并增强细菌在宿主细胞中的黏附能力及降解宿主细胞成分[25]。本实验中,感染河川沙塘鳢的肝、鳃、脾脏和肾脏组织均出现了不同程度的损伤,最为严重的是肝脏大量出血,根据组织病理观察发现部分肝细胞溶解坏死,细胞核溶解消失,推测这一现象由杀鲑气单胞菌携带的alt和act所引起。鳃组织中,鳃小片呼吸上皮细胞肿胀变性,出现坏死脱落,鳃细胞排列疏松紊乱,出现炎症细胞浸润,细胞空泡化,这与杂交鲟[17]感染杀鲑气单胞菌后的组织病理变化一致。脾脏细胞出现肿胀、空泡、坏死,肾小管上皮细胞肿胀、坏死、脱落,肾间组织细胞出现空泡、坏死,综合分析推测杀鲑气单胞菌的主要靶器官为肝脏。 本实验鳃组织中,MHCⅡB表达量在48 h达到峰值,上调0.84倍,MyD88、TLR和SOD表达量在24 h达到峰值,分别上调1.83、1.8和1.47倍;脾脏组织中,MHCⅡB表达量在12 h达到峰值,上调2.58倍 ,MyD88、TLR和SOD表达量在24 h达到峰值,分别上调1.37、1.6和1.38倍;肾脏组织中,MHCⅡB、MyD88、TLR和SOD表达量均在24 h达到峰值,分别上调2.62、1.13、0.89和1.47倍,这与LIU等[4]研究发现河川沙塘鳢感染维氏气单胞菌后,短时间内相关免疫基因的表达量显著上调的结果相似,包括MHCⅡB、SOD等。庞纪彩等[26]和郑风荣等[27]研究表明,MHCⅡB的特异免疫和氧化压力成正相关,在细胞免疫和体液免疫中起着重要作用。范泽军等[28]研究发现TLR负反馈机制对信号的平衡调节在抗感染免疫中起着重要作用。KAWAI等[29]研究指出MyD88是Toll样受体信号中重要的转导蛋白,能在信号途径中发挥重要作用,还可以调控细胞因子的分泌从而影响适应性免疫应答。杨新良等[30]研究发现免疫细胞吞噬细菌后会激活胞内NADPH氧化酶,从而产生杀菌物质和一系列活性氧(ROS)。但是何勤等[31]研究指出当鱼体长期处于氧化应激状态下时,机体的免疫器官会受到不同程度的损伤,从而导致机体免疫力下降,最终引发疫病或死亡。LIN等[32]研究指出SOD可以清除ROS从而维持体内稳态,LIU等[33]研究指出SOD清除机体的ROS能力可以作为评价机体免疫力的重要指标。大西洋鲑(S.salar)感染杀鲑气单胞菌后,其肝脏和血清SOD活性显著提高,表明了实验鱼感染杀鲑气单胞菌后体内产生大量自由基并促进其抗氧化酶活性的提高[34],本实验结果与其结论具有相似之处。本实验中随着感染时间的增加,鳃、脾脏和肾脏组织中不同免疫相关基因表达量显著上调,大部分在24 h达到峰值,可推测河川沙塘鳢感染杀鲑气单胞菌后特异性免疫增强,抗感染免疫能力增强,适应性免疫能力增强,并且体内抗氧化酶活性明显提高,体现出当河川沙塘鳢遇到杀鲑气单胞菌入侵时,这些基因均参与了河川沙塘鳢对杀鲑气单胞菌的免疫应答,通过不同免疫防护机制共同抵抗病原菌入侵从而保护机体,这些结果为进一步了解河川沙塘鳢和杀鲑气单胞菌的相互作用提供了理论依据。 本研究从患病河川沙塘鳢体内分离获得1株具有致病性的杀鲑气单胞菌 G2-4-1,其对河川沙塘鳢7 d LD50为1.8×106CFU/mL,该病原菌感染可导致河川沙塘鳢肝脏、鳃、脾脏和肾脏不同程度的变性、坏死和炎性细胞浸润。该菌株携带aer、hly、exu、ser、alt、act和lip等毒力相关基因,具有蛋白酶、卵磷脂酶、淀粉酶、脂酶、明胶酶和溶血素活性,对恩诺沙星、氟苯尼考等药物敏感。
2 结果
2.1 患病河川沙塘鳢症状及分离菌形态特征

2.2 分离菌G2-4-1的致病性

2.3 组织病理分析
2.4 分离菌G2-4-1理化特征
2.5 gyrB基因序列同源性分析

2.6 杀鲑气单胞菌毒力基因和毒力因子检测结果

2.7 杀鲑气单胞菌耐药性分析

2.8 杀鲑气单胞菌感染对河川沙塘鳢免疫相关基因表达的影响


3 讨论
3.1 杀鲑气单胞菌的致病性
3.2 杀鲑气单胞菌的毒力因子
3.3 河川沙塘鳢感染杀鲑气单胞菌后免疫相关基因差异表达分析
4 结论

