一氧化氮参与调控油菜素内酯增强高山离子芥悬浮细胞抗寒性
刘亚洁 安黎哲
(1.兰州大学草种创新与草地农业生态系统全国重点实验室/农业农村部草牧业创新重点实验室/草地农业教育部工程研究中心/草地农业科技学院,兰州 730020; 2.兰州大学生命科学学院,兰州 730000; 3.北京林业大学生态与自然保护学院,北京 100083)
低温是限制植物分布、生长、发育和降低农作物产量的最为严重的胁迫因子之一[1]。植物可以通过改变其细胞代谢和激活各种防御机制响应和适应低温。低温诱导植物体内产生过量的活性氧(ROS),包括过氧化氢(H2O2)、单线态氧(1O2)、超氧阴离子(O·–2)和羟自由基(OH-)[2],过量产生的ROS 可导致膜脂过氧化程度加剧、DNA 损伤和蛋白质变性,也就是氧化损伤[1,3]。低温胁迫造成的氧化损伤是植物敏感组织响应低温的最初反应,也是造成低温损伤的一个重要因素[3]。植物体内有效清除ROS,修复氧化损伤的保护机制是抗氧化防御系统,它包括酶促和非酶促防御系统两类。酶促防御系统包括各种抗氧化酶如抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、过氧化物酶(POD)和超氧化物歧化酶(SOD)等。非酶类抗氧化剂包括脂溶性抗氧化剂(维生素E、类胡萝卜素)和水溶性抗氧化剂[抗坏血酸(AsA)、还原性谷胱甘肽(GSH)][2]。诸多研究表明植物抗低温胁迫能力的增强通常与抗氧化防御能力的提高密切相关,这对清除过量的ROS和修复低温造成的氧化损伤具有重要作用[3-4]。因此开展植物低温胁迫响应机制的研究及预防低温对植物造成伤害具有重要意义。
油菜素内酯(BRs)是一类甾醇类植物激素,在植物界中普遍存在,其中24-表油菜素内酯(EBR)是使用最多、用途最广泛的一种。BRs 可以增强植物对低温、干旱、盐、高温、金属离子和病原体侵染等各种非生物和生物胁迫的抗逆性,特别是在缓解低温对植物造成的损伤以及提高植物耐冷性方面表现出良好效果[2,5-6]。研究表明,BRs提高植物抗寒性与其提高细胞膜稳定性,调节光合作用以及增强细胞的渗透调节能力有关[6-9]。BRs 还可以通过影响植物膜脂脂肪酸的组成及不饱和程度来调节其对低温胁迫的响应[10-11]。
一氧化氮(NO)是一种具有生物活性的小分子气体自由基,它可以自由扩散透过细胞膜,参与调控植物生长发育的许多过程,如种子的萌发和休眠、植物组织的生长和发育、光形态建成、植物细胞的成熟和衰老、开花、气孔关闭以及程序性细胞凋亡等[12-14]。在植物对各种生物及非生物胁迫的响应过程中,如干旱、盐、极端温度、紫外辐射、机械损伤、除草剂、臭氧、重金属以及病原体侵袭,NO 作为一个重要的信号分子发挥调节功能,缓解逆境造成的损伤,提高其抗逆性[13-15]。已有研究证实NO 通过参与渗透调节、维持细胞膜的完整性以及提高抗氧化酶活性等增强植物的抗寒能力[3-4,16]。植物细胞内NO 的产生主要有以下途径,即类似于哺乳动物一氧化氮合酶(NOS)、硝酸还原酶(NR)、其他酶促反应如亚硝酸还原酶和黄嘌呤氧化酶以及非酶促反应[12,15]。此外,NO 在植物激素如生长素、细胞分裂素、脱落酸等调控的生理反应中发挥重要作用[12-14],然而,作为第六大类植物激素,BRs 增强植物抗寒性是否与NO 信号分子有关的研究鲜见报道,NO 在BRs 调控植物响应低温胁迫中的作用机理及信号路径尚不明确。高山离子芥(Chorispora bungeana)是十字花科(Brassicaceae)离子芥属(Chorispora)的高山冰缘多年生草本植物,和模式植物拟南芥(Arabidopsis thaliana)有较高同源性,是低温逆境生理学研究的理想材料[17]。本研究以高山离子芥悬浮细胞作为一个未分化的、均一的、相对脆弱的植物细胞模型,通过用NO 清除剂PTIO 以及NOS 抑制剂L-NAME进行处理,研究在NO 信号阻断的情况下BRs 对细胞抗寒程度、ROS 水平和抗氧化防御系统的影响,阐明NO 信号分子是否与BRs 提高细胞抗寒性、BRs 在低温胁迫下调节ROS 水平以及抗氧化防御有关,从而揭示BRs 诱导提高植物抗寒性的信号转导机制。
1 材料与方法
1.1 试验材料与设计
高山离子芥取材于新疆天山乌鲁木齐河源区(43°46′N,87°15′E,海拔3 700 m),悬浮细胞的培养参照Guo等[18]的方法。
为探究低温胁迫下BRs 对高山离子芥悬浮细胞抗寒性的影响,将培养好的处于指数生长期的同一批材料转接于0.01、0.10、1.00 μmol·L-1EBR和不加EBR的MS液体培养基中,随后置于光照培养箱中25、4、0 ℃摇床培养处理3 d,摇床转速为120 r·min-1。处理结束后,用双层筛网(400 目)过滤细胞,并用蒸馏水清洗3 遍,用滤纸吸干表面水分,鲜样称取质量,测定相关生理指标。
为了探究BRs 对高山离子芥抗寒性的影响是否受NO 信号分子调控,将悬浮培养好的处于指数生长期的同一批材料转接于加入不同化学试剂的MS 液体培养基中进行处理。这些处理包括:(1)灭 菌 水;(2)0.1 μmol·L-1EBR;(3)100 μmol·L-1SNP(硝 普 钠,外 源NO 供 体);(4)0.1 μmol·L-1EBR+100 μmol·L-1PTIO;(5)0.1 μmol·L-1EBR+300 μmol·L-1L-NAME;(6)100 μmol·L-1PTIO;(7)300 μmol·L-1L-NAME。随后将这些处理的悬浮细胞分为3 组,一组在光照培养箱中25 ℃培养,而另外两组分别置于4 ℃和0 ℃低温培养箱中,摇床培养3 d,以不加任何化学试剂处理并培养于25 ℃的细胞作为对照。处理结束后收集细胞测定相关指标。
1.2 测定指标与方法
1.2.1 相对细胞活力测定
细胞活力的主要生理指标是氯化三苯四氮唑(TTC)还原能力[18]。0.2 g细胞中加入0.4% TTC 溶液和100 mmol·L-1磷酸钠缓冲液(pH=7.0)于25 ℃下避光反应13 h,弃去上清液,用蒸馏水洗涤细胞3次后,再加入95%乙醇,60 ℃温浴30 min,静置于室温下至细胞无色,取上清测定485 nm处吸光值,以光密度值的大小表示细胞活力。
相对细胞活力=处理细胞活力/未经任何处理细胞活力×100%。
1.2.2 相对离子渗漏率和膜脂过氧化程度测定
相对离子渗漏率测定参照Zhao等[19]的方法并稍加修正,即取样结束,细胞中加入16 mL 去离子水,真空抽气8 min,抽气3 次,每次间隔2 min,然后震荡使上下层液体混匀,静置20 min,测电导率C1,沸水浴30 min,自来水冷却10 min,震荡待静置1 h 后,测电导率C2,用公式计算相对离子渗漏率(C1/C2×100%)。膜脂过氧化程度用丙二醛(MDA)含量表示,采用硫代巴比妥酸法测定[20]。
1.2.3 NO含量和NOS活性测定
NO 含量和NOS 活性的测定参考Liu 等[21]的方法。
1.2.4 ROS含量测定
用硫酸钛法测定H2O2含量,OH–含量的测定采用2-脱氧核糖法[21]。采用Zhao等[19]的方法并稍加修改测定O·–2产生速率。收集的悬浮细胞用65 mmol·L-1PBS(pH=7.8)缓冲液研磨,提取液于4 ℃下5 000g离心10 min。取上清加入65 mmol·L-1PBS(pH=7.8)和10 mmol·L-1盐酸氢氨,于25 ℃下温浴20 min,再加入对氨基苯磺酸和α-萘胺,于25 ℃下继续温浴20 min,在530 nm处测定吸光值。
1.2.5 抗氧化酶类活性测定
收集的悬浮细胞用50 mmol·L-1磷酸钾缓冲液(含1% PVP,pH=7.8)冰浴研磨提取,提取液于4 ℃,15 000g离心20 min,上清液用于酶活性分析,用考马斯亮蓝G-250 法测定蛋白浓度。APX 活性测定用AsA 比色法,CAT 活性采用H2O2分解法测定,GR 活性采用测定NADPH 氧化速率的方法,POD活性测定采用愈创木酚显色法,SOD 活性测定采用氮蓝四唑光化学还原法[21]。
1.2.6 抗氧化剂含量测定
收集的细胞用0.5 mmol·L-1EDTA 溶液(含3%三氯乙酸)研磨提取,提取液于4 ℃,15 000g离心10 min,上清液用于抗氧化剂含量分析。AsA 含量采用2,6-二氯酚锭酚(DCPIP)光度测定法,GSH含量用5,5-二硫代对硝基苯甲酸(DTNB)比色法进行测定[21]。
1.3 数据处理
所有试验重复3 次,用SPSS 19.0 软件对数据进行统计和方差分析,不同处理数据之间的差异性用Duncan 多重检验进行分析,当P<0.05 认为有显著性差异。用Origin 9.0绘制数据图。
2 结果与分析
2.1 不同浓度EBR 对离子芥悬浮细胞抗寒性的影响
如图1 所示,在4 ℃和0 ℃胁迫下,不加EBR处理的悬浮细胞活力分别降低至正常温度下细胞活力的81.4%和78.4%,相对离子渗漏率增加了36.8% 和63.6%,MDA 质量摩尔浓度也升高了19.7%和37.9%,说明低温处理明显抑制离子芥悬浮细胞活力,导致相对离子渗漏率和MDA 质量摩尔浓度显著升高,而且这种变化随着温度的降低表现得越为明显。

图1 在正常生长温度(25 ℃)和低温胁迫下(4 ℃和0 ℃),不同浓度EBR 处理对高山离子芥悬浮细胞相对活力(A)、相对离子渗漏率(B)和MDA 质量摩尔浓度(C)的影响图中数据为平均值±标准差;柱上不同字母表示经Duncan 法检验在P<0.05水平差异显著;下同。Fig.1 Effects of different EBR concentrations on relative cell viability(A),relative ion leakage(B) and MDA molality(C) in the suspension cultured cells from C. bungeana under normal growth temperature(25 ℃) and chilling stres(s4 ℃ and 0 ℃)Each value represented mean±standard deviation;Different letters on the bars indicated significant difference at P<0.05 level by Duncan test;the same as below.
不同浓度EBR处理对正常温度下(25 ℃)生长的悬浮细胞的细胞活力、相对离子渗漏率和MDA质量摩尔浓度没有产生显著影响。而在4 ℃低温环境下,与不加EBR 单独低温处理相比,0.01、0.10、1.00 μmol·L-1EBR 处理细胞相对活力分别提高了12.4%、19.4%和6.3%,相对离子渗漏率降低了10.7%、21.7%和6.9%,同时MDA 质量摩尔浓度显著降低了9.5%、15.1%和8.6%。在0 ℃低温环境下不同浓度EBR 处理对上述生理指标的影响与在4 ℃类似,表明EBR能够明显缓解低温胁迫下细胞活力的下降及离子渗漏率和MDA质量摩尔浓度的增加。另外,在3 种处理浓度中,0.10 μmol·L-1EBR 对低温胁迫下悬浮细胞的保护效果最理想,在后续试验中使用该浓度EBR处理细胞。
2.2 EBR、EBR+PTIO 以及EBR+L-NAME 对离子芥悬浮细胞抗寒性的影响
由图2 所示,在常温下,EBR、EBR+PTIO 以及EBR+L-NAME 处理细胞的相对活力、相对离子渗漏率、MDA 质量摩尔浓度没有显著性差异。而在低温胁迫下,EBR 处理可以明显提高悬浮细胞相对活力,降低相对离子渗漏率和MDA 质量摩尔浓度。在4 ℃低温胁迫下,与只加入EBR 处理相比,EBR+PTIO、EBR+L-NAME复合处理细胞的相对活力显著降低了21.8%和35.8%,而相对离子渗漏率明显升高了80.0%和79.4%,同时MDA 质量摩尔浓度明显增加了27.8%和23.7%。在0 ℃低温环境下,EBR、EBR+PTIO 以及EBR+L-NAME 对相对细胞活力、相对离子渗漏率和MDA 质量摩尔浓度的影响与4 ℃环境下类似。由此可见在低温胁迫下,EBR中加入PTIO或L-NAME复合处理细胞时,EBR对细胞的保护作用被抑制。

图2 在正常生长温度(25 ℃)和低温胁迫下(4 ℃和0 ℃),EBR、PTIO 以及L-NAME处理对高山离子芥悬浮细胞相对活力(A)、相对离子渗漏率(B)和MDA质量摩尔浓度(C)的影响EBR.0.1 μmol·L-1 EBR;EBR+PTIO.0.1 μmol·L-1 EBR+100 μmol·L-1 PTIO;EBR+L-NAME.0.1 μmol·L-1 EBR+300 μmol·L-1 L-NAME;下同。Fig.2 Effects of EBR,PTIO and L-NAME on relative cell viability(A),relative ion leakage(B) and MDA molality(C) in the suspension cultured cells from C. bungeana under normal growth temperature(25 ℃) and chilling stress(4 ℃ and 0 ℃)EBR.0.1 μmol·L-1 EBR;EBR+PTIO.0.1 μmol·L-1 EBR+100 μmol·L-1 PTIO;EBR+L-NAME.0.1 μmol·L-1 EBR+300 μmol·L-1 L-NAME;the same as below.
2.3 低温胁迫下EBR 对离子芥悬浮细胞NO 含量和NOS活性的影响
如图3 所示,在4 ℃和0 ℃低温下,细胞NO 质量摩尔浓度分别升高了62.2%和83.1%,而NOS活性也同时上升了78.1%和139.3%,说明低温处理可明显提高细胞内源NO 质量摩尔浓度和NOS 活性,这种变化随着温度的降低表现的越为显著。在正常生长状况下(25 ℃),EBR 处理略微提高了细胞NO 质量摩尔浓度和NOS 活性。而在4 ℃和0 ℃低温环境下,与仅处于逆境胁迫的细胞相比,EBR 处理细胞的NO 质量摩尔浓度分别显著提高了44.6%和40.0%,NOS 活性也明显增加了58.6%和32.5%,表明EBR 处理可以影响细胞内源NO 质量摩尔浓度和NOS活性,在低温胁迫下,EBR 处理细胞的内源NO 水平和NOS 活性更高。在4 ℃和0 ℃低温下,EBR+PTIO 复合处理明显抑制了EBR对NO 质量摩尔浓度的诱导提高效应,与单独EBR处理相比NO 质量摩尔浓度降低了65.3% 和55.8%,但EBR、EBR+PTIO 处理细胞的NOS 活性没有显著差异。同时,在低温下NOS 抑制剂LNAME 的加入也显著抑制了EBR 对NO 积累的促进效应,与4 ℃和0 ℃单独EBR 处理相比NO 质量摩尔浓度降低了64.3%和43.5%。此外,L-NAME也可以抑制EBR处理增强的NOS活性。
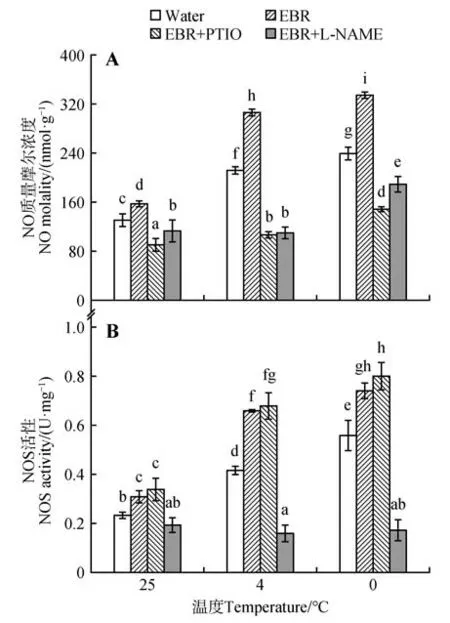
图3 在正常生长温度(25 ℃)和低温胁迫下(4 ℃和0 ℃),EBR、PTIO 以及L-NAME 处理对高山离子芥悬浮细胞NO质量摩尔浓度(A)和NOS活性(B)的影响Fig.3 Effects of EBR, PTIO and L-NAME on NO molality(A) and NOS activity(B) in the suspension cultured cells from C. bungeana under normal growth temperature(25 ℃) and chilling stress(4 ℃ and 0 ℃)
2.4 SNP、PTIO 以及L-NAME 对离子芥悬浮细胞抗寒性的影响
在4 ℃和0 ℃环境下,NO 供体SNP 处理悬浮细胞的相对活力相比单纯低温处理显著提高了13.6% 和20.7%,相对离子渗漏率明显减少了22.6%和36.6%,同时MDA 质量摩尔浓度也显著降低了12.4%和26.8%(见图4:A~C),表明NO 能够明显抑制低温胁迫下细胞活力的降低以及离子渗漏率和MDA 质量摩尔浓度的升高。在4 ℃低温下,与仅受逆境胁迫处理的细胞相比,PTIO 或LNAME 会导致相对细胞活力明显下降,降低的程度达到51.0%和52.1%,同时相对离子渗漏率显著升高了57.2%和42.5%,MDA 质量摩尔浓度增加了23.6%和19.8%。在0 ℃低温环境下,SNP、PTIO以及L-NAME 对相对细胞活力、相对离子渗漏率和MDA 质量摩尔浓度的影响与4 ℃环境下类似。在正常生长温度(25 ℃)下,SNP、PTIO、L-NAME处理细胞的相对活力、相对离子渗漏率和MDA 质量摩尔浓度没有显著性差异,说明SNP、PTIO 及LNAME对常温下生长的悬浮细胞不会产生影响。
此外,图4D~E 显示,无论在正常生长温度还是在低温胁迫下,与不加任何试剂处理的细胞相比,虽然SNP 是NO 的供体可以促进悬浮细胞内源NO 质量摩尔浓度大幅度上升,然而却明显抑制细胞NOS 活性,PTIO 是NO 清除剂可以降低细胞NO水平,但却增强了NOS 活性,这表明细胞NO 质量摩尔浓度与其NOS 活性之间存在反馈抑制。LNAME 处理在抑制细胞NOS 活性的同时也降低了细胞NO质量摩尔浓度。
2.5 低温胁迫下EBR、SNP、PTIO以及L-NAME对离子芥悬浮细胞ROS含量的影响
如图5 所示,悬浮细胞处于低温环境时,与对照相比其H2O2质量摩尔浓度、O·–2产生速率和OH-含量明显上升,这种变化随着温度的降低表现的越为显著,在4 ℃和0 ℃低温下,H2O2质量摩尔浓度增加了66.5%和105.9%,O·–2产生速率升高了84.3%和114.0%,同样OH–含量增加了45.9%和53.0%。在4 ℃环境下,外源EBR 处理细胞的H2O2质量摩尔浓度、O·–2产生速率和OH-含量相比仅处于低温胁迫的细胞明显下降了30.2%、42.0%和27.1%,而在EBR 中加入PTIO 后H2O2质量摩尔浓度、O·–2产生速率和OH–含量又显著增加,相比单独EBR 处理分别增加了101.3%、83.0%和33.0%,同样EBR+L-NAME 与单独EBR 处理相比上述指标分别明显增加了90.7%、64.8%和37.1%。在0 ℃,EBR、EBR+PTIO 以及EBR+L-NAME 对H2O2质量摩尔浓度、O·–2产生速率和OH–含量的影响与4 ℃类似。由此可见EBR 可以抑制低温所引起的ROS大量积累,而用PTIO清除NO或用L-NAME抑制NOS 活性可以阻抑EBR 降低ROS 含量的这种生理效应。
在4 ℃和0 ℃胁迫下,SNP 处理细胞的H2O2质量摩尔浓度相比单纯低温处理显著降低了26.3%和34.2%,O·–2产 生 速 率 明 显 减 少 了43.6% 和42.3%,同时OH-含量也显著降低了28.5% 和18.4%,说明NO 也可以抑制低温所引起的ROS 大量积累。另外,与仅受低温胁迫的细胞相比,PTIO或L-NAME 单独处理会明显提高细胞的H2O2质量摩尔浓度、O·–2产生速率和OH-含量。
2.6 低温胁迫下EBR、SNP、PTIO以及L-NAME对离子芥悬浮细胞抗氧化防御系统的影响
与对照相比,低温胁迫下悬浮细胞APX、GR、POD 和SOD 活性明显升高,而CAT 活性却被胁迫逆境抑制,在4 ℃和0 ℃低温下,CAT 活性下降了18.1%和38.8%(见图6)。在4 ℃,外源EBR 处理后APX、CAT、GR、POD 和SOD 活性显著增强,相比单独低温胁迫分别明显增加了54.1%、30.8%、36.7%、42.5%和29.3%,外源SNP 处理同样也显著提高了上述抗氧化酶活性。在0 ℃,EBR 以及SNP对APX、CAT、GR、POD 和SOD 活性的影响与4 ℃类似。如图7 所示,低温处理下悬浮细胞AsA 和GSH 质量摩尔浓度显著增加,与对照相比,在4 ℃胁迫下增加了44.2%和90.5%,在0 ℃胁迫下增加了20.9%和16.9%,而在加入EBR 后AsA 和GSH质量摩尔浓度进一步明显提高,相比单纯4 ℃低温处理增加了28.9%和17.4%,与仅处于0 ℃胁迫处理相比提高了50.8%和47.4%。同时外源SNP 处理也显著提高了AsA 和GSH 质量摩尔浓度。以上结果说明,EBR 和NO 可以增强低温胁迫下细胞的抗氧化防御能力。

图7 低温胁迫下,EBR、SNP、PTIO 以及L-NAME 处理对高山离子芥悬浮细胞AsA(A)和GSH(B)质量摩尔浓度的影响Fig.7 Effects of EBR, SNP, PTIO and L-NAME on the molalities of AsA(A) and GSH(B) in the suspension cultured cells from C. bungeana under chilling stress
如图6 所示,在4 ℃低温胁迫下,EBR 中加入PTIO 后APX、CAT、GR、POD 和SOD 活性又明显降低,与单独EBR 处理对比分别减少了48.4%、43.8%、42.2%、36.9%和22.8%,同样EBR+L-NAME与单独EBR 处理相比上述抗氧化酶活性分别显著降低了55.3%、42.6%、40.3%、45.3%和26.3%。在0 ℃,EBR+PTIO 以及EBR+L-NAME 对APX、CAT、GR、POD 和SOD 活性的影响与4 ℃类似。与此同时,4 ℃低温下在EBR 中加入PTIO 或L-NAME 复合处理细胞的AsA 质量摩尔浓度与只加入EBR 处理相比明显降低31.7%和31.0%,同样GSH质量摩尔浓度也显著减少了28.4%和23.3%。在0 ℃环境下,EBR+PTIO以及EBR+L-NAME对AsA和GSH质量摩尔浓度的影响与4 ℃类似。可见PTIO 及LNAME 在不同程度上阻碍了低温胁迫下EBR 对抗氧化酶活性和抗氧化剂含量的诱导提高效应。此外,与仅受低温胁迫的细胞相比,PTIO 及L-NAME单独处理会导致细胞APX、CAT、GR、POD 和SOD活性以及AsA和GSH质量摩尔浓度明显下降。
3 讨论
3.1 EBR对离子芥悬浮细胞抗寒性的影响
在本研究中,低温胁迫会明显抑制悬浮细胞活力,外源EBR 处理可以使胁迫下细胞活力部分恢复。相对离子渗漏率是反映植物细胞膜受低温逆境损伤的一个重要生理指标,MDA 是膜脂过氧化产物,其含量的多少可以反映膜脂过氧化程度。低温胁迫会引起细胞膜损伤,胞内可溶性物质和电解质大量向膜外渗漏以及膜脂过氧化程度加剧,而EBR 处理可以缓解离子渗漏和膜脂过氧化程度的加剧。低温胁迫导致植物体内ROS过量积累,EBR 处理可以抑制低温胁迫下离子芥悬浮细胞H2O2含量、O·–2产生速率和OH-含量的升高,提高抗氧化酶APX、CAT、GR、POD 和SOD 的活性,促进抗氧化剂AsA 和GSH 的积累,增强细胞的抗氧化防御能力,从而缓解ROS 大量积累对细胞造成的氧化损伤,防止膜脂过氧化程度加剧,以维持低温状态下细胞膜系统结构和功能的稳定性,保证其生理代谢的正常进行,提高植物对低温胁迫的抗逆能力。这与EBR 在葡萄(Vitis vinifera)[9]、辣椒(Capsicum annuum)[22-23]和垂穗披碱草(Elymus nutans)[24]中的研究结果一致。抗氧化防御系统的增强可能通过转录或翻译特定基因来调节植物体内抗氧化酶及抗氧化剂代谢中关键酶的合成和活化[25],从而增强植物对低温胁迫的耐受力,以抵抗低温对植物体造成的损伤。
3.2 NO 在离子芥悬浮细胞响应低温胁迫时发挥的功能
本研究中SNP 处理可以缓解低温造成的离子芥悬浮细胞活力降低,离子渗漏以及膜脂过氧化程度加剧。与仅受低温处理的细胞相比,PTIO 或L-NAME单独处理会明显加剧细胞活力下降,离子渗漏和膜脂过氧化程度。在低温胁迫下,悬浮细胞NO含量和NOS活性明显升高,而NOS抑制剂LNAME 处理阻碍了低温对NO 含量的诱导提高效应,说明低温环境下NO积累来源于NOS催化。在逆境胁迫下,NO 可以作为一种抗氧化剂迅速清除ROS[3,13,16],许多研究表明NO防卫和保护植物细胞免受胁迫损伤与NO 能够有效清除ROS,调节植物体ROS含量减少有密切关系[15]。本研究发现低温导致细胞H2O2含量、O·–2产生速率和OH–含量显著上升,外源SNP 处理可以抑制低温胁迫下ROS 大量积累。与仅受低温胁迫的细胞相比,PTIO 及LNAME 处理导致H2O2含量、O·–2产生速率和OH–含量明显升高,表明NO 作为一种抗氧化剂直接清除低温胁迫下细胞内过量产生的ROS,从而缓解ROS 大量积累对细胞造成的氧化损伤。NO 还可以作为信号分子激活细胞的抗氧化防御系统[19,26-27]。本研究中,低温胁迫下SNP 处理可以显著提高细胞抗氧化酶APX、CAT、GR、POD 和SOD活性以及抗氧化剂AsA 和GSH 含量,从而增强细胞的抗氧化防御能力,这与牟雪姣等[4]在蝴蝶兰(Phalaenopsisspp.)和黄志明等[28]在枇杷(Eriobotrya japonica)幼果中的研究结果一致。此外,与仅受低温处理的细胞相比,PTIO 及L-NAME 处理导致APX、CAT、GR、POD 和SOD 活性以及AsA 和GSH含量显著下降。在Xu等[3]和陈宇等[29]的研究中,采用NO清除剂或NOS抑制剂处理均抑制了低温胁迫下枇杷幼果中CAT、POD、SOD 和APX 的活性。可见,在低温环境下NO 作为信号分子激活细胞的抗氧化防御系统,从而抑制ROS过量积累,修复氧化损伤。综上,NOS 催化产生的NO 参与离子芥悬浮细胞对低温胁迫的响应过程,是重要的胁迫响应信号分子,它使细胞启动一系列反应,防御和保护植物体免受胁迫损伤,从而增强植物的抗寒性。
3.3 低温胁迫下EBR和NO的关系
大量研究表明,NO 可以作为信号分子参与调控植物激素信号转导[12-14]。在拟南芥中,NO 可以与ABA通过对细胞骨架组织的调节作用促进根毛生长和异位根毛形成[30]。另外,Pagnussat 等[31]的研究表明吲哚乙酸诱导不定根发育的过程中,NO含量瞬时升高并作为信号分子参与调控这一生理反应。NO 处理可以延缓赤霉素、细胞分裂素诱导的细胞程序性凋亡,缓解赤霉素对SOD 和CAT 活性的抑制[32]。NO 参与乙烯诱导的蚕豆(Vicia faba)气孔关闭[33],还可作为对乙烯有抑制作用的因子延缓植物的成熟和衰老[12]。
诸多研究证实BRs 与NO 互作调节植物生长发育[34-35],BRs 处理提高拟南芥根细胞中NO 浓度,在BRs 诱导根系结构变化中作为下游受体发挥功能[36]。施加外源BRs不仅提高野茶树(Camellia sinensis)叶片中类黄酮浓度,还可以促进NO 积累,NO 作为BRs 的下游信号分子发挥作用并在其促进类黄酮合成中是必需的[37]。李雨桐等[38]的研究发现BRs诱导黄瓜(Cucumis sativus)幼苗不定根发生过程中NO 作为下游信号分子起正向调控作用。此外,BRs 增强植物对各种环境胁迫的抗逆性也与NO 信号途径有关。在烟草(Nicotiana benthamiana)幼苗遭受盐胁迫时BRs 能够促进体内NO 积累从而抵御胁迫[39]。BRs 处理可以缓解水分胁迫造成的氧化损伤从而增强玉米(Zea mays)和辣椒植株的抗逆性,同时BRs 诱导生成的NO 参与调控此过程[40-41]。NOS和NR 活性被外源BRs调节并诱导NO 生成从而增强黄瓜对低温和光氧化胁迫的抗性[42]。在重金属镉胁迫时,BRs 处理提高辣椒植株中NR活性和NO含量进而缓解胁迫造成的损伤[43]。综上可知,BRs 和NO 在植物生长发育过程中相互影响,发挥重要的调控作用。
本研究中,外源EBR 处理可以缓解低温胁迫下高山离子芥悬浮细胞活力的下降以及离子渗漏和膜脂过氧化程度的加剧,而用PTIO 抑制NO 积累或L-NAME 抑制NOS 活性则会阻抑EBR 对细胞的保护效应,同时外源EBR 处理可以明显提高低温胁迫下细胞内源NO含量并激活NOS活性,这表明NO 含量和NOS 活性的显著提高对于EBR 诱导提高植物抗寒性是必需的。此外,NOS 抑制剂LNAME 会阻抑低温下EBR 对NO 积累的促进效应,可见NOS 在NO 调控EBR 诱导提高植物抗寒性的生理过程中发挥重要作用,EBR 诱导的NO 积累来源于NOS 催化。低温胁迫下,EBR 处理降低H2O2含量、O·–2产生速率和OH-含量的生理效应也被PTIO 及L-NAME 所阻抑。与此同时,PTIO 及LNAME 明显抑制了EBR 对抗氧化酶APX、CAT、GR、POD 和SOD 活性的增强效应,以及抗氧化剂AsA 和GSH 含量的提高效应,从而导致细胞清除ROS的能力下降。上述结果表明EBR 通过激活离子芥悬浮细胞的NOS 活性来促进细胞内源NO 积累,在低温胁迫下,EBR 处理可以抑制ROS过量积累并增强细胞的抗氧化防御能力,而这两个过程均受NO 调控,从而缓解低温造成的氧化损伤,提高细胞的抗寒性,这与马金虎等[44]在玉米种胚中得到的结果是一致的。总之,低温胁迫下NOS 来源的NO是EBR的下游信号分子。
植物通过激活多种防御反应来响应低温胁迫,除了NO,ABA、Ca2+、ROS、茉莉酸(JA)等都可作为第二信使参与调控低温信号的识别、转导等。ABA 是植物响应低温胁迫的重要信号分子,引起植物体内适应性调节反应和相关冷调控基因表达[1]。低温激活了膜上的Ca2+通道,细胞内Ca2+水平在短时间内骤增,Ca2+与下游的钙调素等钙结合蛋白结合,激活一系列蛋白激酶,从而进一步通过诱导下游相关基因的表达调控植物体对低温的各种生理代谢响应[45]。ROS 可以作为信号分子参与细胞响应低温胁迫,并受Ca2+激活,通过细胞质中Ca2+浓度的变化传递冷信号[46]。张政委等[27]的研究指出,Ca2+参与低温胁迫下NO 的调节过程,且ROS 可能作为信号分子参与且位于Ca2+的下游。此外,NO与JA在植物对低温胁迫的响应中可能存在信号交叉[29]。BRs 可能是通过Ca2+、钙信使系统以及促进ABA合成来调节植物抗冷力的形成[6,47],因此可以推测其他信号分子可能参与低温环境下BRs 信号传递,NO 与其他信号分子在BRs 传导网络中存在复杂的交叉调控。
4 结论
综上所述,在低温逆境胁迫下,EBR 处理可以激活高山离子芥悬浮细胞的NOS 活性,导致细胞内源NO 水平显著升高,积累的NO 可以作为抗氧化剂直接清除低温胁迫下过量产生的ROS,同时,NO 还可以作为信号分子上调细胞的抗氧化防御能力,增强的抗氧化防御系统抑制ROS 含量的升高,缓解ROS大量积累对细胞造成的氧化损伤,防止膜脂过氧化程度加剧,从而稳定细胞膜的结构和功能,增强抗寒能力。总之,低温胁迫下,由NOS 催化产生的NO 在BRs 抑制ROS 积累以及激活抗氧化防御的响应中发挥重要的下游信号分子功能,从而提高植物的抗寒性。低温下BRs 和其他信号分子之间的相互作用及其传递网络还需进一步研究。

