C57BL/6NcGAS基因敲除鼠的构建及对猪伪狂犬病病毒增殖的影响
李丽蕴,梁东阁,于海深,郭江涛,曾 磊
(河南农业大学 动物医学院 农业农村部动物生化与营养重点实验室/河南省动物生长发育调控重点实验室,河南 郑州 450046)
在病毒感染过程中,宿主细胞通过模式识别受体(pattern recognition receptors,PRRs)识别病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)或损伤相关分子模式(damage associated molecular patterns,DAMPs),并引发下游抗病毒天然免疫反应的级联反应[1-3]。环GMP-AMP(cyclic GMP-AMP,cGAMP)合成酶(cGAS)是一种细胞质DNA传感器,在所有哺乳动物中cGAS感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS是通过检测处于错误位置的DNA来发挥作用。在正常条件下,DNA被紧密得包装在细胞核中并受到保护。当DNA片段逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥征兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是cGAS一旦检测到DNA存在于细胞核外面时就会开始起作用。当cGAS与胞质中的双链DNA结合时,cGAS在GTP和ATP作用下产生2′,3′-环GMP-AMP(2′-3′-cyclic GMP-AMP,2′,3′-cGAMP)[4],cGA-MP随后激活干扰素基因刺激因子(stimulator of interferon genes,STING)、TANK结合激酶1(TANK-binding kinase 1,TBK1)和干扰素反应因子3(interferon regulatory factor 3,IRF3)或NF-κB信号通路,促进干扰素-β(interferon-β,IFN-β)、白介素-18(interleukin 18,IL-18)和白介素-1β(IL-1β)的产生[5-8]。在这种信号级联反应结束时,细胞或者得到修复,或者因损坏到无法修复的地步导致自我破坏。
伪狂犬病病毒(pseudorabies virus,PRV)又称猪疱疹病毒Ⅰ型(suid alphaherpesvirus 1,SuHV-1)或Aujeszky病病毒(Aujeszky's disease virus,ADV),是疱疹病毒科、甲疱疹病毒亚科、水痘病毒属的一员。伪狂犬病 (pseudorabies,PR)是由PRV引起的多种动物发热、奇痒(猪除外)并伴有脑脊髓炎的传染病[9]。除了自然宿主猪,PRV还可以感染广泛的哺乳动物,包括牛、羊、犬、狐狸、狼和老虎[10]。鉴于cGAS对宿主抵抗病毒感染过程中产生免疫调节作用的重要性,本试验利用CRISPR/Cas9基因编辑技术构建cGAS基因敲除小鼠,并检测cGAS基因敲除小鼠与野生型小鼠相比感染PRV后对PRV增殖的影响,证明cGAS在抑制病毒增殖中发挥的重要作用。
1 材料与方法
1.1 材料C57BL/6N小鼠、非洲绿猴肾细胞Vero、PRV-QXX(野毒株)由农业农村部动物生化与营养重点实验室保存;PRV gE、gB单克隆抗体由本实验室制备;cGAS、β-actin购自武汉三鹰生物技术有限公司;黏附载玻片、盖玻片购自江苏世泰实验器材有限公司;RNAiso Plus购自宝日生物技术(北京)有限公司;草酸铵结晶紫染色液购自北京索莱宝科技有限公司;DAPI染色试剂(即用型)购自武汉塞维尔生物科技有限公司;Goat anti-Mouse IgG (H+L) Highly cross-Adsorbed Secondary antibody、Alexa Fluor Plus 555购自赛默飞世尔科技有限公司。
1.2 方法
1.2.1引物设计与合成 根据美国国家生物技术中心(national center for biotechnology information,NCBI)网站所公布的鼠cGAS基因序列,本试验针对小鼠cGAS基因设计对应的sgRNA,引物名称及序列见表1。PCR筛选杂合子小鼠引物设计见表2,PCR-cGAS-F1/R1引物的靶向等位基因为438 bp,野生型等位基因为4 101 bp。交叉杂合小鼠产生纯合子小鼠,PCR-cGAS-F1/R1引物扩增长度为438 bp;PCR-cGAS-F2/R1引物扩增长度为480 bp。纯合子438 bp,杂合子438/480 bp,野生型480 bp。

表2 PCR鉴定引物
根据NCBI网站提供的mRNA序列,应用NCBI的Primer-BLAST网页设计Q-PCR引物,检测目的基因名称和引物序列见表3。引物由上海生工生物有限公司合成。
表3 荧光定量PCR引物
1.2.2cGAS基因敲除小鼠的构建 敲除小鼠品种名称为C57BL/6N-Mb21d1tm1cyagen,序列号为KOCMP-00464-Mb21d1,品种类型为C57BL/6N。设计gRNA目标序列如下:gRNA1(上游):GAGTGTCAAGCGAACATTTCAGG;gRNA2(上游):GA-ATGACTCTTACCGGATAGTGG。cGAS基因(NC-BI 参考序列:NM_173386;Ensembl:ENSMU-SG00000032344)位于小鼠第9号染色体上。鉴定了5个外显子,ATG起始密码子位于外显子1中,TGA终止密码子位于外显子5中(转录本:ENSMUST00000070742)。外显子2~4将被选为目标位点。外显子2从大约40.50%的编码区开始。外显子2~4占编码区的37.21%。有效KO区域的大小为3 210 bp。KO区域没有任何其他已知基因。Cas9和gRNA将共同注射到受精卵中用于KO小鼠的生产。
幼鼠将通过PCR进行基因分型,然后进行测序分析。PCR基因分型具体方法如下:剪取小鼠尾尖后使用基因组DNA提取试剂盒,获得高纯度的基因组DNA,测量浓度后进行定量。PCR反应完成后将其产物进行核酸凝胶电泳,通过电泳结果挑选出杂合子小鼠,并将杂合子小鼠进行杂交配对以产生纯合子小鼠。
1.2.3Western blot 用Western blot方法检测C57BL/6N小鼠cGAS敲除情况及感染PRV-QXX后对PRV-gB和PRV-gE 蛋白表达影响。取6周龄左右C57BL/6N和C57BL/6N-cGAS-/-小鼠各6只,每3只为1组,共分为4组,每种小鼠各取1组为空白对照组,其余组为试验组,试验组滴鼻感染50 μL 稀释后的PRV-QXX,将TCID50=1×107PRV-QXX病毒液用DMEM倍比稀释为TCID50=5×103,DMEM做空白对照。病毒感染3 d后,处死小鼠并将肺脏组织分为3份,分别进行收取组织中总蛋白,用于Western blot试验、提RNA用于Q-PCR试验、4% PFA固定用于H&E试验。取脑和肺脏组织研磨并收取蛋白后进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),后进行转膜、室温封闭、孵育一抗(cGAS兔多克隆抗体和PRV-gB、PRV-gE单克隆抗体)、孵育二抗(辣根过氧化物酶标记的山羊抗兔IgG和辣根过氧化物酶标记的山羊抗小鼠IgG)和显影。以β-actin作为内参。
1.2.4H&E染色 用H&E染色检测cGAS-/-对小鼠组织形态及感染PRV-QXX后肺脏组织中炎性浸润的影响。取上述试验中在4% PFA中固定后的肺脏组织进行H&E染色,染色步骤依次为:组织块冲水、酒精梯度脱水、二甲苯透明、浸蜡、包埋、切片、染色、封片等。
1.2.5小鼠存活率检测 取6周龄左右C57BL/6N和C57BL/6N-cGAS-/-小鼠各15只,并分别取3只小鼠做空白对照,其余12只感染PRV-QXX,将TCID50=1×107PRV-QXX病毒液用DMEM倍比稀释为TCID50=5×105。将小鼠用乙醚麻醉后滴鼻感染50 μL稀释后的病毒液,用DMEM做空白对照,每隔12 h观察小鼠精神状态并记录死亡情况。
1.2.6病毒PFU检测 取6周龄左右C57BL/6N和C57BL/6N-cGAS-/-小鼠各6只,每3只为1组,共分为4组,其中2组为空白对照组,2组为试验组,试验组滴鼻感染50 μL PRV-QXX,将TCID50=1×107PRV-QXX病毒液用DMEM倍比稀释为TCID50=5×103,用DMEM做空白对照。感染3 d天后处死小鼠,收取肺脏组织的病毒液。用Vero细胞铺板于24孔板,每孔细胞数量为1×105个。将收取的病毒液用DMEM进行倍比稀释。待24孔板中的Vero细胞长至90%时,弃上清加入稀释后的病毒液,放入细胞培养箱吸附1 h,弃病毒液加入维持培养基继续培养4 d。用4% PFA室温固定细胞,利用1%结晶紫染色,流水浸洗后倒扣晾干,显微镜下统计噬斑数。
1.2.7Q-PCR检测cGAS-/-对PRV感染后相关基因转录的影响,将上述得到的肺脏组织用TRIzol裂解法收取RNA并反转录为cDNA后,以cDNA为模板,用TB GreenTMPremix Ex TaqTM(Tli RNase-H Plus)进行Q-PCR检测。β-actin mRNA表达水平为内参值,计算PRV-TK、PRV-gB、IFN-β、ISG15和ISG20 mRNA表达水平,试验重复3次。
1.2.8免疫组化检测cGAS-/-对PRV-gB蛋白表达影响 将感染PRV不同时间点的C57BL/6N和C57BL/6N-cGAS-/-小鼠肺脏组织,经过石蜡包埋后进行切片,烘片后进行脱蜡和复水。然后用EDTA抗原热修复法对组织切片进行抗原热修复:将组织切片放置煮沸的抗原修复液中,继续煮沸15~20 min,自然缓慢冷却至室温后用双蒸水浸洗2次。用1×磷酸缓冲盐溶液(phosphate buffered saline,PBS)浸洗后进行室温封闭和通透,再分别进行室温孵育PRV-gB单克隆抗体(1∶500稀释)、荧光二抗和DAPI染色剂浸染细胞核等步骤,1×PBS和双蒸水分别浸洗3次后封片,晾干后拍照。

2 结果
2.1 C57BL/6N-cGAS-/-小鼠的构建与鉴定已知敲除片段为外显子2~4所在区域(图1A)。为确认敲除片段是否正确,对纯合子小鼠基因组进行测序。由测序结果可知(图1B)与理论序列信息一致,表明该KO小鼠已成功构建,可用于后续试验。取3只杂交产生的幼鼠(2只公鼠,1只母鼠)用上述PCR方法进行基因型鉴定。PCR分型使用的2个对照:水对照(不添加DNA模板);野生型对照(小鼠基因组DNA 400 ng)。电泳分离出大小为438 bp左右的目的条带(图1C),表明3只幼鼠均为纯合子阳性。随后另取3只纯合子小鼠的肺脏和脑组织用Western blot方法检测cGAS基因已经敲除完全(图1D),以野生型小鼠的肺脏和脑组织作对照。

A.小鼠Mb21d1敲除区域示意图; B.C57BL/6N-cGAS-/-测序结果;C.cGAS-/-纯合子鉴定结果(M.DL1000 DNA Marker;1#.幼母鼠;2#,3#.幼公鼠); D.Western blot检测cGAS敲除结果
2.2cGAS敲除对C57BL/6N小鼠肺脏和脑组织形态影响为验证cGAS敲除后是否对小鼠组织形态产生影响,使用H&E染色检测了小鼠肺脏和脑部的组织形态。结果显示,cGAS敲除后对小鼠肺脏和脑组织形态无明显影响(图2)。
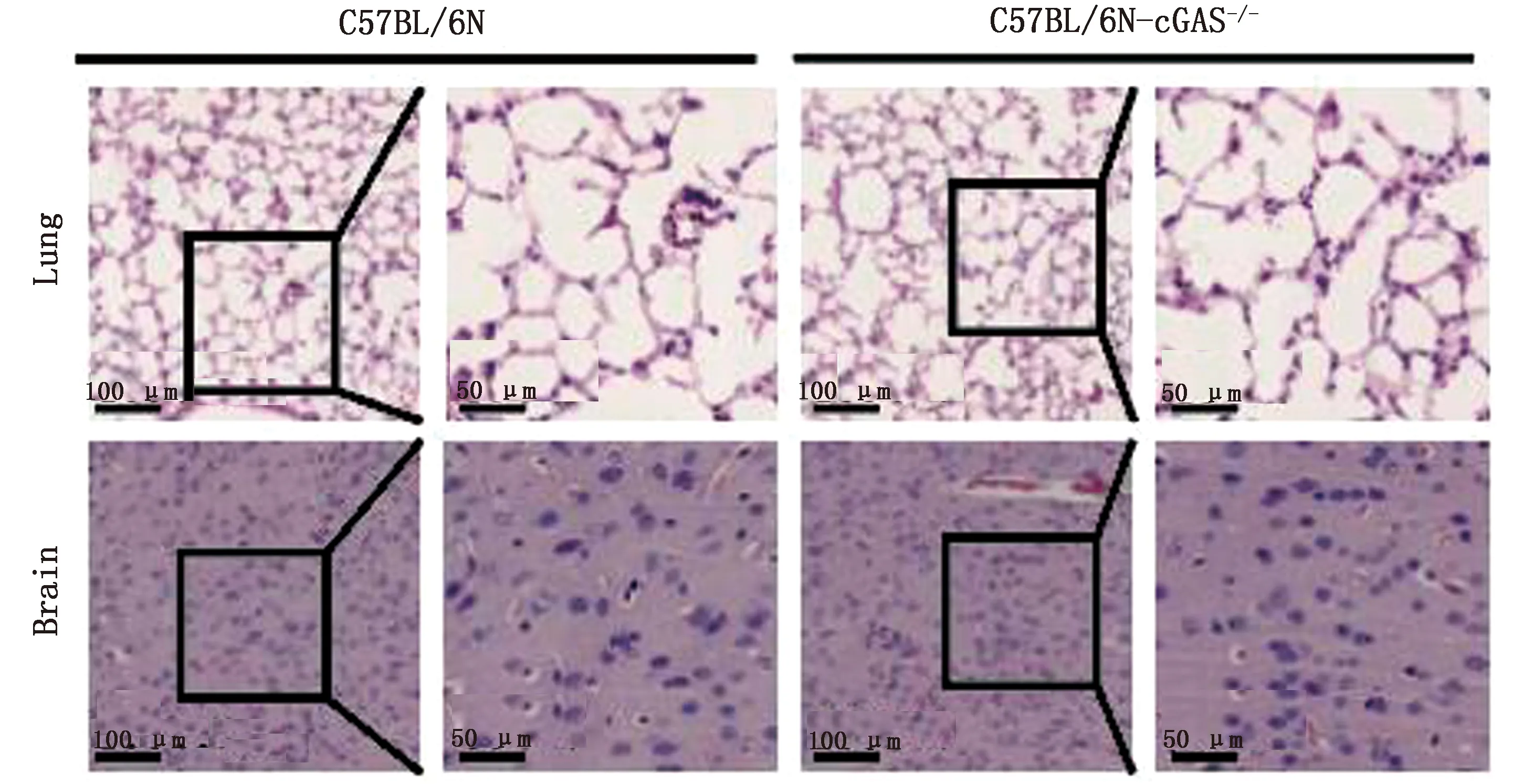
图2 cGAS敲除对C57BL/6N小鼠肺脏和脑组织形态无影响
2.3cGAS敲除提高PRV毒力PFU测定结果显示,PRV感染C57BL/6N小鼠后测定PFU为102.6PFU/mL,在C57BL/6N-cGAS-/-小鼠体内PFU为105.6PFU/mL,表明随着PRV感染时间增加C57BL/6N-cGAS-/-小鼠的病毒毒力显著高于C57BL/6N小鼠(图3)。结果表明,敲除cGAS能显著提高PRV毒力。
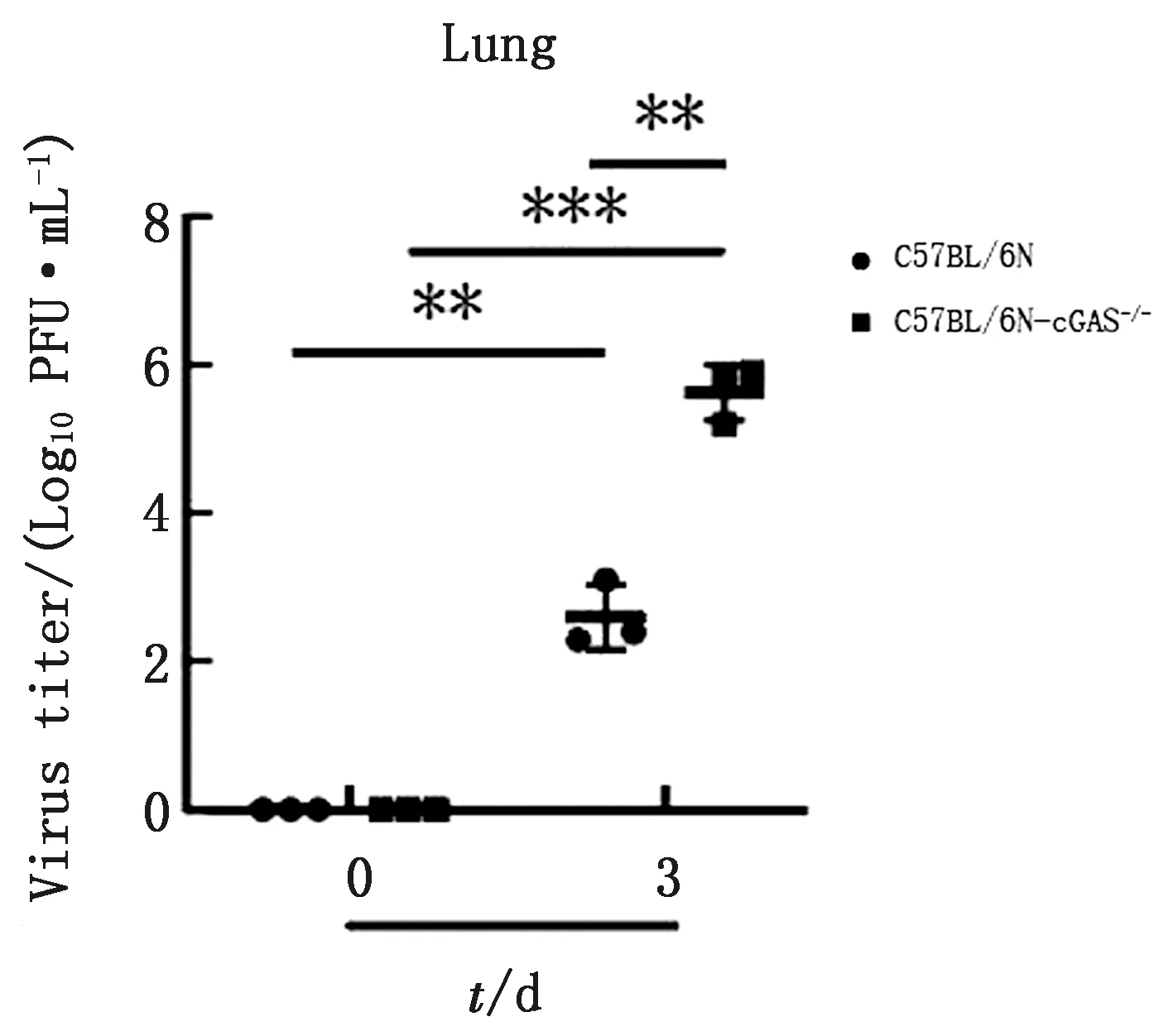
与对照组比较,*.差异显著(P<0.05);**.差异极显著(P<0.01);ns.差异不显著(P>0.05)。下同
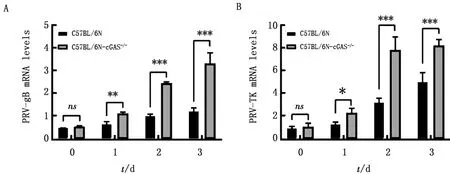
A.Q-PCR检测感染PRV不同时间PRV-gB基因拷贝数;B.Q-PCR检测感染PRV不同时间PRV-TK基因拷贝数

A.Western blot检测感染PRV后PRV-gB和PRV-gE蛋白的表达量;B.免疫组化检测感染PRV后PRV-gB蛋白的表达量

A.Q-PCR检测感染PRV不同时间IFN-β基因拷贝数;B.Q-PCR检测感染PRV不同时间ISG15基因拷贝数;C.Q-PCR检测感染PRV不同时间ISG20基因拷贝数
2.4 敲除cGAS促进PRV-gB和PRV-TKmRNA转录取感染PRV-QXX的C57BL/6N和C57BL/6N-cGAS-/-小鼠的肺脏组织,Q-PCR检测PRV-gB、PRV-TKmRNA表达水平。随着PRV-QXX感染时间增加,C57BL/6N-cGAS-/-小鼠体内PRV-gB(图4 A)和PRV-TK(图4 B)mRNA表达量显著高于C57BL/6N小鼠。结果表明,敲除cGAS促进PRV-gB和PRV-TK基因转录。
2.5 敲除cGAS上调PRV-gB和PRV-gE 蛋白表达Western blot检测结果显示,C57BL/6N-cGAS-/-小鼠PRV-gB和PRV-gE蛋白显著高于C57BL/6N小鼠(图5A)。同时免疫组化的结果进一步证实随着PRV感染时间增加,C57BL/6N-cGAS-/-小鼠PRV-gB蛋白表达显著高于C57BL/6N小鼠(图5B)。结果表明,敲除cGAS促进PRV-gB和PRV-gE蛋白的表达。
2.6 敲除cGAS抑制PRV调控的IFN-β、ISG15及ISG20 mRNA转录Q-PCR检测C57BL/6N和C57BL/6N-cGAS-/-小鼠感染PRV-QXX后体内IFN-β、ISG15及ISG20 mRNA表达水平。随着PRV-QXX感染时间增加,C57BL/6N小鼠体内IFN-β(图6A)、ISG15(图6B)和ISG20(图6C)mRNA表达量显著高于C57BL/6N-cGAS-/-小鼠。结果表明,敲除cGAS抑制了IFN-β、ISG15及ISG20 mRNA转录。
2.7 敲除cGAS促进PRV感染肺脏组织炎性浸润H&E染色检测C57BL/6N及C57BL/6N-cGA-S-/-小鼠感染PRV-QXX后肺脏组织内炎性浸润情况。随着PRV感染时间的增加,C57BL/6N-cGAS-/-小鼠肺脏组织内炎性浸润显著多余C57BL/6N小鼠(图7)。结果表明,敲除cGAS促进了PRV感染引起的肺脏组织内的炎性浸润。
2.8cGAS敲除降低PRV感染后小鼠存活率为检测C57BL/6N和C57BL/6N-cGAS-/-小鼠在感染PRV后存活率的差异,经统计分析,C57BL/6N和C57BL/6N-cGAS-/-小鼠在感染病毒3 d后均出现死亡,但C57BL/6N-cGAS-/-小鼠的死亡率显著高于对照组,并且在病毒感染5 d后全部死亡(图8)。结果表明,cGAS敲除后可促进小鼠死亡。
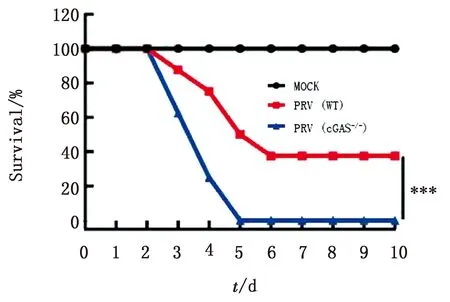
图8 cGAS敲除促使小鼠存活率降低
3 讨论
天然免疫是宿主抵御病原体的第一道防线,而cGAS是天然免疫中的重要衔接蛋白。有研究报道,cGAS是一种触发Ⅰ型干扰素通路的细胞质DNA传感器,而且还揭示了一种新的免疫信号传导机制,其中cGAS产生第二信使cGAMP,cGAMP结合并激活STING[11],从而触发Ⅰ型干扰素的产生[12]。在缺乏cGAS的细胞中,例如成纤维细胞、巨噬细胞和树突状细胞不能产生Ⅰ型干扰素和其他细胞因子。干扰素家族的细胞因子现在被认为是先天免疫反应的关键组成部分和对抗病毒感染的第一道防线。
根据干扰素结构组成及功能可以将其分为3大类:分别为Ⅰ型干扰素、Ⅱ型干扰素、Ⅲ型干扰素,并可以根据它们所传递信号的受体复合体进行进一步分类。Ⅰ型(IFNα/β)和Ⅲ型(IL28A、IL28B、IL29)干扰素通常被认为是抗病毒类别[13]。干扰素刺激基因(ISG)在干扰素抗病毒途径中有不同的作用。一些ISGs的功能是阻止病毒复制,而另一些ISGs则能够促进或增强某些病毒的复制[14]。ISGs的产生分为2种途径,抗病毒干扰素通过JAK/STAT信号通路诱导ISGs的产生,还有一些ISGs是在没有通过干扰素的情况下由病毒感染直接诱导产生的[15]。最早发现的抗病毒ISGs是非常有效的(例如MX1、PKR、OAS1),在近几年中又发现了新的成员(TRIM 5、ZAP、APOBEC3G、IFITM3)。ISG介导的抗病毒活性的一个特点是,单个干扰素效应器可以抑制病毒复制。据报道,ISG15可以阻止病毒介导的干扰素调节因子3(IRF3)的降解,从而增加IFN-β的表达[16]。
病毒必须进入细胞翻译和复制基因组,然后释放感染新的细胞,以此完成它们的生命周期。病毒生命周期的每个阶段都是ISG干预的潜在目标。病毒依赖宿主核糖体进行蛋白质合成,而翻译是ISG干预的常见目标。例如,锌指抗病毒蛋白(ZAP)、干扰素诱导的带有四肽重复序列的蛋白(IFIT)家族、OAS-RNASE途径和PKR这些ISGs可以抑制翻译[17-19]。除了翻译,病毒或宿主蛋白的翻译后修饰对病毒复制和传染也很重要。ISG15是ISG复杂性的典范,并在将翻译与翻译后修饰相结合方面发挥了新的作用[20]。
理论上,所有能够携带DNA进入宿主细胞质的微生物,如DNA病毒、细菌、寄生虫(如疟疾)和逆转录病毒(如HIV),都可能触发cGAS-STING通路[21-22]。cGAS酶促合成cGAMP作为一种信号放大机制,可增强相关免疫反应。然而cGAS在宿主细胞质中检测到自身DNA也可能导致自身免疫性疾病,如系统性红斑狼疮、Sjögren综合征和Aicardi-Goutières综合征[23]。先前的研究表明,通过siRNA下调猪cGAS显著降低了PRV感染后IFN-β mRNA转录水平,提示PRV感染可以激活cGAS[24];以及BRD4抑制剂通过cGAS-STING诱导DNA损伤应答和抗病毒天然免疫,抑制PRV的感染[4]。本试验结果显示随着PRV感染时间的延长,敲除cGAS基因可以显著促进PRV-TK、PRV-gBmRNA的转录,PRV-gE蛋白的翻译以及子代病毒的毒力,因此cGAS在C57BL/6N小鼠体内抑制PRV病毒增殖中发挥重要作用。

