2株GⅡb亚群猪流行性腹泻病毒分离、鉴定及变异分析
郭子仪,孙亚威,许夕雅,丁晨梦,邓梦梦,韩紫薇,吕晨哲,齐江坤,于林洋,王新卫,陈 陆
(河南农业大学 动物医学院,河南 郑州 450046)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种高传染性猪肠道疾病,感染仔猪以发生呕吐、急性水样腹泻和严重脱水为特征[1],7日龄以下仔猪病死率可达100%[2]。PEDV于1971年首次出现在英国[3],随后在欧洲和亚洲的许多生猪养殖国家也报道了该疾病[4]。1973年,中国首次出现猪传染性胃肠炎(transmissible gastroenteritis,TGE)样急性腹泻暴发,但直到1984年才通过荧光抗体试验和血清中和试验确认该病的病原体为PEDV[5]。2010年底,由变异毒株引起的PED在我国南方再次暴发流行,给我国养猪业造成了巨大经济损失。2013年4月美国首次出现由PEDV变异毒株引起的PED病例,1年之内造成数百万仔猪死亡[6]。目前,PED依然是对世界养猪业影响最大的猪病之一。因此,分离当前PEDV流行变异株以及掌握其进化趋势,对于后续的新型疫苗研发意义重大。
PEDV是α-冠状病毒属(α-CoV)的成员,基因组全长约28 kb,由7个开放阅读框(ORF)组成。从5′→3′端依次编码复制酶多聚蛋白1ab(pplab)、纤突蛋白(S)、ORF3蛋白、小膜蛋白(E)、膜糖蛋白(M)和核衣壳蛋白(N)[7]。S蛋白是一种糖基化蛋白,含有能够诱导中和抗体的表位,具有高度的遗传多样性[8]。基于S基因的遗传多样性,PEDV分为GⅠ和GⅡ 2大基因型,每个基因群可进一步分为2个亚型,分别为GⅠa/b和GⅡa/b[9]。GⅠa/b亚型主要包括早期流行的CV777、DR13等低致病力毒株,GⅡa和GⅡb均属于高致病力变异毒株,而GⅡb亚型流行更广泛[10]。最近流调结果显示[11],我国PEDV流行毒株大多是GⅡ基因型,其中GⅡb亚群占比90%以上。目前我国流行的GⅡa和GⅡb亚型毒株对哺乳仔猪具有高致病性,并具有血清的交叉中和活性或交叉免疫保护[12-14]。经典PEDV毒株CV777的PEDV疫苗在我国被广泛使用,但免疫失败现象常见[15]。
因此,基于目前流行的PEDV变异毒株开发新疫苗迫在眉睫,为实现这一目标,本研究在先前分子流调基础上[16],成功分离出2株当前流行且高毒力的GⅡb变异毒株CH-HNKF-03和CH-HNPDS-01,并对其进行全基因组测序分析及致病性试验,以期为PEDV新型高效疫苗的研发提供候选毒株。
1 材料与方法
1.1 PEDV阳性样品与细胞株2020和2021年采集的经RT-PCR及测序鉴定为PEDV GⅡb阳性的腹泻仔猪肠道组织,用含有青霉素(100 mg/L)、链霉素(100 IU/mL)和磷酸胰蛋白酶(7.5 mg/L) 的改良DMEM培养基匀浆后,反复冻融3次,4℃离心取上清液,用0.22 μm滤器除菌,-80℃备用。非洲绿猴肾细胞系(Vero CCL-81)购自ATCC。
1.2 主要试剂M-MLV反转录酶、Recombinant RNase Inhibitor、2×Taq PCR Mix均购自宝日医生物技术(北京)有限公司(TaKaRa中国);病毒基因组DNA/RNA提取试剂盒购自天根生化科技(北京)有限公司;Oligo dT(18)、Random primer购自生工生物工程(上海)股份有限公司;胰酶购自Sigma(美国)公司;兔抗PEDV S蛋白血清由本实验室制备;Alexa Fluor®488-conjugated goat anti-rabbit IgG购自Abcam(英国)公司。
1.3 实验动物9头1日龄未吃母乳健康仔猪,购自河南省某猪场,采集直肠拭子,通过RT-PCR确认PEDV、TGEV、猪急性腹泻综合征病毒、猪δ冠状病毒和猪轮状病毒呈阴性。在适应期间,所有仔猪均活跃,粪便稠度正常,无临床症状。
1.4 引物设计与合成根据GenBank公布的PEDV变异株KR809885(CH/HNAY/2015),设计18对全基因组测序引物。引物由生工生物工程(上海)股份有限公司合成,引物详细信息见表1。

表1 PEDV全基因组测序引物信息
1.5 病毒分离处理的组织上清液接种生长良好的单层Vero细胞,吸附1 h,PBS(0.01 mol/L,pH=7.2)清洗3次,加入含胰酶(1 mg/L)的维持液,置37℃ CO2培养箱中培养,48 h后收取培养液盲传至出现细胞病变,收获病毒液并命名,置-80℃保存。
1.6 间接免疫荧光分析(IFA)PEDV感染Vero细胞(MOI=0.1)18 h后,4%多聚甲醛4℃固定30 min,0.25% Triton X-100室温下通透10 min,3% BSA洗涤3次后,用3% BSA封闭1 h,分别用兔抗S蛋白抗血清和Alexa Fluor®488-conjugated goat anti-rabbit IgG作为第一抗体和第二抗体,用DAPI对细胞核进行染色5 min,PBS洗涤细胞后,用荧光显微镜观察。
1.7 PEDV全基因组克隆和测序取病毒液用病毒基因组DNA/RNA提取试剂盒提取样品RNA进行反转录,反转录体系:5×M-MLV Buffer 4 μL、dNTP(2.5 mmol/L)4 μL、Oligo dT(18)(20 μmol/L)0.5 μL、Random primer(20 μmol/L)0.5 μL、M-MLV反转录酶(200 U/μL)0.5 μL、Recombinant RNase Inhibitor(40 U/μL)0.5 μL、RNA 200 ng,DEPC(焦碳酸二乙酯)水补足20 μL。反转录程序:42℃处理1 h,70℃处理15 min。反转录后获得的cDNA进行PCR检测,采用50 μL反应体系:25 μL 2×Phanta Max Buffer、dNTP Mix 0.5 μL、上、下游引物(25 μmol/L)各1 μL、Phanta Max Super-Fidelity DNA Polymerasec 1 μL,cDNA 4 μL,ddH2O补足。反应条件:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,30个循环;最后72℃延伸5 min,4℃ 10 min。反应结束后,取PCR扩增产物进行1%琼脂糖凝胶电泳检测。阳性产物进行胶回收并克隆于pMD18-T载体,挑取阳性质粒送生工生物工程(上海)股份有限公司测序。
1.8 全基因组同源性比对及系统发育分析运用DNAStar和MEGA-X软件对本研究毒株全基因组及S、ORF3、E、M、N基因与GenBank数据库已公布的国内外44个代表性参考毒株进行同源性比对及系统发育分析,采用邻接法(neighbor-joining method)构建系统发育树,通过1 000次重复计算引导值。

A.CH-HNKF-03感染Vero细胞后CPE结果;B.CH-HNPDS-01感染Vero细胞后CPE结果;C.阴性细胞对照;D.CH-HNKF-03感染Vero细胞后IFA结果;E.CH-HNPDS-01感染Vero细胞后IFA结果;F.IFA阴性对照

A.全基因组系统发育树;b~f.S、ORF3、E、M、N基因系统发育树;●.本试验分离毒株

A.CH-HNKF-03攻毒组;B.CH-HNPDS-01攻毒组;C.阴性对照组;D.CH-HNKF-03攻毒组肠道剖检;E.CH-HNPDS-01攻毒组肠道剖检;F.阴性对照组肠道剖检
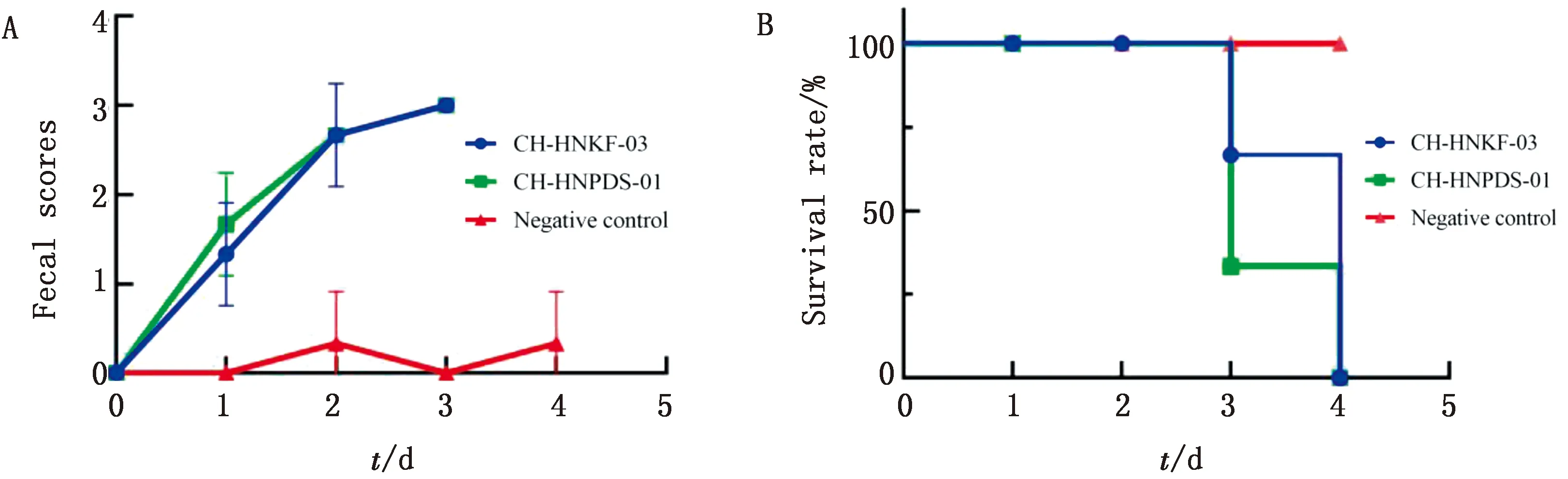
A.各组仔猪粪便评分曲线;B.各组仔猪存活率
1.9 致病性试验9头1日龄未吃初乳健康仔猪,随机均分为3组:CH-HNKF-03攻毒组、CH-HNPDS-01攻毒组和阴性对照组。CH-HNK-F-03攻毒组和CH-HNPDS-01攻毒组仔猪每头分别灌服PEDV CH-HNKF-03、CH-HNPDS-01株病毒液100 TCID50,阴性对照组灌服同体积DMEM。攻毒后4 d内,每天目测仔猪腹泻情况,按照以下评分标准进行打分:0分,正常;1分,膏状大便;2分,半液体腹泻;3分,液体腹泻。记录每组仔猪平均得分,评估腹泻严重程度。
1.10 结果分析将各基因片段重叠部分利用CExpress软件拼接,得到用CH-HNKF-03、CH-HNPDS-01的全基因组序列,利用DNAStar软件包中的MegAlign进行同源性比较,用MEGA-X进行系统发育分析。
2 结果
2.1 病毒分离及IFA鉴定CH-HNKF-03和CH-HNPDS-01毒株分别在第3和5代出现典型细胞病变(CPE)。用PEDV S蛋白多克隆抗体进行IFA检测,结果显示,在感染的Vero细胞中有绿色荧光信号,空白细胞对照中没有(图1)。
2.2 PEDV全基因组扩增、测序及拼接对CH-HNKF-03和CH-HNPDS-01基因片段进行扩增和测序,通过CExpress软件拼接,得到2条完整PEDV序列,长度分别为27 970,28 032 bp(表2)。其序列已上传至GenBank数据库,登录号为分别为OL446966、OL446967。
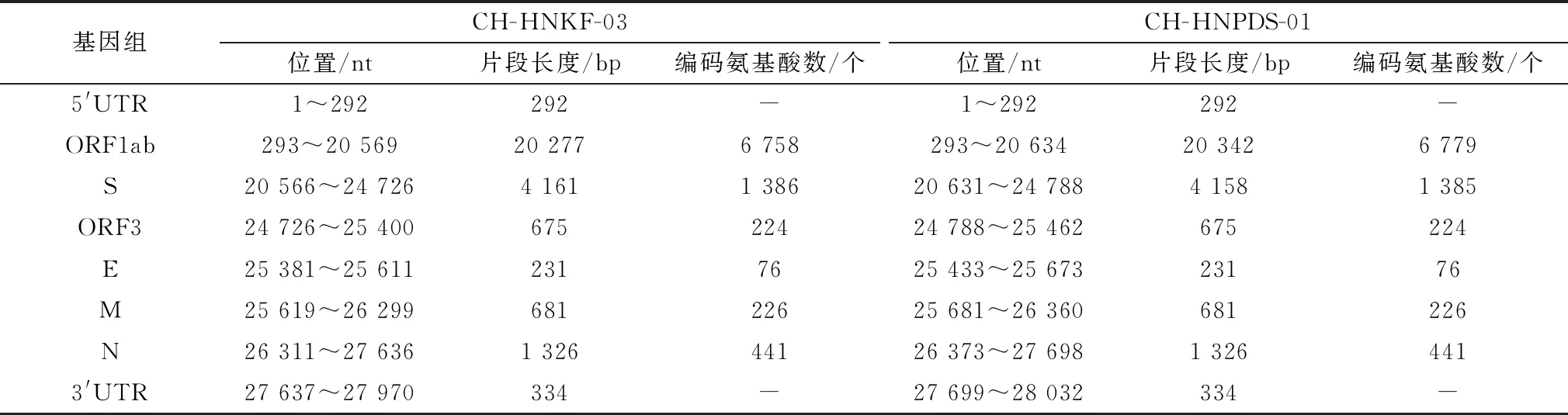
表2 PEDV CH-HNKF-03、CH-HNPDS-01株基因组结构
2.3 全基因组同源性比对及系统发育分析全基因组同源性比对显示CH-HNKF-03和CH-HNPDS-01株与国内流行株CH/HNAY/2015同源性最高,分别为98.3%和98.7%,系统发育分析显示这2个毒株均属于国内流行的GⅡb群(图2a);S基因核苷酸序列分析显示CH-HNKF-03分离毒株S基因全长与中国近年流行毒株CH/HNAY/2015、PEDV-WS等一致,大小均为4 161 bp,CH-HNPDS-01分离株S基因全长4 158 bp,与AJ1102、GD-A等一致。CH-HNKF-03和CH-HNPDS-01株与PEDV-WS株同源性最高分别为98.6%和98.4%,系统发育分析显示这2个毒株均属于国内流行的GⅡb群,与全基因组系统发育分析一致(图2b);2株分离株ORF3基因全长均为675 bp,其中CH-HNKF-03株与SD2014株同源性最高为95.6%,CH-HNPDS-01株与CHGD-01株同源性最高为98.7%,系统发育分析显示CH-HNKF-03毒株形成单独分支(图2c);CH-HNPDS-01和CH-HNKF-03株E基因与参考毒株核苷酸同源性分别为93.9%~99.0%和94.2%~95.1%,系统发育分析显示CH-HNPDS-01与早期经典毒株CV777、DR13等处于同一个分支,CH-HNKF-03与SD2014处于同一个分支(图2d);M基因同源性比对显示CH-HNPDS-01和CH-HNKF-03毒株与参考毒株核苷酸同源性分别为95.5%~98.8%和96.4%~99.4%,系统发育分析显示,CH-HNPDS-01与GD-A、AJ1102等毒株处于同一分支,CH-HNKF-03与CH/BJ9/2015处于同一分支(图2e);N基因同源性比对显示,CH-HNPDS-01和CH-HNKF-03毒株与参考毒株核苷酸同源性分别为95.6%~97.7%和94.9%~99%,系统发育分析显示CH-HNPDS-01形成一个单独分支,CH-HNKF-03与CH/HNAY/2015、PE-DV-WS等处于同一分支(图2f)。
2.4 致病性试验试验组仔猪攻毒后出现呕吐、粪便呈液体伴腥臭味、采食量锐减、精神萎靡、站立不稳、被毛粗乱、消瘦等症状。2组试验组仔猪在攻毒4 d后均全部死亡,阴性对照组仔猪正常。对仔猪进行剖检,发现试验组仔猪小肠肠壁变薄充血、胀气,内有黄色水样粪便和未消化凝乳块。致病性试验表明CH-HNKF-03 和 CH-HNPDS-01 毒株均具有高致病性。
3 讨论
由于PEDV基因组的点突变、插入突变和缺失突变频繁发生,这导致了我国PEDV流行株的遗传具有多样性[17-18]。同时PEDV不同流行株之间的毒力及免疫力也有所不同,使得目前使用的商业化PEDV疫苗无法对各种流行变异株提供完全保护[8,19]。自2010年我国首次报道GⅡb亚型毒株引起的PED暴发以来,该亚型在所有PEDV分离株占比逐年增加,近几年达到了90%以上[10-11,20]。同时,PEDV GⅡb毒株研发的疫苗相比传统市售疫苗能够提供更好的同源保护[21-22]。因此,目前PEDV GⅡb亚型流行毒株研发新型疫苗对防控猪流行性腹泻意义重大。毒株分离是疫苗研发的重要环节,但是PEDV体外分离培养非常困难,这一定程度上掣肘了新型疫苗的研发速度。PEDV体外分离培养困难的原因主要有2点:(1) 实验室培养的细胞环境无法完全模拟猪肠道环境。(2)猪肠道组织内含毒素及毒株培养需要一定的胰酶作用,这都会导致细胞状态很差甚至死亡,从而影响PEDV的分离培养。本研究从疑似暴发PED的河南规模化养殖场收集病料,将鉴定PEDV为唯一病原体的病料进行PEDV分离,根据HOFMANN等[23]以及KUSANAGI等[24]的方法,应用Vero细胞上成功地分离到PEDV CH-HNKF-03和CH-HNPDS-01毒株,其分别在第3代和第5代出现典型细胞病变,这与PAN等[25]在同一细胞中第7代观察到CPE,和HOFMANN等[23]第1代就观察到了CPE有一定差异,可能是因为Vero细胞对不同PEDV分离株的敏感性不同。
为了解分离株的基因特征,对CH-HNKF-03和CH-HNPDS-01株进行全基因组测序,并从全基因组水平和部分基因水平分析PEDV毒株之间的系统发育关系。结果显示,本研究中分离株全基因组及S基因系统发育分析显示均属于GⅡb亚型,差异最大的基因是S和ORF3基因,E、M、N基因同源性较高,相对比较保守,与LIU等[26]、DIEP等[27]研究结果一致。PEDV N基因高度保守,可在感染细胞中大量表达N蛋白,并且在感染初期即可产生高水平抗N蛋白抗体,N蛋白的这种特性使其成为诊断PEDV的理想靶抗原[28]。本研究CH-HNPDS-01毒株N基因形成一个单独分支,其影响还有待进一步研究。致病性试验结果显示1日龄仔猪感染CH-HNKF-03和CH-HNPDS-01毒株后,18 h即可发病,在24~56 h仔猪均出现典型的液体腹泻、呕吐、消瘦、脱水等症状,并在96 h内全部死亡,说明CH-HNKF-03和CH-HNPDS-01株对仔猪具有高致病性。
综上,本研究分离出2株可在Vero细胞上有效增殖并能稳定传代的PEDV GⅡb亚群变异毒株(CH-HNKF-03和CH-HNPDS-01),其与我国近年流行毒株遗传关系最近,同时对哺乳仔猪具有高致病性,这为PEDV的遗传演化提供了参考以及后续PEDV新型高效疫苗的研发提供了候选毒株。

