一株大熊猫源唾液联合乳杆菌对DSS 诱导小鼠结肠炎的预防作用研究
杨宇,张沁荣,谢佶芹,谢军金,王黎明,郑丽君,张文平 ,岳碧松
(1. 四川大学生命科学学院生物资源与生态环境教育部重点实验室,成都 610065;2. 南京师范大学生命科学学院,南京 210023;3. 成都大熊猫繁育研究基地,四川省濒危野生动物保护生物学重点实验室,成都 610081)
溃疡性结肠炎是以直肠、结肠黏膜和黏膜下层的炎症和溃疡形成为病理特点的非特异性炎性肠病,多呈反复发作的病程,在人和动物中均较常见(Okayasu & Mainka,1990)。大熊猫Ailuropoda melanoleuca的肠道疾病一直被研究者们认为是造成其死亡的重要原因之一,由细菌引发的肠道疾病尤为严重,任何一种或者多种肠道微生物的变化都可能引起一系列的消化功能紊乱甚至疾病(Qiuet al.,1993;Azizet al.,2013)。引起大熊猫肠道疾病的病原菌包括大肠杆菌Escherichia coli、魏氏梭菌Clostridium welchii、铜绿假单胞菌Pseudomonas aeruginosa、小肠结肠炎耶尔森氏菌Yersinia enterocolitica和肺炎克雷伯氏菌Klebsiella pneumoniae等(孙飞龙等,2002)。条件致病菌大肠杆菌在大熊猫生活环境变化等情况下会大量滋生,引起大熊猫腹泻;肺炎克雷伯氏菌感染会导致大熊猫肠炎,体重减轻,排粘、便血等,严重时引起大熊猫死亡。王成东等(2006)报道一亚成年大熊猫因大肠杆菌和肺炎克雷伯氏菌合并感染出现败血症而死亡。目前为止还缺乏安全有效的治愈药物。
肠道微生物不是单独存在的,不同种类间具有复杂的网络关系,相互依赖、相互制约形成一种微生态平衡(Belkaid & Harrison,2017)。尽管溃疡性结肠炎的发病原因尚不清楚,但越来越多证据表明,肠道共生菌群可以促进肠道内环境的平衡,调节宿主的免疫系统,增强肠道黏膜的屏障功能和肠上皮细胞的代谢活性;病原微生物的入侵会导致肠道微生态系统的紊乱,破坏肠道菌群之间的平衡(张开,2017)。肠道菌群通过多种机制参与机体的能量代谢,包括对不能被消化的膳食纤维等的酵解(淀粉或寡糖)、肽类或蛋白质的无氧酵解、结合胆汁酸的生物转化、草酸盐复合物的降解及一些维生素的合成(维生素B12 和维生素K),菌群失调可导致能量代谢紊乱(Nicholsonet al.,2005);同时菌群失调可造成肠道黏膜免疫异常,全身免疫系统及肠道黏膜免疫的建立和成熟有赖于肠道细菌的定植和菌群的形成,肠相关淋巴组织起到了对肠道原籍菌群的耐受和对病原菌的免疫反应的作用。各种原因导致肠道黏膜屏障功能减弱,其对菌群的免疫反应调控就会出现问题,继而引起局部甚至全身的免疫反应紊乱(潘照等,2015),进一步导致病原菌作用于肠道黏膜及其下的淋巴组织,从而引发结肠炎。近年来,乳杆菌Lactobacillusspp.作为安全有效的饲料添加剂,因能够提高动物的生产性能、免疫功能与肠道黏膜形态而受到了广泛的关注和认可(唐仁龙,2019)。乳杆菌可通过诱导黏液素分泌、阻止上皮细胞凋亡、产生可溶性肽等机制,增强上皮细胞的屏障功能;也能减少致病菌对肠道上皮细胞的黏附和侵袭(Wineet al.,2009)。如口服植物乳杆菌L. plantarumK68 可通过抗炎和免疫调节活性来改善小鼠的实验性结肠炎(Liuet al.,2011)。L. plantarum-12 可通过增加乳杆菌和减少致病菌来恢复肠道菌群平衡,并通过激活Janus 激酶信号转导子和转录激活子来提高免疫力、增强肠道屏障功能,从而减轻结肠炎小鼠的发病症状(Sunet al.,2020);L. casei也可使由2,4,6-三硝基苯磺酸/无水乙醇的混合物诱发结肠炎的小鼠结肠组织病理学评分和脂质过氧化明显改善,从而进一步缓解结肠炎的发作(Ghasemi-Niriet al.,2011)。乳杆菌在预防和治疗腹泻的有效性方面得到了大量的验证(Kimet al.,2018;Liet al.,2019;Yueet al.,2020)。
唾液联合乳杆菌Ligilactobacillus salivarius103是成都大熊猫繁育研究基地实验室从健康大熊猫新鲜粪便样品中分离筛选得到的优良菌株,具有生物特性好、抑菌效果明显、不含耐药基因等特点(王黎明等,2019)。本研究采取先用菌悬液灌胃、再用葡聚糖硫酸钠(dextran sulphate sodium,DSS)诱导小鼠结肠炎的方法,评估唾液联合乳杆菌103对结肠炎的预防作用,为其在圈养大熊猫种群中的应用打下基础。
1 材料和方法
1.1 唾液联合乳杆菌
从成都大熊猫繁育研究基地实验室冻存管中取唾液联合乳杆菌103菌液1 mL于200 mL的MRS肉汤培养基中,37 ℃扩培24 h,用生理盐水调整浓度到1×109cfu·mL-1。
1.2 主要试剂
DSS[分子量:36 000~50 000;翌圣生物科技(上海)股份有限公司],白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的酶联免疫ELISA 试剂盒(江苏晶美生物科技有限公司),髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒(南京建成生物工程研究所),MRS 培养基(青岛高科技工业园海博生物技术有限公司)。
1.3 动物实验
急性结肠炎造模是常用的结肠炎模型之一,因其制备简单、成功率高,且与人类结肠炎病变相似,是研究急性结肠炎发病机制和评估药物疗效较为理想的模型。急性造模一般采用较高浓度的DSS 建立,给药时间较短,给予3%~5%DSS 自由饮用1 周即可(http://www.bioon.com.cn/)。本研究选择的实验动物为4周龄SPF级C57BL/6J雄性小鼠,体重22~25 g,由成都达硕动物实验有限公司提供,实验动物生产许可证号:SCXK(川)2020-030,动物试验由成都大熊猫繁育研究基地动物保护与使用委员会(IACUC)批准并监督(批准号:202015)。将27只小鼠随机均分为对空白对照组、DSS模型组和唾液联合乳杆菌处理组,每笼3 只。适应饲养1 周后,唾液联合乳杆菌处理组灌胃唾液联合乳杆菌103 菌悬液14 d,活菌浓度为109cfu·mL-1,每天每只200 µL,空白对照组和DSS 模型组每只每天灌胃200 µL 生理盐水。灌胃14 d 后,DSS 模型组和唾液联合乳杆菌处理组自由饮用3%DSS 水溶液,空白对照组自由饮用超纯水,7 d 后用颈椎脱臼法处死小鼠,剖腹,取肛门至回盲部的结肠并用游标卡尺测量结肠长度(精度为1 mm),剪取中段约1 cm 结肠,用生理盐水清洗后迅速固定于4%甲醛溶液中,石蜡包埋切片,HE染色,光镜下观察。
1.4 造模成功标准
7 d造模周期结束后,以小鼠体重下降10%、出现血便作为建模成功的标准(李富凤等,2015)。
1.5 血清炎症因子检测
ELISA 法测定小鼠血清中的IL-6、TNF-α 含量和MPO活性,按ELISA试剂盒说明书进行。
1.6 数据分析
采用Graphpad Prism 8.0 进行统计分析,用单因素方差分析比较各组间的差异。数据采用xˉ±SD表示,显著性水平设置为α=0.05。
2 结果
2.1 症状观察及体重变化
空白对照组和唾液联合乳杆菌处理组在7 d造模期间的体重保持基本稳定或略有增长,而DSS模型组体重下降13.65%(表1)。造模结束时,DSS模型组全部出现严重便血、腹泻、蜷缩成堆、精神萎靡、毛色无光、大便松散、饮水量减少等现象;而唾液联合乳杆菌处理组症状明显减轻,仅1只出现明显症状。
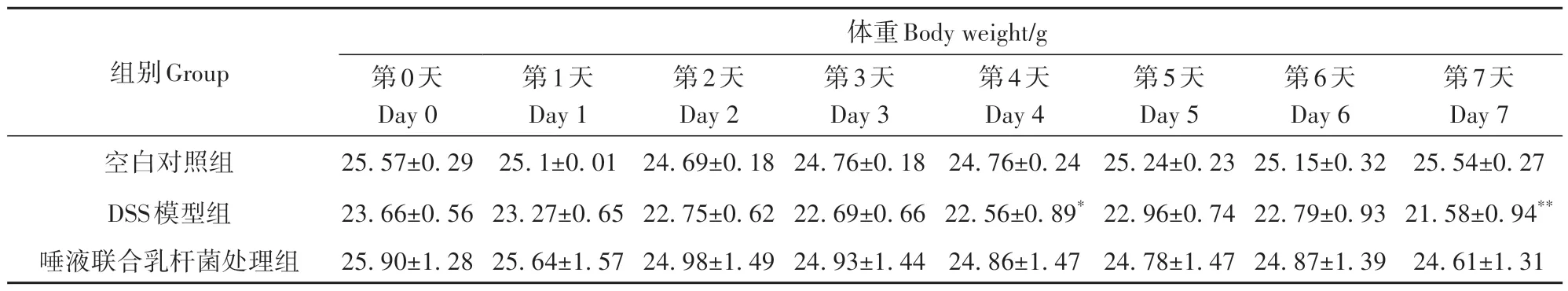
表1 造模期间小鼠体重变化Table 1 Changes in body weight of mice during modeling
2.2 结直肠长度
DSS 模型组的平均长度为7.37 cm±0.12 cm,空白对照组的平均长度为8.65 cm±0.36 cm;唾液联合乳杆菌处理组的平均长度(8.25 cm±0.23 cm)明显大于DSS模型组的(图1:A)。
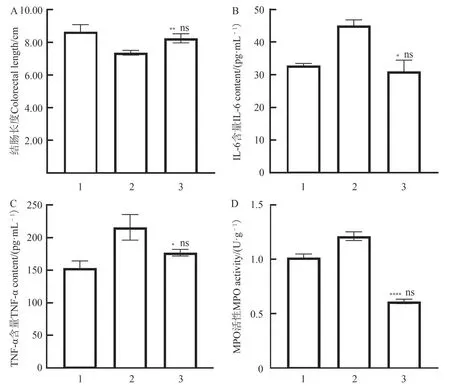
图1 造模期结束时小鼠的各项指标对比Fig. 1 Comparison of different indexes of the mice at the end of modeling
2.3 血清炎症因子含量
DSS 模型组的IL-6 和TNF-α 含量比空白对照组显著上升,唾液联合乳杆菌处理组的IL-6 和TNF-α含量明显低于DSS模型组(图1:B,C)。
2.4 MPO活性
与空白对照组相比,DSS 模型组的MPO 活性显著增加(P<0.000 1);与DSS 模型组相比,唾液联合乳杆菌处理组的MPO 活性降低,但差异不显著(图1:D)。
2.5 病理组织切片观察
空白对照组的结肠组织结构完整,黏膜层、黏膜下层、肌层和外膜分层明显,细胞排列整齐,未见病理变化。而DSS模型组的黏膜层变性坏死,坏死区域形态结构模糊,上皮明显脱落、缺失,固有层内肠腺结构基本不见,杯状细胞消失,坏死区域或萎缩肠腺周围可见淋巴细胞或中性粒细胞聚集,局部黏膜下层水肿伴轻微炎细胞浸润,表明具有严重的炎症反应。唾液联合乳杆菌处理组的组织黏膜层轻微受损,局部肠腺萎缩,体积减小,周围结缔组织内可见淋巴细胞聚集,表现出局部炎症反应,但严重程度比DSS模型组明显减轻(图2)。
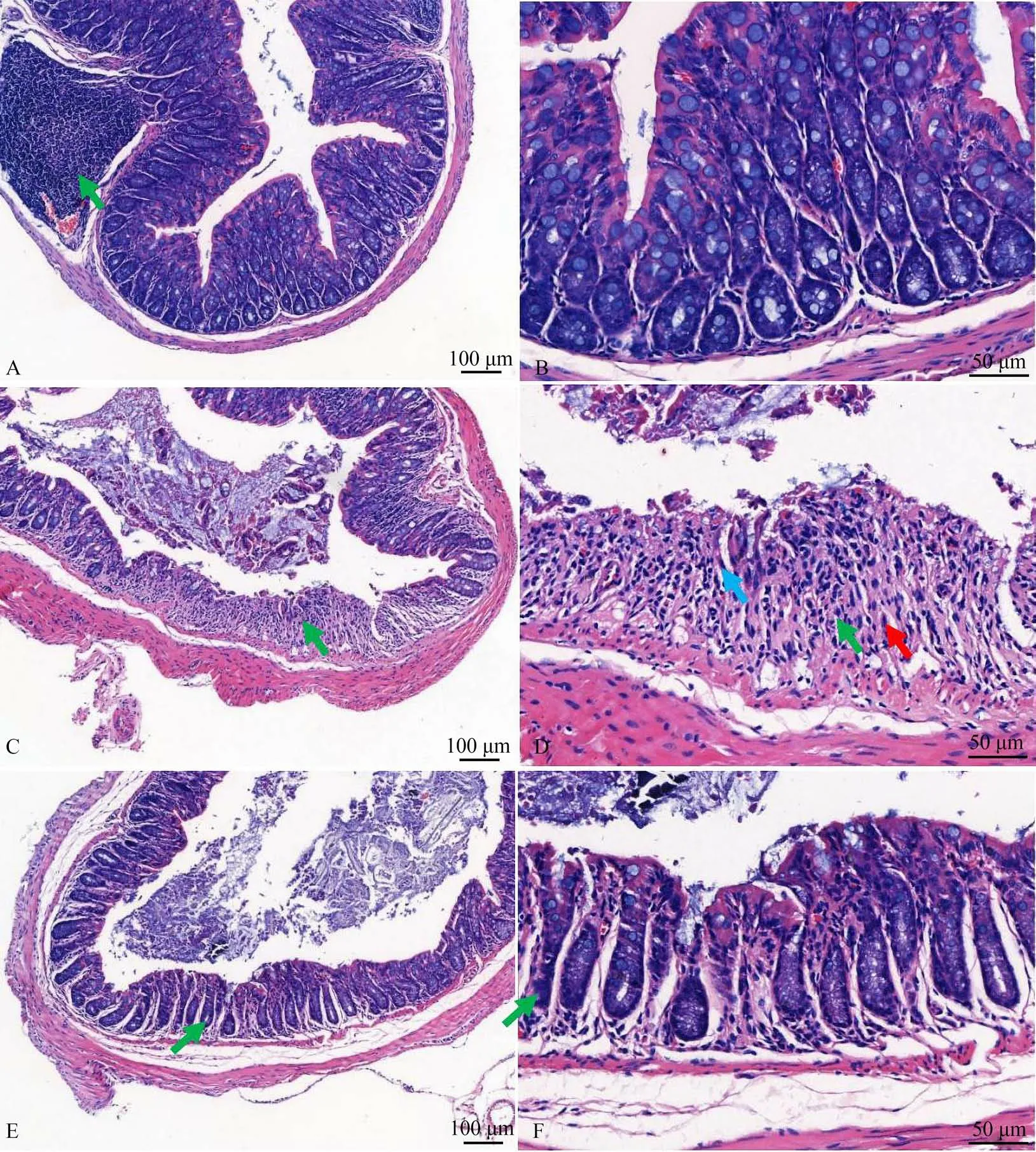
图2 小鼠结肠HE染色对比Fig. 2 Comparison of HE staining in the colon of mice
5 讨论
溃疡性结肠炎是一种慢性炎症性疾病,发病机制尚不清楚(Bohl & Sobba,2015)。目前益生菌已成为治疗结肠炎的研究热点,其中,乳杆菌被广泛研究,其能够通过抑制病菌、调整肠胃微生物的多样性、产生生态天然屏障来维持肠道平衡。研究表明,乳杆菌可以通过增加有益肠道菌群如阿克曼氏菌Akkermansia muciniphila、乳杆菌属和双歧杆菌属Bifidobacteriumsp.,减少有害菌群如埃希氏菌属Escherichia,从而改善宿主结肠炎(Wanget al.,2016;Maet al.,2020)。最近浙江大学李兰娟院士团队研究发现,唾液联合乳杆菌Li01(CGMCC7045)的摄入能够促进结肠炎小鼠肠道菌群结构和肠道屏障功能的恢复,并展现出潜在的抗炎作用(Feiet al.,2022);同时也有研究表明唾液联合乳杆菌在处理小鼠巨噬细胞的脂多糖中表现出更高的胃肠道条件耐受性和更显著的抗炎作用(翟齐啸等,2020)。
本研究探讨了大熊猫源唾液联合乳杆菌对DSS诱导的结肠炎小鼠预防作用及其机制,采用了来自大熊猫肠道的益生菌,而非常规的肠道菌群,这为开发针对大熊猫肠道疾病的益生菌制剂提供了新的方向。王黎明等(2019)完成了对唾液联合乳杆菌103 耐酸耐盐、抑菌实验、药敏实验的体外筛选,但并没有进行小鼠的体内动物实验进行验证。本研究探究了大熊猫源唾液联合乳杆菌103的作用机理,并进行动物体内实验,通过抑制炎症介质的表达,促进保护性黏蛋白的增加,从而减轻结肠炎症反应,降低结肠组织损害。由此可见,大熊猫源唾液联合乳杆菌103 能够有效改善溃疡性结肠炎,在溃疡性结肠炎出现时,能在一定程度上减轻结肠炎的不良反应,可能具有较好的安全性。
本研究通过探究大熊猫肠道益生菌的治疗作用,为治疗大熊猫肠道疾病提供了新的思路,并为研究其他动物肠道菌群的应用提供了启示。值得注意的是,未来需要进一步研究该菌株在不同病理状态下的治疗效果,并对该菌株的安全性进行评估。

