石榴叶多糖的提取工艺优化及体外活性分析
杨宇航 杨子青 许海旭 刘恩岐 崔 珏 赵南南
(徐州工程学院食品与生物工程学院,江苏 徐州 221018)
近年来,植物多糖由于其多种药理活性和药用价值,且几乎无毒副作用而愈发受到关注。大量研究表明,多糖的生物活性主要包括免疫调节、抗氧化、抗肿瘤、保护肝脏等[1-3]。山药多糖通过调控Nrf2/HO-1抗氧化通路,降低炎性因子释放,从而缓解大鼠脑缺血再灌注损伤[4]。因此,对植物多糖的研究已成为行业热点。
石榴(Punica granatumL.)含有丰富的营养成分,其果皮、种子和叶还兼具药用价值。但石榴叶在工业生产中常作为废弃物。研究表明,植物叶中含有多种活性成分(多糖类、黄酮类、鞣质类等),能够促进畜禽的生长,提高免疫性能和抗氧化能力[5]及维持肠道微生态平衡[6]。石榴叶提取物具有抗炎[7]、缓解非酒精性脂肪肝[8]、预防肥胖[9]及抗菌[10-11]等功效。目前,关于石榴叶多糖(PLP)在畜禽生产中的应用较少。有研究表明,添加番石榴叶提取物能够降低仔猪腹泻率,提高仔猪抗氧化能力和免疫力[12]。对石榴叶潜在价值的探索研究,不仅降低了资源浪费,还能够促进石榴叶资源深度开发利用,对石榴产业持续健康发展具有重要意义。本研究以石榴叶为原料提取PLP,优化超声波法提取工艺条件;通过体外试验评估PLP 的抗氧化活性和抗炎功效,为PLP 在畜牧养殖业中的开发与利用提供参考。
1 材料与方法
1.1 试验材料与仪器
石榴叶购自徐州惠春堂药店,60 ℃烘干粉碎,过80目筛,保存。
DPPH 和ABTS 试剂购自国药集团化学试剂有限公司,一氧化氮检测试剂盒、RIPA裂解液和BCA蛋白浓度试剂盒购自上海碧云天生物技术有限公司,COX2、iNOS、NF-κB p-p65和p-IκB抗体购自proteintech生物公司,肿瘤坏死因子-α (TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的ELISA 试剂盒购自上海酶联生物科技有限公司。
7230G 可见分光光度计(上海精密科学仪器有限公司),RE-201D 旋转蒸发仪(常州华特仪器有限公司),HH-8 数显式恒温水浴锅(常州市万丰仪器制造有限公司),XO-SM100 超声-微波协同反应工作站(南京先欧仪器制造有限公司),Min P4 蛋白质电泳仪、VersaDoc 4000MP化学发光成像系统(美国伯乐仪器)。
1.2 PLP提取条件优化
1.2.1 PLP含量测定方法
本文采用苯酚-硫酸法测定PLP中多糖含量。以葡萄糖为标准品,检测在470 nm 处吸光度值,绘制标准曲线,拟合方程为y=0.019 2x+0.058 9,R2=0.996 9。PLP多糖得率为:
1.2.2 单因素试验
分别考察液料比(15、20、25、30、35 mL/g)、超声功率(70、100、130、160、190 W)、超声时间(5、10、15、20、25 min)和水浴温度(40、50、60、70、80 ℃)对PLP多糖得率的影响。
1.2.3 响应面优化方案
基于单因素试验结果,以多糖得率为响应值,采用Box-Behnken Design 响应面试验设置4 因素3 水平设计,研究得出PLP 多糖得率的优化条件。试验因素与水平设计见表1。
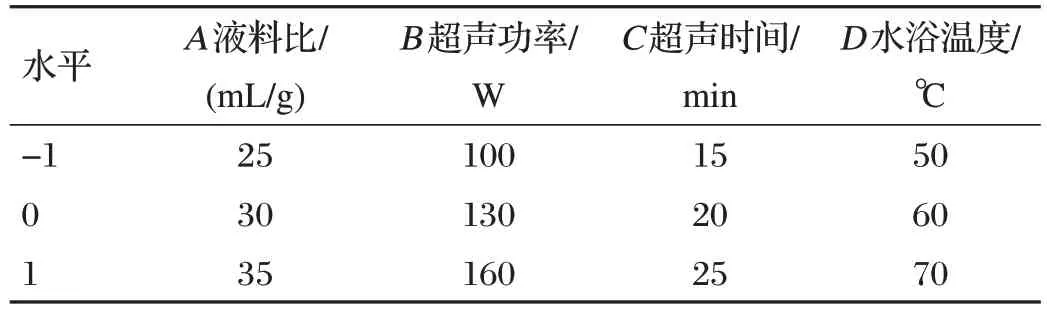
表1 试验因素与水平设计
1.3 体外抗氧化分析试验
1.3.1 DPPH自由基清除率
参考郭育东等[13]和Cao等[14]方法,对PLP进行去蛋白脱色处理,冷冻干燥,获得精制多糖。取0、0.2、0.4、0.6、0.8 g/L粗PLP 1 mL分别加入2 mL 0.2 mmol/L DPPH溶液,充分混匀,37 ℃水浴30 min,517 nm 测定吸光度。以去离子水作为空白对照,VC作为阳性对照组。
式中:A0为去离子水的空白对照的吸光度;A1为样品和DPPH的吸光度;A2为样品和去离子水的吸光度。
1.3.2 ABTS清除率测定
取不同浓度粗PLP,加入ABTS溶液200 μL。充分混合,在温度较低且光线较暗的情况下放置1 h,734 nm处测量吸光度。无水乙醇作为空白对照,VC 作为阳性对照组。
式中:A0为无水乙醇的吸光度;A1为样品和ABTS的吸光度;A2为样品和无水乙醇的吸光度。
1.4 体外抗炎活性试验
1.4.1 细胞培养
将小鼠巨噬细胞RAW264.7 培养在含有10%胎牛血清和1%双抗的DMEM完全培养基中,在37 ℃、5% CO2的恒温培养箱中培养。待细胞长满后,按照1∶3的比例进行传代培养。
1.4.2 NO检测和酶联免疫吸附(ELISA)试验
在6 孔板中加入1×105RAW264.7 巨噬细胞,在37 ℃、5% CO2条件下培养。待细胞融合至80%左右时,加入不同质量浓度的PLP(0.2、0.5、1.0 g/L,分别作为低、中、高剂量)预处理2 h,加入1 mg/L的脂多糖LPS溶液刺激处理,培养22 h。参考说明书,取50 μL细胞上清液,按照Griess法检测NO的含量。取细胞上清液采用ELISA试剂盒检测TNF-α、IL-1β和IL-6含量。
1.4.3 蛋白免疫印迹试验
按照1.4.2 进行药物处理24 h 后,6 孔板每孔RAW264.7巨噬细胞加入200 μL RPIA裂解液,冰上裂解15 min;4 ℃,12 000 r/min离心5 min;采用BCA法进行蛋白质浓度测定和校正。通过SDS-PAGE 凝胶检测COX2、iNOS、NF-κB p-p65和p-IκB的蛋白含量,采用Image J软件进行图像分析。
2 结果与分析
2.1 PLP提取的单因素试验结果(见图1)
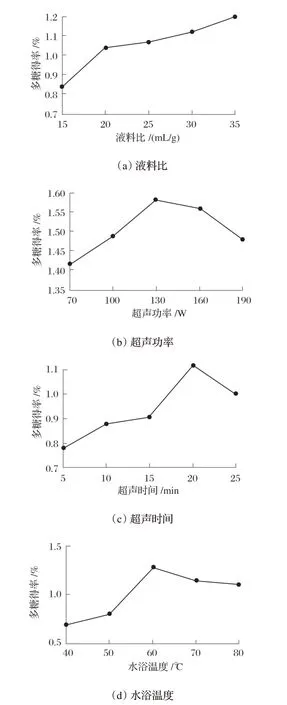
图1 不同提取因素对PLP得率的影响
由图1(a)可知,随着液料比升高,PLP 的得率呈现逐步上升的趋势,在液料比为35 mL/g时,得率达到最高,主要是因为溶液增加了多糖在水中的溶解量,但由于本试验中液料比处于持续上升趋势,若选取液料比35 mL/g无法判断后续PLP得率的变化趋势,故考虑将最佳液料比前移至30 mL/g。由图1(b)可知,PLP得率从70 W 到130 W 逐步升高,在130 W 时达到顶峰;超过130 W 后,呈现下降趋势,主要原因可能是功率过高导致PLP降解。由图1(c)可知,5~20 min,PLP得率逐步提高,随后时间延长呈逐步降低趋势,这可能是由于超声时间过长导致能量过强(包括机械力和热效应)引发多糖降解。由图1(d)可知,当温度在40~60 ℃,PLP得率呈现升高走势,之后温度升高PLP 得率走势下降,可能原因是温度过高破坏了多糖的结构导致溶解降低。综上所述,选择液料比30 mL/g、超声功率130 W、超声时间20 min 及水浴温度60 ℃作为响应面优化方案的中心值。
2.2 PLP多糖提取的响应面优化结果(见表2、表3)
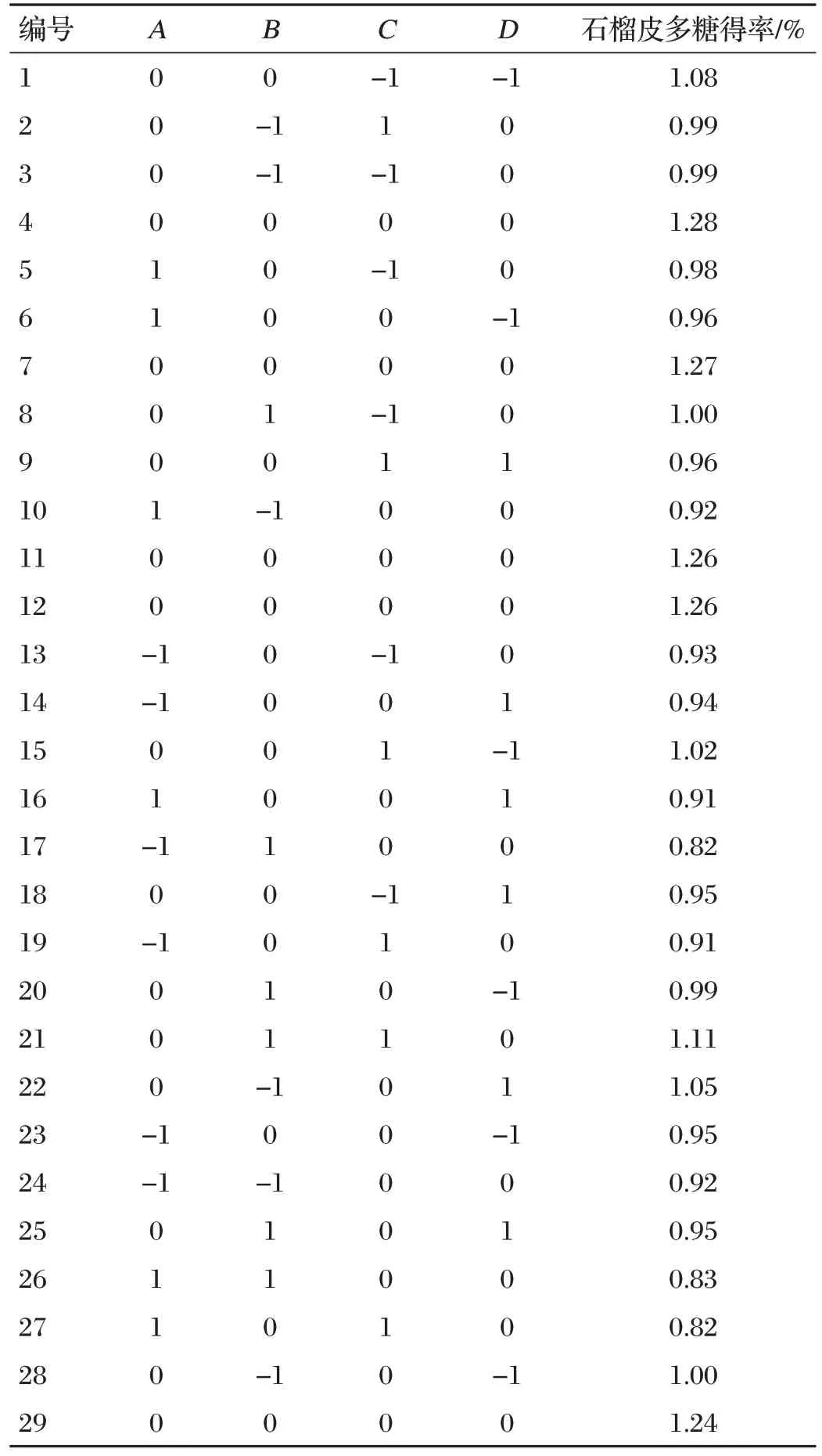
表2 响应面分析结果
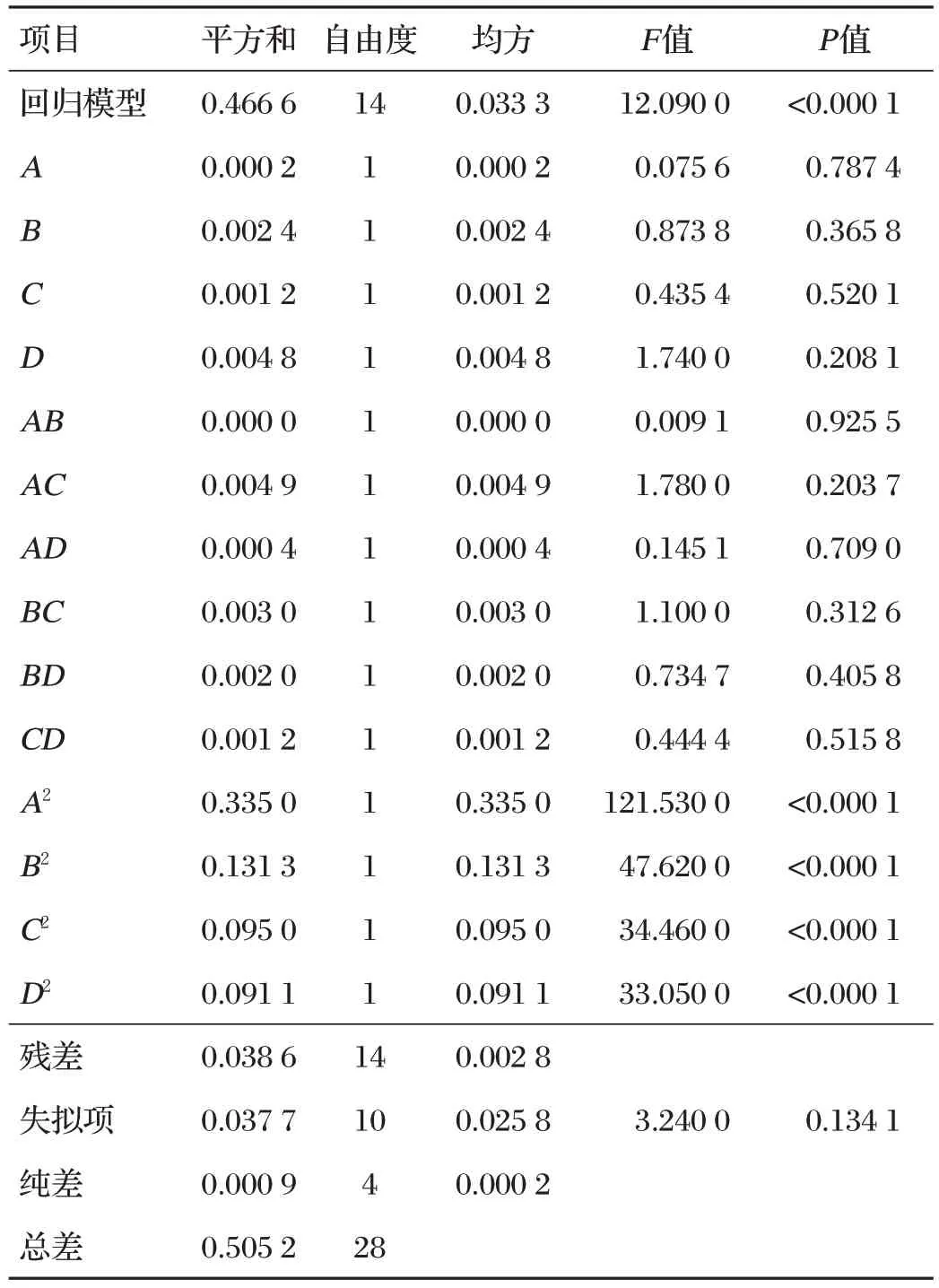
表3 回归模型方差分析
采用Design-Expert 12软件对试验结果进行分析,得到多元二次回归方程:Y=1.26-0.004 2A-0.014 2B-0.01C-0.02D+0.002 5AB-0.035AC-0.01AD+0.027 5BC-0.022 5BD+0.017 5CD-0.227 2A2-0.142 2B2-0.121C2-0.118 5D2。
根据表3 回归模型方差分析结果可知,回归模型P<0.000 1,方差显著;失拟项P>0.05,方差不显著,表明本试验的回归方程可靠,可对PLP 提取工艺进行优化预测。此外,由表3的F值和P值可知水浴温度和超声功率对PLP的提取影响最大,其次是超声时间和液料比。
通过响应面分析可知,最佳优化方案为液料比29 mL/g、超声功率128.47 W、超声时间19.73 min、水浴温度59.19 ℃,此时理论上PLP 的得率为1.26%。根据实际试验条件调整为液料比30 mL/g、超声功率128 W、超声时间20 min、水浴温度60 ℃。试验重复5 次后,实际值为1.27%,与理论预测值相近,表明优化后模型参数可靠,制备工艺可行。
2.3 PLP体外抗氧化结果(见图2)
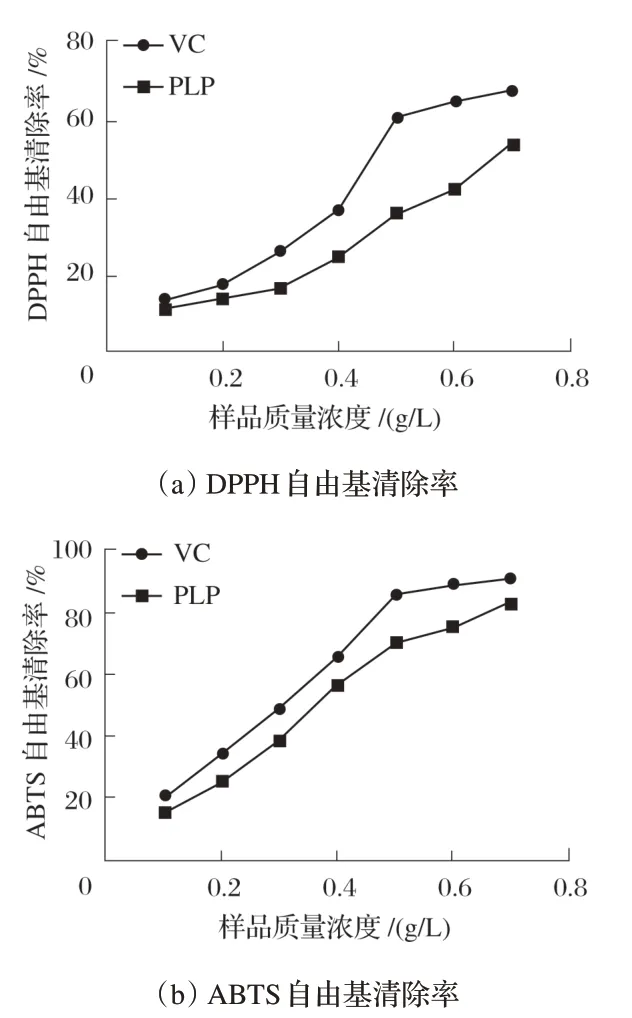
图2 PLP的DPPH自由基和ABTS自由基清除能力
为了解PLP 的抗氧化能力,进行了DPPH 自由基和ABTS自由基清除试验。结果表明,随着PLP质量浓度的增加,DPPH 自由基和ABTS 自由基的清除率显著上升,呈剂量依赖性关系;其中PLP 和VC 对DPPH 自由基的IC50值分别是0.71、0.46 g/L,对ABTS自由基的IC50值分别是0.34、0.27 g/L;清除活性顺序是ABTS>DPPH,且PLP对两者的清除活性均显著低于VC溶液。
2.4 PLP体外抗炎作用(见图3、图4)

图3 PLP对LPS刺激的RAW 264.7细胞NO、TNF-α、IL-1β和IL-6含量的影响
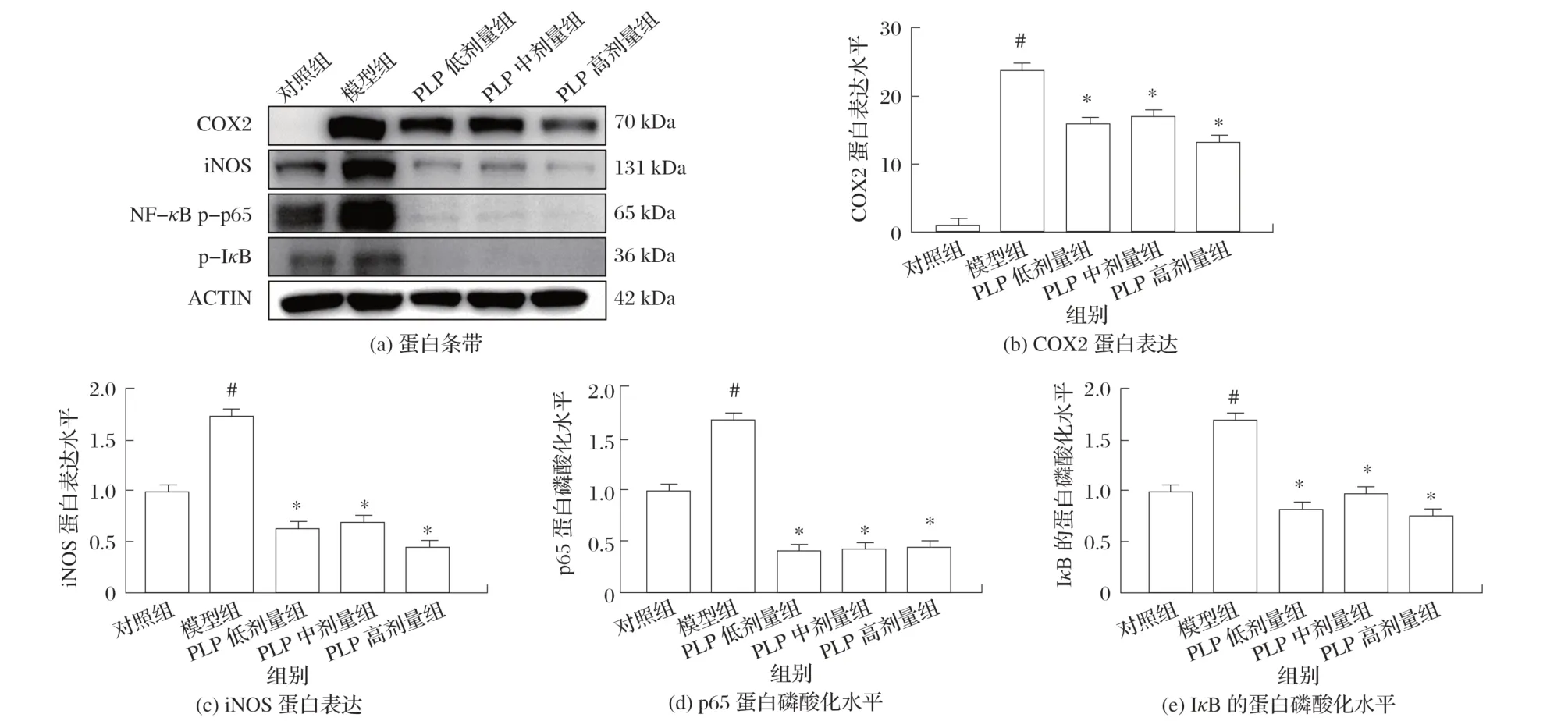
图4 PLP对LPS刺激的RAW 264.7细胞炎性相关蛋白表达的影响
为进一步明确PLP 的活性,体外采用脂多糖(LPS)刺激RAW264.7 巨噬细胞诱导炎性反应,观察PLP 的抗炎功效。LPS刺激能够显著促进NO释放,然而PLP能够逆转LPS促进NO释放现象(P<0.05)。
由图3中ELISA 试验分析发现,随着PLP 浓度增加,LPS 产生的TNF-α、IL-1β 和IL-6 的含量呈剂量依赖性减少(P<0.05)。
采用Western blot 法检测PLP 对LPS 刺激的RAW 264.7 细胞炎性相关蛋白的影响。由图4 可知,添加PLP能够缓解LPS诱导的COX2和iNOS蛋白过表达,进而影响NO 的分泌。NF-κB 信号通路在炎症的发生中起到重要作用,其中p65 能够作为转录因子调控多种促炎因子的表达(如TNF-α、IL-1β和IL-6等);添加PLP能够降低LPS所致的p65和IκB的磷酸化水平,表明PLP可能通过NF-κB信号通路发挥抗炎作用。
3 讨论
本试验以石榴叶为原料,采用单因素试验结合响应面方法优化了超声波提取PLP 的工艺条件,结果表明,影响PLP提取率的主次顺序依次是水浴温度、超声功率、超声时间和液料比,优化后的最佳工艺条件为液料比30 mL/g、超声功率128 W、超声时间20 min、水浴温度60 ℃,PLP得率是1.27%,与预测值相吻合。Luo等[15]研究表明,超声功率404 W、提取温度62 ℃、超声时间20 min时,番石榴叶多糖最佳得率为1%,与本试验结果比较接近。此外,景年华等[16]以枇杷叶为原料提取枇杷叶多糖,采用超声辅助提取,经响应面法得出超声浸提温度60 ℃、超声浸提时间150 min、超声功率450 W 及液料比20 mL/g为最佳提取工艺,得率为0.71%。而以石榴皮为原料提取多糖,在液料比23 mL/g、提取时间62 min、提取温度57 ℃、超声功率为145 W 的最佳提取条件下,得率为13%[17];以乙醇浓度91%、液料比42 mL/g、提取时间62 min、提取温度96 ℃为最佳提取条件,得率为16%[18]。此外,采用复合酶法获得石榴籽最佳提取得率是2.01%[19]。结果表明,同一植物不同部位所含有的多糖含量有所差异。
本试验抗氧化试验结果表明,PLP 具有很强的清除自由基能力,对DPPH 和ABTS 的IC50值分别是0.71、0.34 g/L,对ABTS的清除活性大于DPPH,与文献[20]报道结果一致。此外,体外细胞抗炎试验结果表明,PLP能够抑制LPS 刺激的RAW264.7 巨噬细胞NF-κB 信号通路,降低p65的磷酸化水平,进而减少促炎因子(TNF-α、IL-1β 和IL-6)释放,最终减少炎性反应;也有可能是通过影响iNOS 的表达而抑制细胞内NO 的产生。最近研究表明,PLP 能够改善糖尿病小鼠总抗氧化能力,缓解肝脏、肾脏和胰腺的损伤[21]。此外,石榴叶的其他成分也具有相似的作用,石榴叶的水醇提取物能够缓解LPS诱发的小鼠急性肺损伤,降低TNF-α和白蛋白水平,提高IL-10的含量;恢复LPS刺激诱导的RAW264.7巨噬细胞NO 含量及IL-1β、IL-6 和IL-10 的mRNA 表达[22]。此外,石榴叶的乙醇提取物呈剂量依赖性地降低LPS 刺激的RAW264.7 细胞COX2 和iNOS 蛋白表达,调控炎性因子的分泌[23]。Chu等[24]研究表明,石榴叶水提物能够通过调节肝脏中的葡萄糖代谢以及恢复肠道微生物菌群的平衡,从而缓解2 型糖尿病的高血糖和胰岛素抵抗。而且石榴叶三萜类提取物能够调控NF-κB信号,减轻糖尿病周围神经性病变[25]。尽管本试验中PLP 提取率较低,但研究发现PLP 具有很强的抗炎、抗氧化等作用,而且提取流程所需设备操作技术简单、投资少,具有很大的开发价值。
4 结论
本研究以石榴叶为原料,通过响应面法优化PLP 的提取率,最佳提取条件为液料比30 mL/g、超声功率128 W、超声时间20 min、水浴温度60 ℃;在此条件下,PLP 得率是1.27%。体外抗氧化和细胞试验结果表明,PLP 具有较强的清除DPPH 自由基和ABTS 自由基的能力,能够缓解LPS 刺激的RAW264.7 细胞炎性反应,有可能是通过NF-κB 通路。后期还需要对PLP 的体内抗炎作用及分子机制进行进一步研究,本研究结果可为PLP的进一步开发利用提供参考。

