响应面法优化贝莱斯芽孢杆菌P9菌株生孢培养基及条件的研究
马 烁 刘 瑾 赵 华
(天津科技大学生物工程学院 天津市微生物代谢与发酵过程控制技术工程中心 工业发酵微生物教育部重点实验室 天津市工业微生物重点实验室,天津 300457)
贝莱斯芽孢杆菌(Bacillus velezensis)属于芽孢杆菌属,为革兰氏阳性细菌,菌体呈杆状,可产孢子,是广泛存在于环境中的多功能细菌[1-3]。贝莱斯芽孢杆菌具有来源广、易筛选、培养周期短、抗逆性强、能形成芽孢、耐酸、耐碱、耐高温、产酶丰富等优势[4-6]。目前,关于贝莱斯芽孢杆菌的研究主要集中在病害防控、抑菌活性物质、动物病原菌拮抗作用机制等方面,广泛应用于农业、食品等领域[7-10]。研究表明,贝莱斯芽孢杆菌可分泌丰富的木质纤维素降解酶,对纤维素酶的饲料化应用具有重要意义[11]。贝莱斯芽孢杆菌作为一种益生菌,可代替抗生素在水产及畜禽养殖中发挥积极作用[12-13]。本试验采用单因素分析及响应面分析方法,确定贝莱斯芽孢杆菌P9最适生孢培养基,对菌株的生孢培养基进行进一步优化,以提高产酶量以及酶活性,为其在动物饲料生产中应用提供参考。
1 材料与方法
1.1 菌株
贝莱斯芽孢杆菌(Bacillus velezensis)由天津科技大学工业发酵微生物重点实验室组内提供。
1.2 培养基
LB 培养基:酵母浸粉5.0 g/L、蛋白胨10.0 g/L、氯化钠10.0 g/L,pH 值为7.0。固体时添加琼脂20.0 g/L,121 ℃灭菌20 min。
DSM培养基[14]:葡萄糖10.0 g/L、L-谷氨酸1.0 g/L、酵母浸粉0.5 g/L、KH2PO41.0 g/L、(NH4)3PO41.0 g/L、MgSO40.2 g/L、NaCl 0.1 g/L、CaCl20.05 g/L、MnCl20.007 g/L、ZnSO40.01 g/L、FeSO40.01 g/L,pH值为7.0。
SBM 培养基[15]:葡萄糖1.04 g/L、KH2PO46.0 g/L、MgSO4·7H2O 0.59 g/L、蛋白胨5.0 g/L、NaCl 0.01 g/L、0.1 mol/L 的 FeSO4·7H2O 1.136 mL、 0.1 mol/L 的ZnSO4·7H2O 300 μL、 0.1 mol/L 的 CaCl29.9 mL、0.1 mol/L的MnCl230 mL,pH值为7.0。
改良NA 培养基[16]:MgSO4·7H2O 0.51 g/L、KCl 0.97 g/L、 CaCl20.2 g/L、 MnSO4·7H2O 3×10-3g/L、FeSO4·7H2O 0.55×10-3g/L,pH值为7.0。
合成生孢培养基[17]: FeCl20.003 6 mmol/L、MgCl20.041 mmol/L、MnCl20.1 mmol/L、NH4Cl 10 mmol/L、NaSO40.75 mmol/L、CaCl21 mmol/L、KH2PO40.5 mmol/L、NH4NO31.2 mmol/L、葡萄糖10 mmol/L、L-谷氨酸10 mmol/L,pH值为7.0。
1.3 试验方法
1.3.1 芽孢率测定
1.3.1.1 营养体的收集
防止菌体生长过程中出现结块,在摇瓶中加入3~4 颗灭菌的玻璃珠。将3%菌种接种于100 mL 或250 mL LB 培养基,30 ℃、160 r/min 摇瓶培养24 h,8 000 r/min离心10 min,收集沉淀。所得沉淀用无菌生理盐水重悬,混匀,8 000 r/min离心10 min,水洗,重复上述水洗步骤2次,再次离心得到水洗后的菌体。
1.3.1.2 生孢率计算
采用无菌生理盐水稀释涂布的方法测定培养基中的菌体数。稀释度为10-6、10-7、10-8菌液涂布于LB固体平板上,30 ℃倒置培养24 h,记录单菌落数量,得到的单菌落数为该稀释度下的菌体总数。将所得的培养液于80 ℃条件下水浴20 min,采用无菌生理盐水稀释涂布的方法测定芽孢数[18],稀释度为10-6、10-7、10-8的菌液涂布于LB 平板上,30 ℃倒置培养24 h,记录单菌落的数量,所得的单菌落数量即为孢子数。
1.3.2 基础培养基确定
按照1.3.1所述方法收集4×100 mL培养液内的菌体,所得菌体用4 mL 生理盐水重悬、混匀,分别吸取1 mL菌液转接于DSM 培养基、改良NA 生孢培养基、合成生孢培养基、SBM 培养基中,30 ℃、160 r/min 摇瓶培养48 h,测定培养48 h 后各培养基菌体数与孢子数,计算生孢率,确定最适的基础生孢培养基。
1.3.3 碳源对菌体生孢率的影响
1.3.3.1 碳源种类对生孢率的影响
可溶性淀粉、蔗糖、果糖、麦芽糖、葡萄糖作为唯一的碳源进行芽孢率的测定。收集各碳源培养液内的菌体,所得菌体使用5 mL生理盐水重悬、混匀,分别移取1 mL 菌悬液至100 mL 或250 mL 的不同种类的碳源基础培养基中,30 ℃、160 r/min 摇瓶培养48 h,测定不同培养基中的菌体数与孢子数,计算生孢率。
1.3.3.2 碳源含量对生孢率的影响
碳源含量设为0、0.1%、0.2%、0.3%、0.4%,收集5×100 mL 或5×250 mL 培养液内的菌体,所得菌体用5 mL 生理盐水重悬,混匀,分别移取1 mL菌液至100 mL或250 mL不同含碳量培养基中,30 ℃、160 r/min摇瓶培养48 h,测定培养基中的菌体数和孢子数,计算生孢率。
1.3.4 氮源对菌体生孢率的影响
1.3.4.1 氮源种类对生孢率的影响
牛肉膏、蛋白胨、酵母浸粉、胰蛋白胨、大豆蛋白胨、硫酸铵作为唯一氮源替换基础培养基的氮源制备氮源基础培养基。收集各氮源培养液内的菌体,所得菌体用6 mL 生理盐水重悬,混匀,分别移取1 mL 菌悬液至100 mL 或250 mL 的不同氮源种类的基础培养基中,30 ℃、160 r/min 摇瓶培养48 h,测定各培养基中的菌体数和芽孢数,计算生孢率。
1.3.4.2 不同氮源配比对生孢率的影响(见表1)
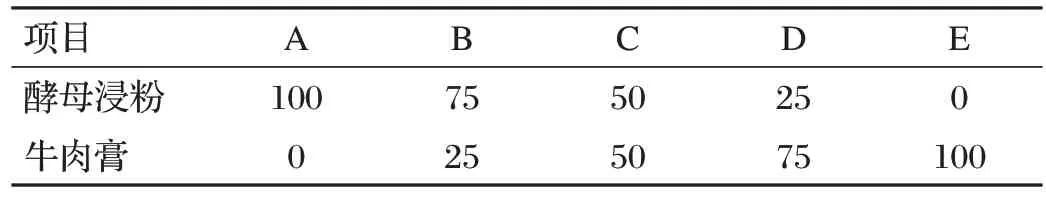
表1 不同氮源配比对生孢率的影响 单位:%
在已知上述确定条件下,分别挑选作为唯一氮源条件下生孢率最高的两种氮源,根据氮源种类的优化结果选择最优和次优氮源,并按表1 调整两种氮源的配比,酵母浸粉并且以单一的两种氮源为对照,制备不同氮源配比的基础培养基,收集氮源培养液内的菌体,所得菌体用5 mL 生理盐水重悬,混匀,分别吸取1 mL 菌悬液添加到100 mL 或250 mL 的不同氮源配比的培养基中,30 ℃、160 r/min 摇瓶培养48 h,测定此时的菌体数和芽孢数,计算生孢率。
1.3.4.3 氮源含量对生孢率的影响
分别调整培养基中氮源的含量为0、4%、8%、12%、16%制备不同含氮量的培养基,收集氮源培养液内的菌体,所得菌体用5 mL 生理盐水重悬,混匀,分别吸取1 mL 菌悬液添加至100 mL/250 mL 的不同含氮量培养基中,30 ℃、160 r/min 摇瓶培养48 h,测定不同培养基中的菌体数和芽孢数,计算生孢率。
1.3.5 金属离子对生孢率的影响
1.3.5.1 Ca2+、Mn2+、Fe2+、Zn2+对菌体生孢率的影响
分别添加1 mol/L 的CaCl2、MnCl2、FeCl2、ZnCl22、4、6、8 mL,以不添加CaCl2、MnCl2、FeCl2、ZnCl2的培养基为对照。30 ℃、160 r/mi摇瓶培养48 h,记录菌体数和芽孢数,计算生孢率。
1.3.5.2 Mg2+对菌体生孢率的影响
分别添加0.4%、0.8%、1.2%、1.6%的MgCl2,以不添加MgCl2的培养基为对照,30 ℃、160 r/min 摇瓶培养48 h后记录菌体数和芽孢数,计算生孢率。
1.3.6 最陡爬坡试验设计(见表2)

表2 最陡爬坡试验设计
在单因素试验基础上,以菌体生孢率为响应值(Y),选取3 个影响最大的因素葡萄糖(X1)、复合氮源(X2)和Mg2+(X3),利用Design Expert 10.0 软件进行Box-Behnken试验设计,确定培养基成分最佳组合和最优值。
1.3.7 响应面试验因素水平设计(见表3)

表3 响应面试验因素水平设计
在最陡爬坡试验的基础上,利用Design Expert 10.0软件,葡萄糖(X1)、复合氮源(X2)和Mg2+(X3)对菌体生孢率(Y)的影响进行响应面试验,利用响应面法研究各个因素对菌体生孢率的影响,进一步确定培养基成分的最佳组合和最优值。
2 结果与分析
2.1 不同培养基对Bacillus velezensis P9 产孢量的影响(见图1)
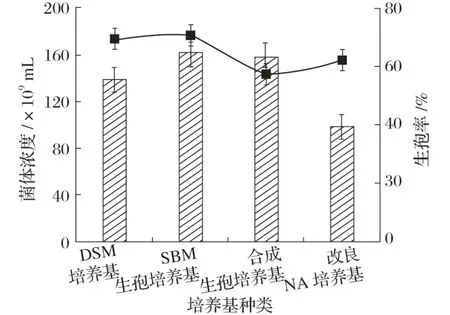
图1 不同培养基对Bacillus velezensis P9产孢量的影响
由图1 可知,Bacillus velezensisP9 在DSM 培养基和SBM培养基生孢率最高,而其中通过使用SBM培养基进行菌体培养时,菌体浓度可达到162×109/mL。因此选用SBM培养基作为生孢培养基优化的基础培养基。
2.2 生孢培养基优化结果
2.2.1 碳源对Bacillus velezensisP9 产孢量的影响(见图2)

图2 碳源对Bacillus velezensis P9产孢量的影响
由图2 可知,使用葡萄糖作为碳源时,菌体的生孢率最高,可达到77.056%,而使用麦芽糖作为碳源时,生孢率最低,只有58.132%,但此时菌体浓度较高,可能是由于麦芽糖对菌株的生长发育有很大影响,但并不适合用来做生孢培养基的碳源。因此本试验采用葡萄糖作为培养基的碳源。
2.2.2 葡萄糖对Bacillus velezensisP9 产孢量的影响(见图3)
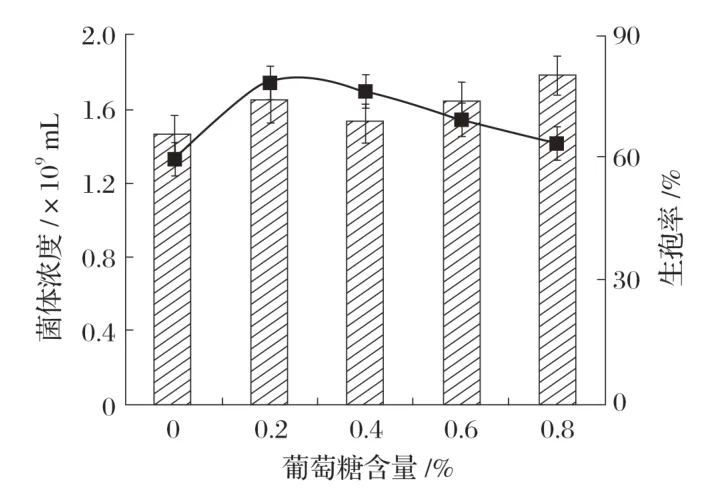
图3 葡萄糖含量对Bacillus velezensis P9产孢量的影响
由图3 可知,当葡萄糖含量低于0.2%时,生孢率随着葡萄糖浓度的增加而增加,最大值为78.1%,原因是少量的葡萄糖为菌体生孢提供了能量,使更多的菌体转化为芽孢。随着葡萄糖含量的增加,菌体浓度变化不大,生孢率下降,可能是因为过多的葡萄糖为菌体生命活动提供了能力,使菌体并未转化成芽孢[19]。因此,生孢培养基中葡萄糖的添加量为0.2%。
2.3 氮源对菌体生孢率的影响
2.3.1 氮源对Bacillus velezensisP9 产孢量的影响(见图4)

图4 氮源对Bacillus velezensis P9产孢量的影响
由图4 可知,使用酵母浸粉或牛肉膏作为培养基氮源,生孢率较高,使用酵母浸粉时生孢率最高,使用牛肉膏时菌体浓度较大。使用硫酸铵作为培养基氮源时,生孢率和菌体数较低,因此,可采用酵母浸粉与牛肉膏进行复配制备复合氮源进一步对培养基的氮源进行优化。
2.3.2 氮源配比对Bacillus velezensisP9 产孢量的影响(见图5)

图5 氮源配比对Bacillus velezensis P9产孢量的影响
由图5 可知,菌体浓度随着牛肉膏浓度的降低而降低。当牛肉膏∶酵母浸粉=1∶1 时生孢率最大,为79.7%,综合考虑菌体浓度和生孢率,选用牛肉膏∶酵母浸粉=1∶1作为生孢培养基的氮源。
2.3.3 氮源含量对Bacillus velezensisP9 产孢量的影响(见图6)
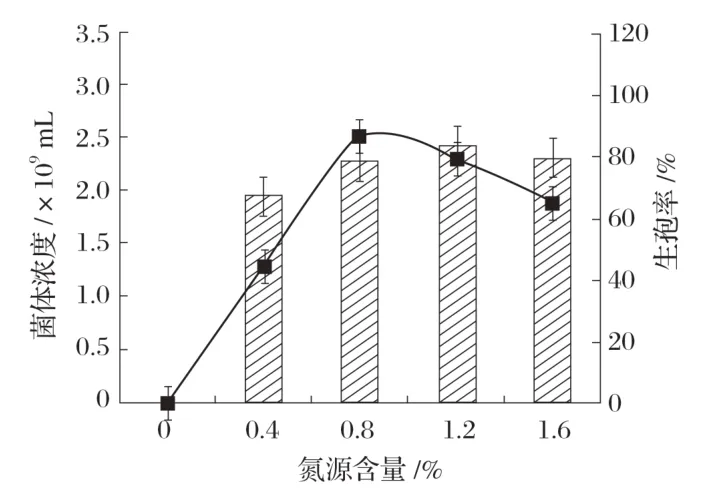
图6 氮源含量对Bacillus velezensis P9产孢量的影响
按照1∶1 的配比分别添加0、0.4%、0.8%、1.2%、1.6%的牛肉膏和酵母浸粉作为生孢培养基的氮源。由图6 可知,随着氮源含量增加,菌体浓度具有一定的增加趋势,最后趋于平稳,但是生孢率会随着氮源含量的增加先增后减。这可能是氮源浓度过大时,并不能刺激菌体产生芽孢所需要的酶,反而为菌体的其他生命活动提供了物质基础。当氮源含量较少时,不能为菌体转化为孢子的过程提供物质基础,而且影响了菌体的其他活动,因此,牛肉膏∶酵母浸粉比例为1∶1,含量为0.8%作为生孢培养基的氮源[20]。
2.4 金属离子对菌体生孢率的影响
2.4.1 Ca2+对Bacillus velezensisP9 产孢量的影响(见图7)

图7 Ca2+对Bacillus velezensis P9产孢量的影响
由图7可知,随着Ca2+水平增加,菌体浓度和生孢率均有所增加,当Ca2+水平增加到6×10-3mol/L时生孢率达到最大,为93.21%,继续增加Ca2+浓度,生孢率开始下降。因此,添加6 mL 1 mol/L CaCl2溶液进行后续试验。
2.4.2 Mn2+Bacillus velezensisP9产孢量的影响(见图8)
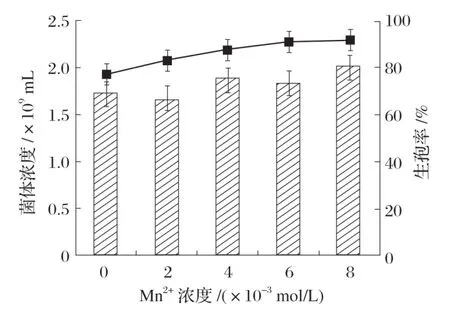
图8 Mn2+对Bacillus velezensis P9产孢量的影响
由图8 可知,随着Mn2+水平的增加,菌体的生孢率也增加,当Mn2+水平增加至8×10-3mol/L 时生孢率达到最大,为91.53%。因此,本试验添加8 mL 1 mol/L 的MnCl2溶液进行后续试验。
2.4.3 Fe2+对Bacillus velezensisP9 产孢量的影响(见图9)

图9 Fe2+对Bacillus velezensis P9产孢量的影响
由图9可知,不添加Fe2+进行生孢培养时,生孢率和菌体浓度均最大,其中生孢率为93.25%,菌体浓度为1.88×109/mL,随着Fe2+水平增加,培养液中的菌体浓度和生孢率持续下降,表明Fe2+可能并不能起到促进菌体生孢的作用。因此后续试验不添加Fe2+。
2.4.4 Zn2+对Bacillus velezensisP9 产孢量的影响(见图10)
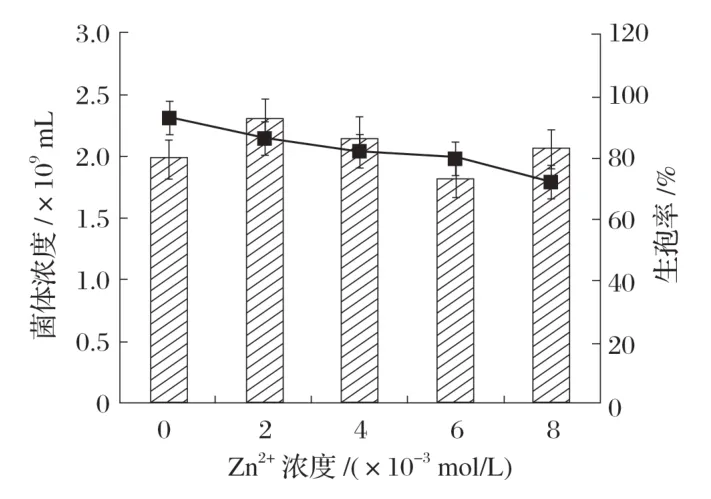
图10 Zn2+对Bacillus velezensis P9产孢量的影响
由图10 可知,不添加Zn2+进行菌体的生孢培养时,Bacillus velezensisP9 生孢率最大,为91.15%。随着Zn2+浓度增加,菌体生孢率持续下降,而菌体浓度无明显变化,可能是Zn2+对菌体生孢并无有益影响。因此,后续不添加Zn2+进行试验。
2.4.5 Mg2+对Bacillus velezensisP9 产孢量的影响(见图11)
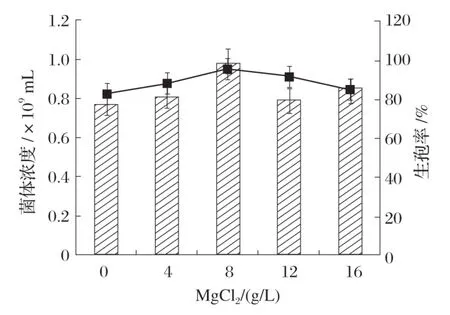
图11 Mg2+对Bacillus velezensis P9产孢量的影响
由图11可知,当MgCl2质量浓度小于8 g/L时,随着Mg2+水平增加,菌体的生孢率增加,当MgCl2质量浓度达到8 g/L时达到最大,此时的生孢率为94.65%,继续增加Mg2+水平,生孢率开始下降,可能是过量的Mg2+会对菌体生芽孢产生抑制作用。因此,本试验添加MgCl2的质量浓度为8 g/L。
2.5 爬坡试验结果
葡萄糖浓度为2g/L,复合氮源浓度为8 g/L,Mg2+浓度为8 g/L时,生孢效果达到最优。
2.6 响应面试验及方差分析结果(见表4、表5)
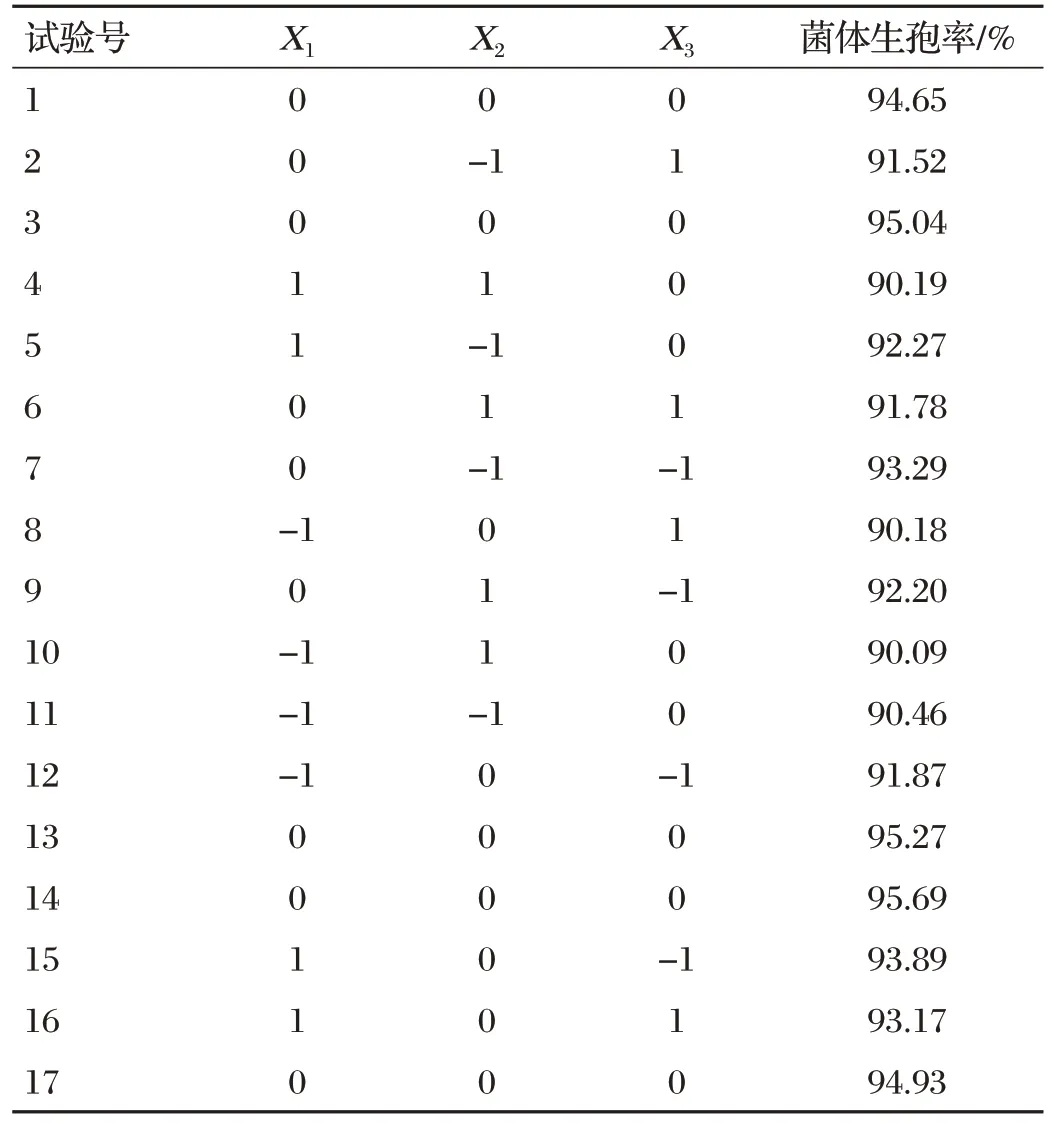
表4 响应面试验结果
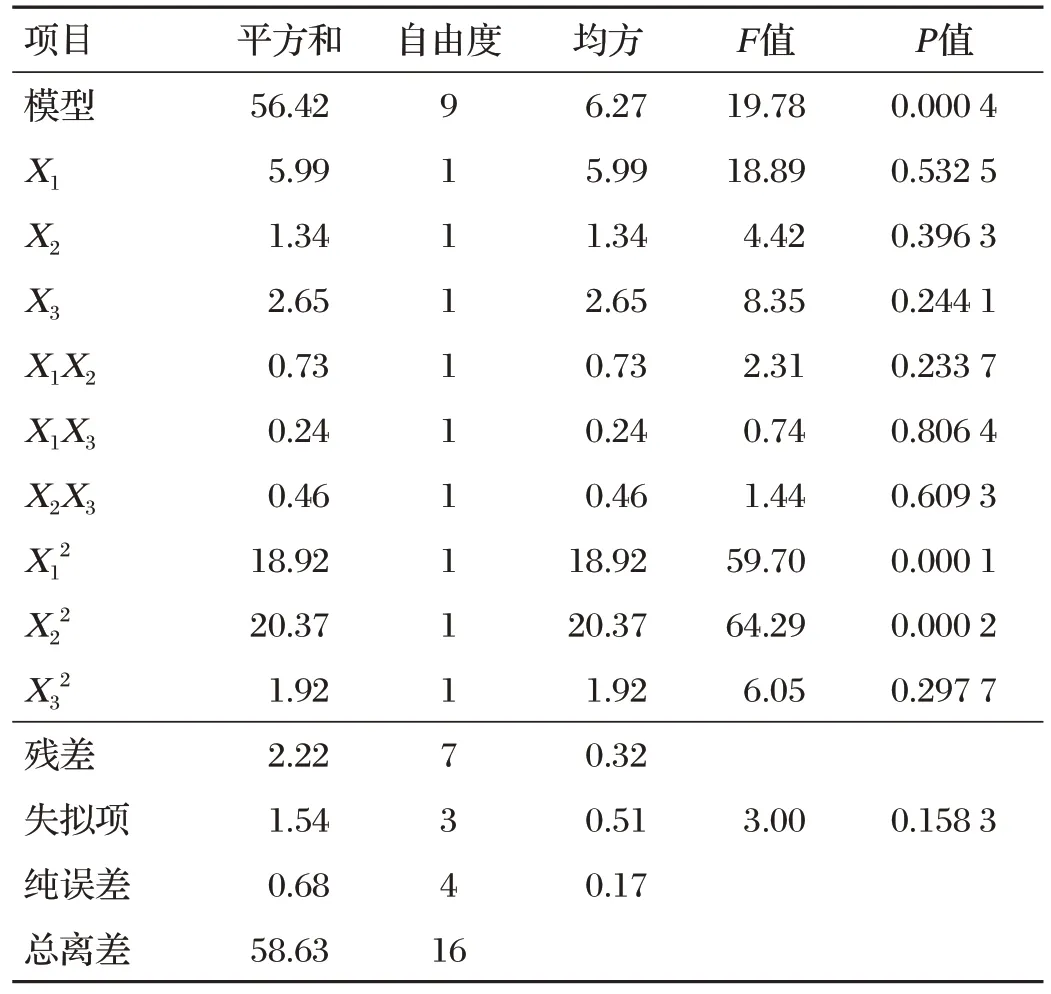
表5 方差分析结果
通过Design Expert 10.0软件对表4数据进行多元线性回归分析,得到拟合试验因素的回归方程:
Y=95.07+0.87X1-0.41X2-0.58X3-0.43X1X2+0.24X1X3+0.34X2X3-2.12X12-2.20X22-0.67X32。
通过Design Expert 10.0 软件对响应面试验进行方差分析。由表5可知,该模型P值为0.000 4<0.01,具有极显著影响,失拟项P值为0.158 3>0.05,不显著,表明该模型和试验拟合度较好。模型的决定系数R2为0.962 2,校正后的决定系数R2为0.915 3,变异系数(C.V.)为0.61%,表示该模型有0.61%的变异不能由该模型解释,说明试验操作和模型可信。
2.7 各因素交互作用对生孢率的影响(见图12)
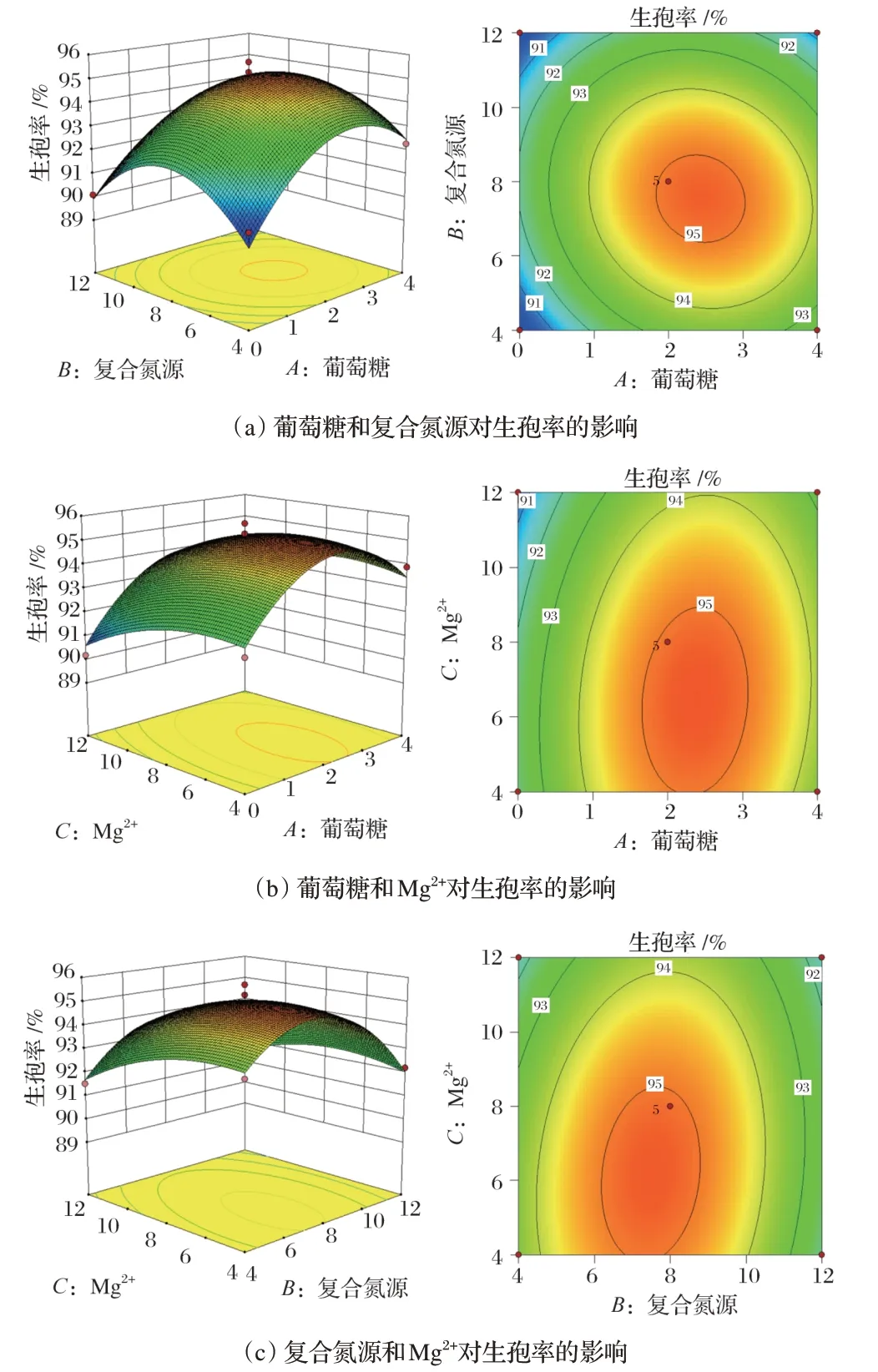
图12 各因素交互作用对生孢率的影响
由图12(a)可知,当Mg2+的质量浓度为8.0 g/L时,葡萄糖和复合氮源质量浓度分别为1.75~2.25 g/L和7.75~8.25 g/L。
由图12(b)可知,当复合氮源质量浓度为8.0 g/L时,葡萄糖和Mg2+质量浓度范围分别为1.75~2.50 g/L 和7.0~8.25 g/L。
由图12(c)可知,当葡萄糖浓度为8.0 g/L时,复合氮源和Mg2+质量浓度范围分别为7.75~8.25 g/L 和7.0~8.25 g/L。
通过Design-Expert 10.0 分析,发现葡萄糖质量浓度为2.124 g/L,复合氮源质量浓度为8.272 g/L 和Mg2+质量浓度为8.272 g/L时,生孢率最大为94.65%,与以上分析一致。
2.8 验证试验
为了验证Design-Expert 10.0软件所预测的最佳试验条件,考虑现实操作条件,调整发酵条件为葡萄糖2.0 g/L、牛肉膏4.0 g/L、酵母浸粉4.0 g/L,MgCl28.0 g/L、KH2PO46.0 g/L、NaCl 0.01 g/L、1 mol/L 的CaCl26 mL、1 mol/L 的MnCl26 mL。在此条件下进行3 次平行试验,得到发酵液生孢率为95.37%,比预测值94.65%高约0.73%,此差值在可接受范围内。在未优化的培养条件下,生孢率为64.53%[21]。本试验比未优化培养基生孢率增加了30.84%。
3 结论
对Bacillus velezensisP9进行生孢培养基的优化,确定最佳的生孢培养基成分为葡萄糖2.0 g/L、牛肉膏4.0 g/L、酵母浸粉4.0 g/L、MgCl28.0 g/L、KH2PO46.0 g/L、NaCl 0.01 g/L、1 mol/L的CaCl26 mL、1 mol/L的MnCl26 mL,此时芽孢率为95.37%。

