禽腺病毒4型云南株分离鉴定及Hexon基因序列分析
薛晓岩,张振兴,曾 毅,季 佳,代红炀,李素华,宋建领
(1.西南林业大学生命科学学院,昆明 650224;2.云南省畜牧兽医科学院,云南省热带亚热带动物病毒病 重点实验室,昆明 650224;3.水富市两碗镇农业农村和集体经济发展中心,水富 657803;4.会泽黑颈鹤国家级自然保护区管护局,曲靖 654200)
禽腺病毒4型(Fowl adenovirus-4,FAdV-4)是近年来中国鸡群暴发的病毒性传染病心包积液-肝炎综合征的主要病原,也是致病性最强的禽腺病毒(Fowl adenovirus,FAdV)[1],给中国养禽业造成巨大的经济损失。FAdV-4不仅感染肉鸡、蛋鸡、鸭和鹅,而且在野鸟上也有分离到FAdV-4的报道[2-4]。1987年,在巴基斯坦安卡拉地区的一个肉鸡场首次暴发FAdV-4感染,所以也称为安卡拉病,1989年后该病在世界范围内流行,2013年在中国散在发生[5],2015年在中国大面积暴发[6-8],2016年在云南省石林县肉鸡群中分离到云南省首个FAdV-4毒株[9]。按照群特异性抗原不同,FAdV分为Ⅰ、Ⅱ和Ⅲ群,其中Ⅰ群FAdV又分5个亚群(FAdV-A~FAdV-E)和12个血清型(FAdV1~FAdV8a,FAdV8b~FAdV11)[10],FAdV-4属于FAdV-C亚群。Hexon蛋白是FAdV病毒颗粒表面最大的衣壳蛋白,含有病毒刺激宿主产生免疫应答的重要抗原决定簇[11],由2个保守的基底区(P1、P2)和4个高变环(L1~L4)组成,能诱导机体产生中和抗体[12]。由于不同血清型FAdVHexon基因高变区序列的差异较大,因此Hexon蛋白也常用于血清型分类[13-14]。2020—2021年,本研究从云南省发病家禽肝脏组织及野鸟粪便样品中分离出FAdV-4,并对分离株的致病性和Hexon基因序列进行了研究分析,以期探讨云南FAdV-4分离株的毒力特性,为FAdV-4的分子流行病学研究和防控提供参考。
1 材料与方法
1.1 材料
2020年1月—2021年6月在云南省昆明市、曲靖市、楚雄州、大理州、红河州、玉溪市等家禽养殖密集区采集到疑似感染FAdV-4的家禽肝脏组织样品158份和候鸟迁徙地野鸟新鲜粪便样品310份,将肝脏组织样品剪碎,按1∶10比例加入灭菌生理盐水研磨;粪便样品按1∶5比例加入灭菌生理盐水充分混匀,研磨的混合物和粪便混合液反复冻融3次,8 000 r/min离心10 min,取上清液经0.22 μm滤膜过滤,收集滤液―20 ℃保存备用。
SPF鸡胚购自北京妫川亚申养殖中心;未经FAdV-4免疫的健康白羽肉鸡购自云南云岭广大峪口禽业有限公司。
MiniBEST Viral RNA/DNA提取试剂盒、TaqDNA聚合酶和DL2000 DNA Marker等均购自宝生物工程(大连)有限公司。
1.2 PCR扩增
根据GenBank中FAdV-4基因序列(登录号:GU188428.1),参考文献[6,15]设计FAdV-4检测引物FAdV-4F/R(表1),预期扩增产物大小为564 bp,引物由生工生物工程(上海)股份有限公司合成。
利用MiniBEST Viral RNA/DNA提取试剂盒分别提取样品滤液中的病毒DNA,以此为模板进行PCR扩增。PCR反应体系20 μL:TaqDNA聚合酶10 μL,上、下游引物各0.5 μL,DNA模板2 μL,ddH2O 7 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性45 s,58 ℃退火45 s,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min。PCR产物经1.2%琼脂糖凝胶电泳检测,100 V电泳30 min,拍照保存。
1.3 病毒分离鉴定
参考兰虹等[16]方法,样品滤液通过卵黄囊接种7日龄SPF鸡胚,每枚鸡胚0.2 mL,37 ℃恒温培养箱孵育,每12 h观察一次鸡胚,弃去24 h内非特异性死亡鸡胚,无菌收集24~96 h死亡鸡胚尿囊液及胚体。对收集的尿囊液分别提取核酸,采用PCR检测FAdV-4。
1.4 血凝试验
取96孔V型微量板,将微量板横向放置,每行为同种动物1%红细胞悬液,每列为不同检测样品,进行血凝试验,观察红细胞凝集现象。红细胞凝集滴度的判定以反应板倾斜45°,沉于管底的红细胞沿着倾斜面向下呈线状流动,表明红细胞未被病毒凝集;若孔底的红细胞平铺,凝成均匀薄层,倾斜45°后红细胞不流动,表明红细胞被病毒凝集。
1.5 鸡胚半数致死量测定
取FAdV-4阳性样品滤液,经无菌PBS梯度稀释,配制成10-3至10-10病毒液,卵黄囊接种于7日龄SPF鸡胚,每个滴度接种5枚。弃去24 h内死亡鸡胚,记录每天死胚数量,连续观察至96 h,按Reed-Muench法计算鸡胚半数致死量(ELD50)。
1.6 致病性试验
将30只4周龄未经免疫的健康白羽肉鸡平均分成3组,每组10只,分别为分离毒株YN1905组(试验1组)、分离毒株YN1802组(试验2组)及对照组。试验组分别用106ELD50/mL的病毒液肌内注射1 mL,对照组肌内注射1 mL无菌PBS。每天观察雏鸡临床症状,记录死亡数,连续观察14 d,剖检发病死亡个体,观察大体病变,并采集肝脏组织,制备石蜡组织切片,经HE染色,显微镜下观察病理变化。
1.7 Hexon基因PCR扩增和测序
根据GenBank中FAdV-4基因序列(登录号:GU188428.1),参考文献[6,15],设计用于分段扩增FAdV-4Hexon全基因的3对引物Hexon-1F/R、Hexon-2F/R和Hexon-3F/R(表1),引物均由生工生物工程(上海)股份有限公司合成。利用MiniBEST Viral RNA/DNA提取试剂盒提取FAdV-4阳性鸡胚尿囊液病毒DNA,以此为模板进行PCR扩增。PCR反应体系20 μL:TaqDNA 聚合酶10 μL,上、下游引物各0.5 μL,DNA模板2 μL,ddH2O 7 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性50 s,60 ℃退火50 s,72 ℃延伸1 min 30 s,共35个循环;72 ℃延伸10 min。PCR产物用琼脂糖凝胶回收试剂盒纯化回收后送生工生物工程(上海)股份有限公司测序。
1.8 Hexon序列生物信息学分析
使用SeqMan软件对测序结果进行拼接、处理和编辑,经BLAST进行序列相似性比对,在NCBI中下载相似毒株序列及已发表的FAdV代表毒株序列作为参考序列,参考毒株信息见表2。采用BioEdit进行氨基酸位点变异分析,采用ClustW进行多序列比对,并应用Neighbor-Joining法通过Mega 10.0软件构建Hexon分子系统进化树。

表2 FAdV参考毒株信息Table 2 Reference strain information of FAdV
2 结 果
2.1 病原核酸检测
在采集的158份家禽肝脏组织样品中,FAdV-4核酸阳性19份,阳性率为12.03%;在候鸟迁徙地采集的310份野鸟新鲜粪便样品中,FAdV-4核酸阳性1份(黑颈鹤粪便),阳性率为0.3%;20份阳性样品PCR扩增产物在564 bp处均检测到预期目的条带(图1)。
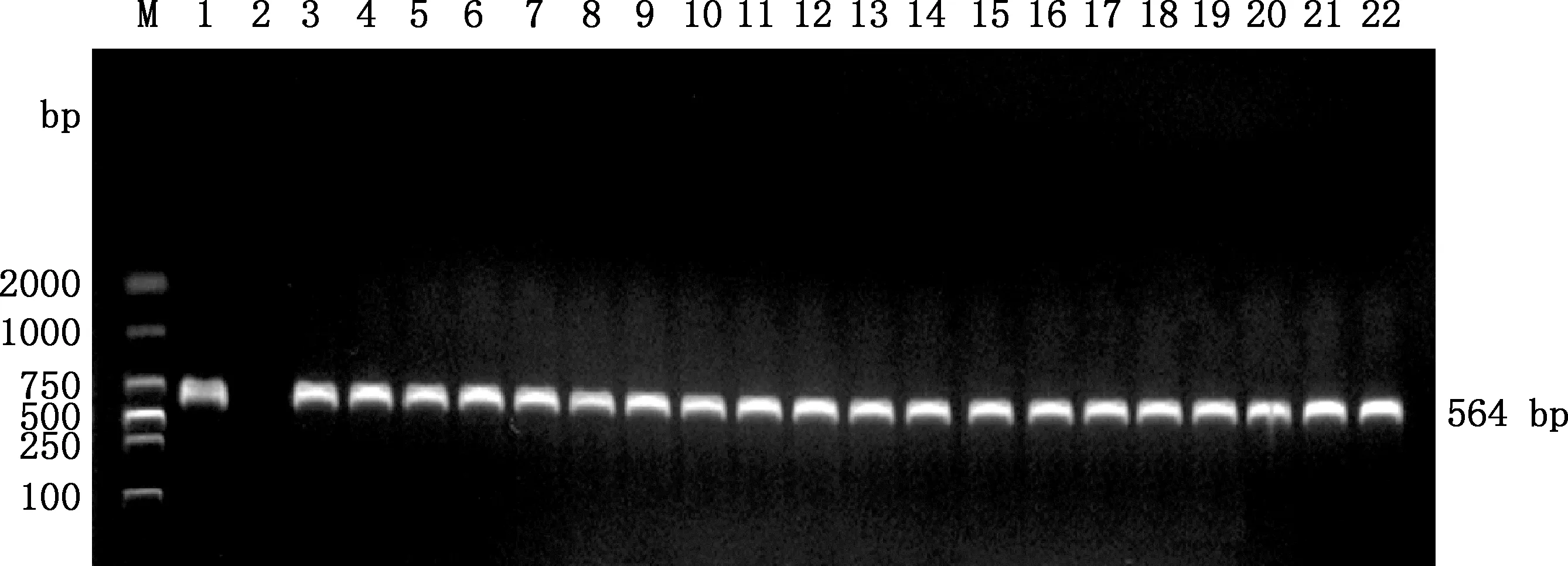
M,DL2000 DNA Marker;1,阳性对照;2,阴性对照;3~21,家禽肝脏组织样品;22,野鸟粪便样品 M,DL2000 DNA Marker;1,Positive control;2,Negative control;3-21,Liver tissue samples from domestic poultry;22,Faecal samples from wild bird图1 样品FAdV-4的PCR检测结果Fig.1 PCR detection results of FAdV-4 in samples
2.2 病毒分离及鉴定
对20份FAdV-4核酸检测阳性对应样品的上清液分别接种SPF鸡胚,盲传3代,其中7份样品的上清液(均来自于发病家禽的肝脏组织样)对3代鸡胚均可致死。与无菌PBS接种的对照组胚体相比,接种样品致死的胚体发育不良、组织器官明显萎缩,胚胎呈现头尾明显卷曲状,且表面覆盖疏松血性渗出物。对鸡胚尿囊液用引物FAdV-4F/R进行PCR扩增,7份可致死鸡胚的样品扩增产物大小约564 bp(图2),与预期目的条带长度相符。说明从7份样品中分离到FAdV-4,分别命名为:YN1605、YN2004、YN1802、YN1904、YN2109、YN1905和YN2108。
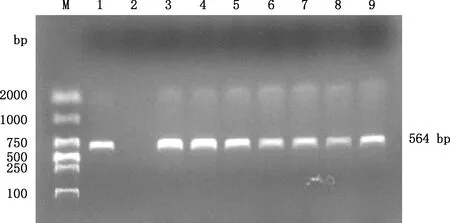
M,DL2000 DNA Marker;1,阳性对照;2,阴性对照;3~9,YN1605、YN2004、YN1802、YN1904、YN2109、YN1905和YN2108分离毒株鸡胚尿囊液 M,DL2000 DNA Marker;1,Positive control,2,Negative control,3-9,YN1605,YN2004,YN1802,YN1904,YN2109,YN1905 and YN2108 for chicken embryo allantoic fluid,respectively图2 分离毒株鸡胚尿囊液FAdV-4的PCR检测结果Fig.2 PCR detection results of FAdV-4 of chicken embryo allantoic fluid
2.3 血凝试验
7份FAdV-4样品接种鸡胚的尿囊液对鸡、鸭、兔红细胞均无血凝能力(图3)。
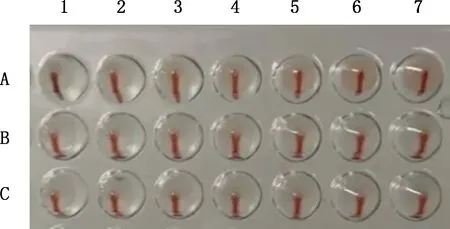
A,鸡红细胞悬液;B,鸭红细胞悬液;C,兔红细胞悬液;1~7,YN1605、YN2004、YN1802、YN1904、YN2109、YN1905和YN2108分离毒株鸡胚尿囊液 A,Chicken erythrocyte suspension;B,Duck erythrocyte suspension;C,Rabbit erythrocyte suspension;1-7,YN1605,YN2004,YN1802,YN1904,YN2109,YN1905 and YN2108 for chicken embryo allantoic fluid,respectively图3 分离毒株血凝抑制检测Fig.3 The blood coagulation inhibition test of the isolated strains
2.4 鸡胚半数致死量测定
由表3可知,Reed-Muench法得到7个分离毒株的ELD50在10-6.17~10-4.32/mL之间。
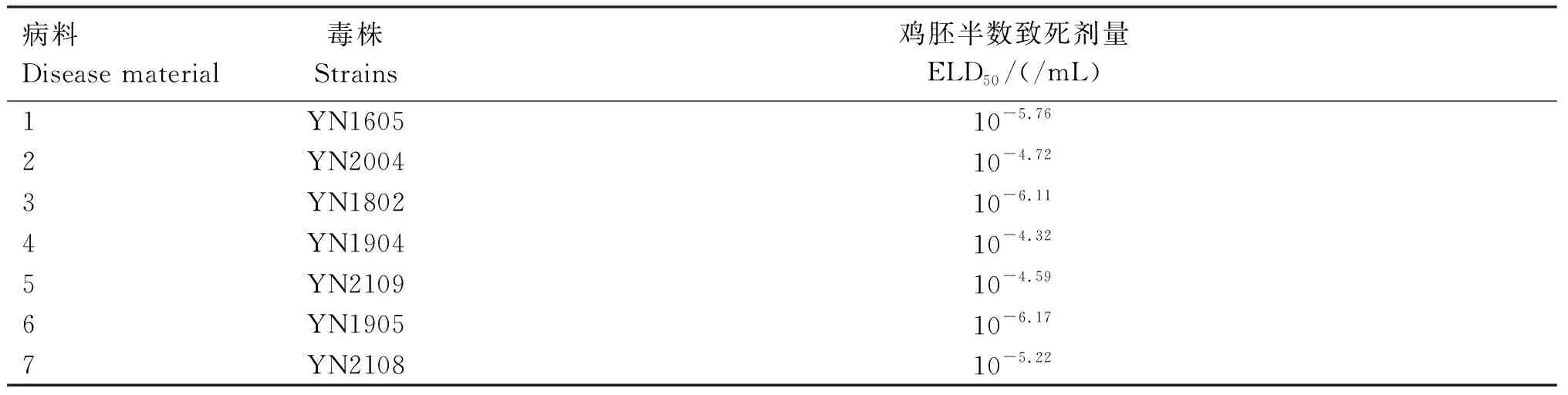
表3 7个分离毒株的ELD50测定结果Table 3 ELD50 determination results of 7 isolated strains
2.5 病毒致病性试验
用YN1905和YN1802分离毒株感染试验1、2组雏鸡,在感染第1~2天未见明显异常症状;感染第3天2个试验组雏鸡开始出现精神萎靡、嗜睡、羽毛蓬乱、食欲减退等症状;感染第4~6天内可见临床症状加重,表现为头首啄地、绿便腹泻、流涎等,并出现个体死亡;感染第14天2个试验组死亡率高达80%;对照组鸡未出现异常临床表现,无死亡个体。对感染第5天死亡的雏鸡进行剖检可见心包呈水囊状,明显淡黄色澄清的心包积液;肝脏肿大,质脆易碎,颜色苍白,肝叶上分布有出血点或出血斑,伴有坏死灶。肝脏病理组织切片显示,肝血窦淤血,肝细胞变性坏死,炎性细胞显著浸润(图4)。
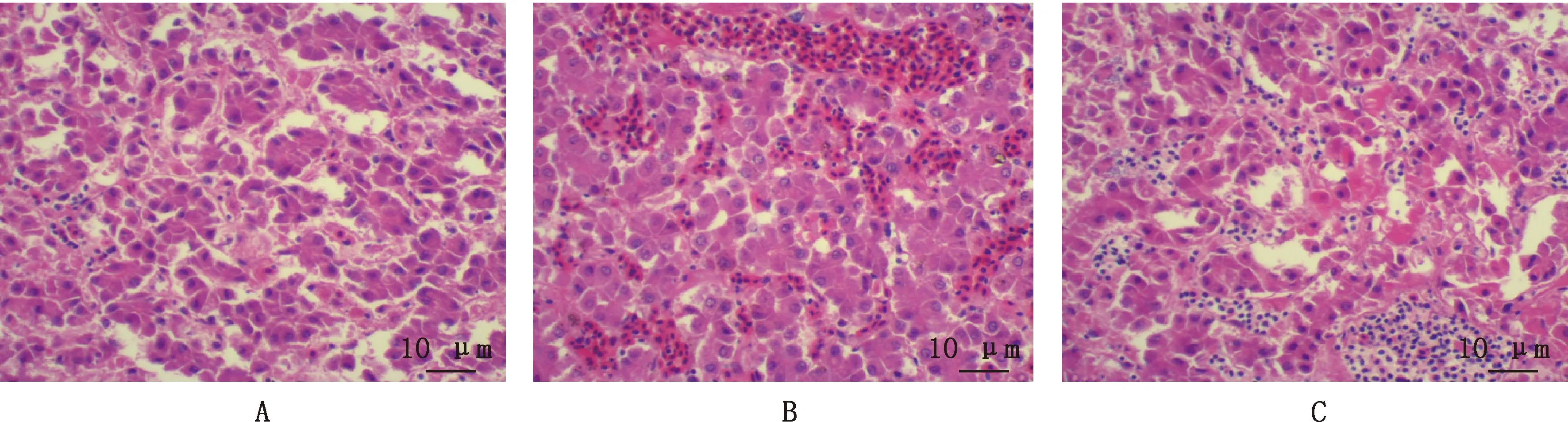
A,对照组;B,试验1组;C,试验2组 A,Control group;B,Group 1;C,Group 2图4 FAdV-4感染鸡肝脏组织学特征(40×)Fig.4 Histological characteristics of chicken liver with FAdV-4 infection (40×)
2.6 Hexon全基因PCR扩增和测序
分别对7份FAdV-4阳性样本的鸡胚尿囊液提取核酸,对Hexon全基因分3段进行PCR扩增,结果显示,7份样本均在1 110、915和816 bp处出现特异性目的条带,与预期大小相符,部分毒株Hexon基因扩增结果见图5。PCR产物纯化后送测序,所获序列经SeqMan拼接分别获得6株2 814 bp和1株2 811 bp全长Hexon基因序列。
2.7 遗传进化分析
对7株FAdV-4Hexon全基因序列进行核苷酸序列相似性分析,结果显示,7株FAdV-4云南分离株Hexon基因相似性为99.5%~100%;与近几年国内分离的高致病性毒株(SD1511、AH712、HLJFAd15、HB1510等)[12]核苷酸序列相似性在99.7%~100%;与印度分离株(PK-01、PJ-06、B1-7等)核苷酸序列相似性在96.9%以上(图6)。遗传进化分析结果显示,7株云南分离株处于FAdV-C亚群分支,与Ⅰ群的A、B、D和E各亚群FAdV毒株之间亲缘性较低,聚类在不同分支;与国内流行的高致病性株处于同一小分支上,此分支还包括印度株,加拿大株(ON1)、澳大利亚株(KR5)和墨西哥(MX-SHP95)聚类在另一小分支(图7)。
2.8 分离毒株Hexon氨基酸序列相似性及位点分析
7株FAdV-4分离毒株Hexon氨基酸序列间的相似性为99.5%~100%,与参考株氨基酸序列相似性在96.9%~100%,其中与国内高致病性毒株和印度株氨基酸序列相似性较高,分别为99.7%~100%和96.9%~99.7%,与MX-SHP95、ON1和KR5的相似性较低,为98.3%~99.0%(图8)。Hexon氨基酸位点变异主要集中于第160~410位,与ON1、KR5、PJ-06等低致病性毒株相比,变异位点包括T164S、I188R、Q193R、E195Q、N238D、A240T、E243N、M263I、T410A等;与HB1510、HLJFAd15、SD1511等国内高致病性毒株相比具有相同位点,包括164S、188R、193R、195Q、238D、240T、243N、263I等;部分毒株存在S362P、G369A、N663K、G675R等位点变异(表4)。
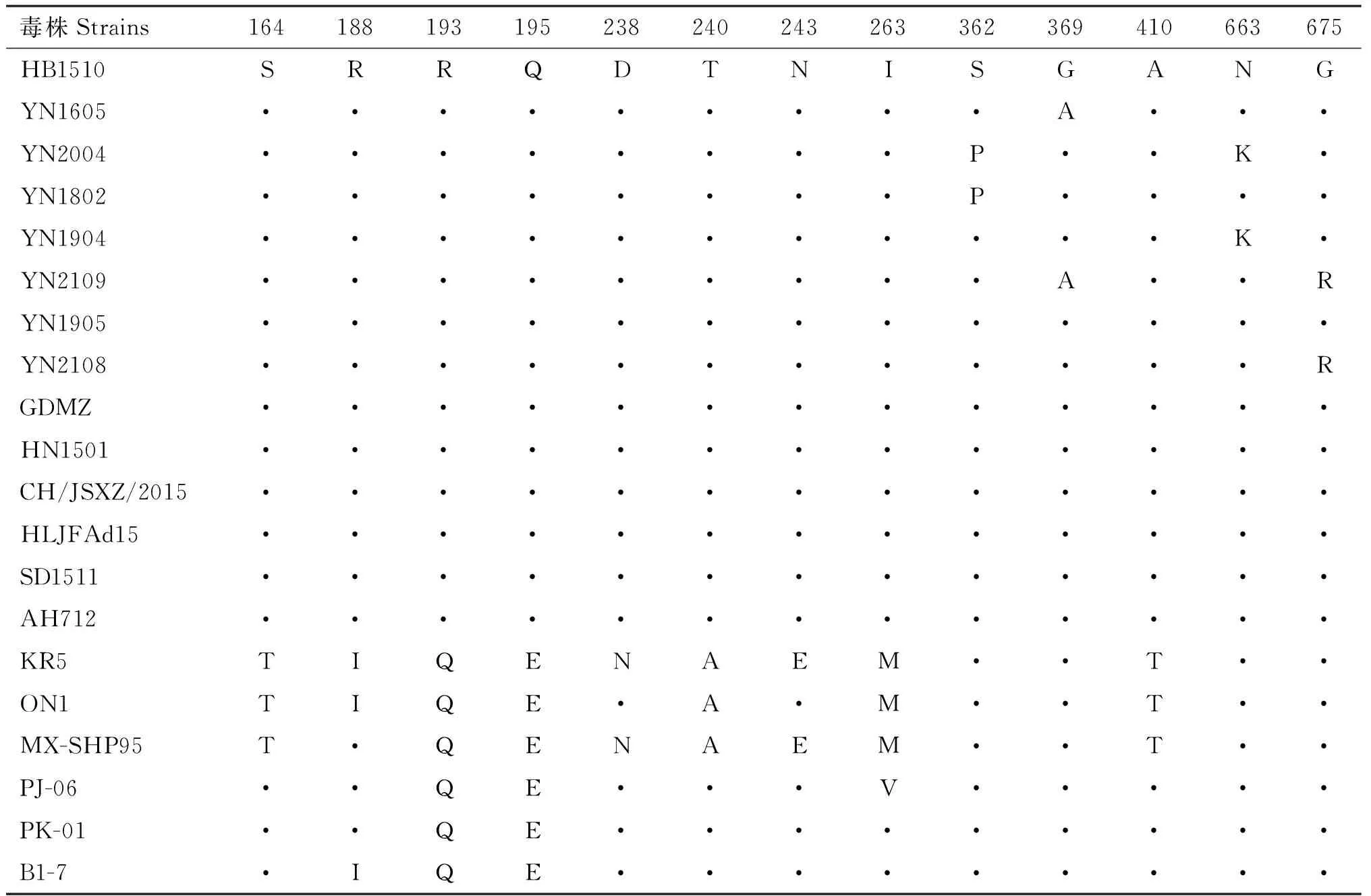
表4 FAdV-4 Hexon氨基酸序列变异位点Table 4 Variation sites of Hexon amino acid sequences of FAdV-4
3 讨 论
FAdV是家禽和野禽常见的传染病病原,自2015年以来中国暴发了以FAdV-4、FAdV-8a、FAdV-8b和FAdV-11为主的包涵体肝炎疫情,发病鸡数量逐年增加且致病性增强,给养禽业造成巨大经济损失[16]。目前对FAdV不同血清型之间的鉴定和区分常依赖于PCR法,该方法中如何选择特定靶基因来设计引物是关键。由于FAdV对宿主选择不具有特异性,若选择FAdV全基因组中高度保守基因,则只能鉴定;若选择12个血清型中各独立保守基因,则只能分型。为达到同时进行鉴定和分型的目的,靶基因应具有保守区域和可变区域,且保守区域应围绕可变区域,在保守区域扩增用于FAdV鉴定的同时可变区域用于分型[17]。Hexon蛋白是FAdV病毒粒子的主要结构蛋白,蛋白编码Hexon基因具有保守部区(基座、P1和P2)和可变结构环区域(Loop 1―Loop 4),保守区域位于病毒体内部,可变环从表面伸出,且可变环含有亚型特异性中和表位。研究表明,来自不同宿主、不同血清型的FAdV可变环区的序列相似性极低,通过对Loop 1区遗传进化分析可确定FAdV的血清型[17-19],因此对FAdV的鉴定和分型通常以Hexon为靶基因。冯敬敬等[12]、兰虹等[16]、赵玉杰等[20]均以Hexon为靶基因成功鉴定并确定不同血清型的FAdV。本研究以Hexon为靶基因,从云南省不同养殖场疑似FAdV感染的家禽肝脏组织样品和候鸟新鲜粪便中鉴定到20份FAdV-4阳性样品,也是首次在云南越冬的黑颈鹤粪便中检测到FAdV-4核酸,本研究分离获得的7株FAdV-4毒株均来自于发病家禽的肝脏组织样品,黑颈鹤粪便样品中没有分离到FAdV-4毒株,可能与粪便样品中FAdV-4病毒含量太低有关。遗传进化分析显示,7株分离株与C亚群的FAdV-4型分离株亲缘关系较近,与当前FAdV-4国内高致病性流行株及印度株的相似性较高。
Hexon蛋白也是FAdV的主要免疫保护性蛋白,含有特异性抗原决定簇,决定着FAdV-4的致病性[21-24]。研究人员将Hexon特定氨基酸位点特征(如:164S、188R、193Q、195Q、238D、240T、243N、263I、410A等)及病毒具有明确的致病性作为高致病性毒株的的判定标准,且出现任意一项即可判定为高致病毒株[24-25]。FAdV-4 Hexon蛋白氨基酸位点分析显示,云南省分离毒株均具有188R、195Q、238D、240T等的高致病性毒株特征[24-25]。本研究用YN1905和YN1802株感染4周龄白羽肉鸡,可以引起明显的FAdV-4感染导致的临床症状,出现淡黄色澄清的心包积液、肝脏肿大、肝血窦淤血、肝细胞变性坏死和炎性细胞显著浸润等病理变化,死亡率最高达到80%,致病性试验结果验证了分离毒株为高致病性毒株,与国内FAdV-4流行株对雏鸡具有一致的致死性,导致相似的临床症状及病理变化[14]。同时云南部分分离毒株存在362、369、663、675位氨基酸变异,这些位点突变在病毒复制能力、宿主选择等方面的影响仍需要进一步深入研究。
4 结 论
本试验掌握了云南FAdV-4流行情况,首次在云南越冬的黑颈鹤粪便中检测FAdV-4病原核酸阳性。从发病家禽的肝脏组织样中共分离获得7株FAdV-4毒株,具有高致病性特征,属于FAdV-C亚群,与国内流行株和印度株Hexon基因序列相似性极高,亲缘关系较近。分离毒株Hexon蛋白188、193和195位氨基酸处具有与国内高致病性毒株相同特征,部分毒株362、369、663和675位氨基酸处发生突变。

