白来航鸡半乳糖凝集素-1基因克隆、生物信息学及组织表达特性分析
张 凯,夏宇欣,王立强,侯少阳,温海燕,葛仕豪,周宛蓉,姜莉莉,樊兆斌
(菏泽学院药学院,菏泽 274015)
半乳糖凝集素(galectin)是一种典型的动物半乳糖结合蛋白,在多种动物体内广泛分布,对β-半乳糖苷具有较强的亲和力,在细胞黏附、细胞凋亡、炎症反应、肿瘤转移等许多生理和病理过程中发挥重要作用[1-2]。半乳糖凝集素-1(Gal-1)是第一个被报道的哺乳动物半乳糖凝集素[3],作为可溶性多功能蛋白,可通过结合多种病毒表面的聚糖从而介导宿主与病原体的相互作用[4]。Gal-1能够与流感病毒[5]和Nipha病毒[6]的囊膜糖蛋白结合,抑制二者的感染;通过与人类免疫缺陷病毒1型(HIV-1)壳膜蛋白gp120和宿主受体蛋白CD4上的多糖结合,促进HIV-1的吸附和感染[7]。新城疫病毒(NDV)等禽类呼吸道病毒可以诱导鸡Gal-1基因在主要靶器官中的表达上调。鸡Gal-1基因通过与新城疫病毒(NDV)血凝素-神经氨酸酶(HN)糖蛋白上的G-四链体(G4)N-聚糖结合发挥抗NDV作用;对HN糖基化突变的NDV在Gal-1基因敲除和过表达细胞中的复制研究表明,NDV的复制与Gal-1基因的表达存在特定的糖依赖方式[8]。Gal-1基因参与机体在病毒感染早期的抗病毒固有免疫反应,可诱导鸭瘟病毒感染鸭的免疫应答和抗病毒能力,显著抑制感染早期鸭瘟病毒的复制[9]。
目前针对哺乳动物Gal-1基因的研究较为广泛和深入[3-6],但对于家禽Gal-1基因的研究报道相对较少。本研究通过对白来航鸡Gal-1基因进行克隆、测序及序列分析,利用在线软件对该基因编码蛋白进行生物信息学分析,并检测不同组织中Gal-1基因的表达,以期为Gal-1基因编码蛋白的抗病毒功能的深入研究提供有价值的参考资料。
1 材料与方法
1.1 材料
1.1.1 样品采集 3只3周龄健康的白来航鸡购自菏泽市某养殖场。屠宰后,采集每只白来航鸡的心脏、肝脏、脾脏、肺脏、肾脏、脑、十二指肠、空肠、盲肠、直肠、腺胃、肌胃、胸肌和腿肌组织,置于1.5 mL RNase/DNase Free离心管中,―70 ℃保存备用。
1.1.2 主要试剂 动物组织总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒、2×TaqPCR MasterMix、DL2000 DNA Marker、质粒小提试剂盒、pGM-T载体、大肠杆菌DH5α感受态细胞、T4 DNA连接酶等均购自天根生化科技(北京)有限公司;限制性内切酶BamH Ⅰ与NotⅠ购均自宝日医学生物技术(北京)有限公司。
1.2 方法
1.2.1 引物设计及合成 根据GenBank中原鸡Gal-1基因序列(登录号:NM_205495.2),利用Primer Premier 5.0设计Gal-1基因扩增引物及实时荧光定量PCR引物,以GAPDH为内参基因,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。
1.2.2Gal-1基因克隆及测序 按照RNA提取试剂盒说明书提取鸡各组织总RNA并反转录合成cDNA。以合成的脾脏cDNA为模板,进行鸡Gal-1基因PCR扩增。PCR反应体系50 μL:2×TaqPCR MasterMix 25 μL,cDNA 1 μL,上、下游引物各1 μL,ddH2O 22 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸7 min,4 ℃保存。PCR产物经1.0%琼脂糖凝胶电泳检测,经胶回收试剂盒回收,与pGM-T载体16 ℃过夜连接,产物转化大肠杆菌DH5α感受态细胞,接种于LB(Amp+)平板,37 ℃过夜培养,挑取单个圆滑白色菌落,PCR验证正确后送生工生物工程(上海)股份有限公司测序。用NCBI中BLAST程序对测序结果进行相似性比对。
1.2.3 相似性比对及系统进化树构建 利用DNAStar中的MegAlign软件将白来航鸡(White Leghorn chicken)与绿头鸭(Anasplatyrhynchos,XM_005015962.4)、火鸡(Meleagrisgallopavo,XM_003202240.3)、珍珠鸟(Taeniopygiaguttata,XM_012569200.1)、马(Equuscaballus,XM_001501032.5)、藏羚羊(Pantholopshodgsonii,XM_005955615.1)、羊驼(Vicugnapacos,XM_006207063.2)、人(Homo,CR456511.1)、小鼠(Musmusculus,NM_008495.2)、大鼠(Rattusnorvegicus,NM_019904.1)的Gal-1基因核苷酸序列进行相似性比对,利用Mega 5.0软件构建系统进化树。
1.2.4 生物信息学分析 用ProtParam在线软件(https:∥web.expasy.org/protparam/)分析Gal-1蛋白的理化性质;用ProtScale在线软件(https:∥web.expasy.org/protscale/)分析蛋白亲/疏水性;用TMHMM 2.0在线软件(https:∥services.healthtech.dtu.dk/service.php?TMHMM-2.0)对蛋白跨膜结构进行预测分析;用NetPhos 3.1 Server(https:∥services.healthtech.dtu.dk/service.php?NetPhos-3.1)、NetOGlyc 4.0(https:∥services.healthtech.dtu.dk/service.php?NetOGlyc-4.0)和NetNGlyc 1.0(https:∥services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)在线软件进行潜在磷酸化位点及O-糖基化位点、N-糖基化位点预测;用SignalP 5.0在线软件(https:∥services.healthtech.dtu.dk/service.php?SignalP-5.0)预测蛋白信号肽;用SMART在线软件(http:∥smart.embl-heidelberg.de/)预测蛋白结构域;用SOPMA在线软件(http:∥npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白二级结构;通过SWISS-MODEL在线软件(http:∥swissmodel.expasy.org/)预测蛋白三级结构。
1.2.5Gal-1基因组织表达特性检测 以鸡心脏、肝脏、脾脏、肺脏、肾脏、脑、腺胃、肌胃、胸肌、腿肌、十二指肠、空肠、盲肠和直肠cDNA为模板,以GAPDH为内参基因,采用实时荧光定量PCR检测Gal-1基因在不同组织中的相对表达量。PCR反应体系10 μL:SYBR Premix ExTaq(2×) 5 μL,上、下游引物各0.3 μL,cDNA 0.5 μL,ddH2O 3.9 μL。PCR反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,共45个循环;熔解程序:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个组织样品设3个重复,利用2-ΔΔCt法计算Gal-1基因在鸡不同组织中的表达情况。
1.3 数据统计及分析
所有试验都重复至少3次。使用SPSS 28.0软件进行单因素方差分析,采用LSD和邓肯氏法进行多重比较,结果表示为平均值±标准差。P<0.05表示差异显著。
2 结 果
2.1 Gal-1基因CDS区克隆及序列分析
PCR产物经1.0%琼脂糖凝胶电泳检测显示,扩增片段大小约为432 bp(图1),与预期大小一致。应用DNAMAN软件分析测序结果显示,Gal-1基因CDS区全长为408 bp,与NCBI上发表的鸡Gal-1基因(登录号:NM_205495.2)序列相似性为99.9%,共编码135个氨基酸,碱基组成分别为A(24.02%)、C(28.19%)、G(24.51%)、T(23.28%),GC含量为52.7%,高于AT含量,说明Gal-1基因编码区的DNA双链较稳定。
2.2 Gal-1基因核苷酸序列相似性比对及系统进化树构建
利用DNAStar中的MegAlign软件对不同物种Gal-1基因序列进行相似性比对,结果显示,白来航鸡Gal-1基因与火鸡、绿头鸭和珍珠鸟的相似性分别为97.1%、88.4%和82.2%,与其他物种的相似性较低(图2)。系统进化树分析结果表明,白来航鸡与火鸡亲缘关系最近,与绿头鸭的亲缘关系相对较近,形成一个分支;与其他物种亲缘关系较远,人、小鼠、马等哺乳动物形成另外一个分支(图3)。
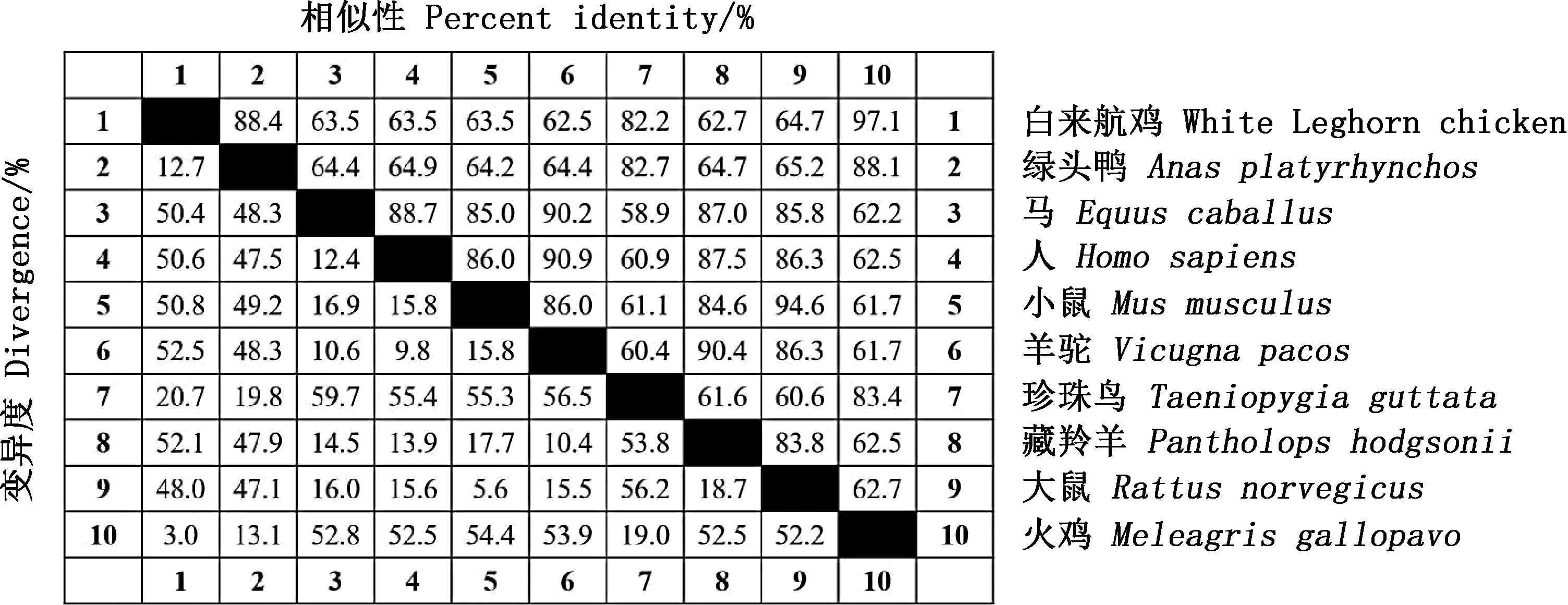
图2 不同物种间Gal-1基因核苷酸序列相似性比对Fig.2 Similarity alignment of nucleotide sequences of Gal-1 gene in different species
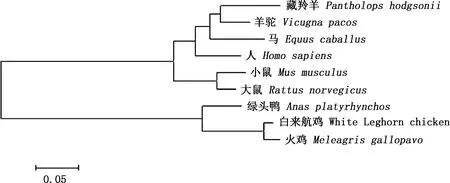
图3 Gal-1基因系统进化树Fig.3 Phylogenetic tree of Gal-1 gene
2.3 生物信息学分析
2.3.1 理化性质预测 利用ExPASy在线工具ProtParam对Gal-1基因编码蛋白的理化性质预测结果表明,Gal-1蛋白分子式为C677H1034N184O195S6,理论分子质量为15.06 ku,理论等电点为6.57,编码135个氨基酸,其中甘氨酸(Gly)和亮氨酸(Leu)含量最多,所占比例均为8.9%,含量最低的氨基酸是色氨酸(Tyr),所占比例为0.7%。Gal-1蛋白的不稳定系数为36.05,低于阈值40,表明该蛋白比较稳定。在哺乳动物网织红细胞内的半衰期为30 h,脂肪系数为74.30。
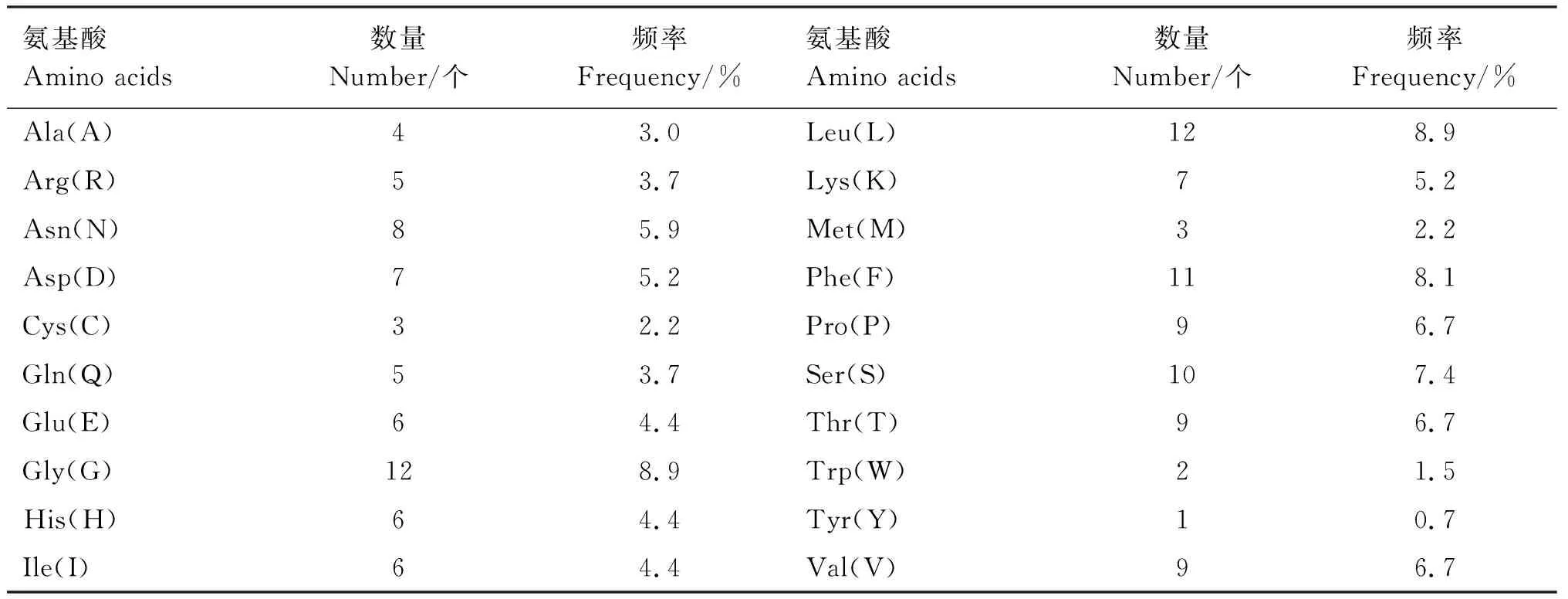
表2 白来航鸡Gal-1蛋白的氨基酸组成Table 2 Amino acid composition of Gal-1 protein in White Leghorn chickens
2.3.2 亲/疏水性预测 利用ProtScale工具分析Gal-1蛋白的亲/疏水性,结果见图4。由图4可知,在72位氨基酸处亲水性最强,在23位氨基酸处疏水性最强,整个多肽链有2个明显的亲水区,综合平均亲水指数为-0.259。说明Gal-1蛋白为亲水性蛋白。
2.3.3 跨膜区、信号肽和保守结构域预测 利用TMHMM 2.0在线软件分析Gal-1蛋白跨膜区,结果表明该蛋白不存在跨膜区(图5)。利用SignalP 5.0 Server工具预测Gal-1蛋白信号肽,结果表明该蛋白不含信号肽(图6),说明该蛋白不是分泌型蛋白。利用EMB的SMART程序对Gal-1蛋白保守结构域预测结果表明,该蛋白具有GLECT家族典型的同源结构域(图7)。

图4 白来航鸡Gal-1蛋白亲/疏水性预测Fig.4 Hydrophilic and hydrophobic prediction of Gal-1 protein in White Leghorn chickens
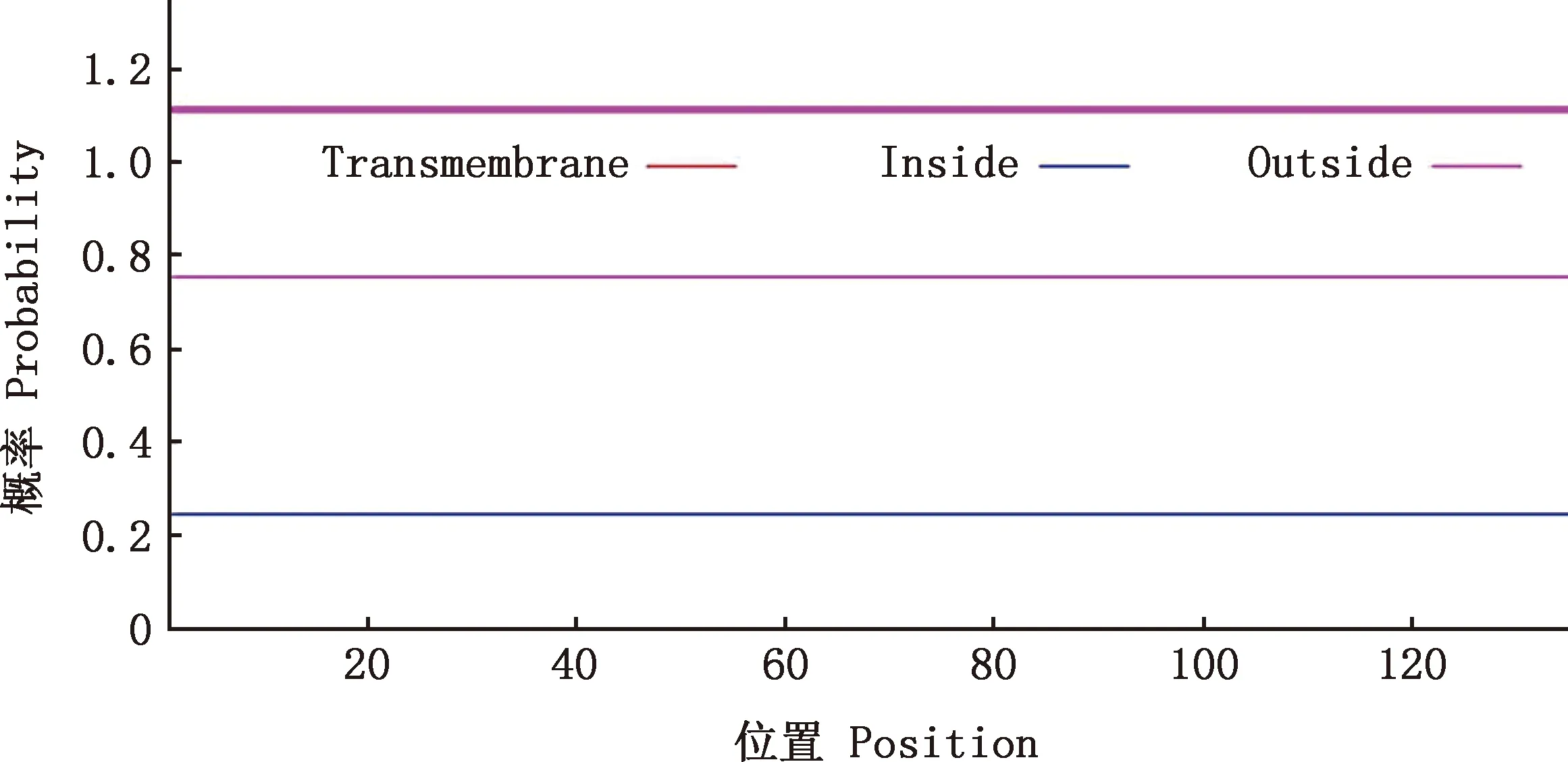
图5 白来航鸡Gal-1蛋白跨膜结构域预测Fig.5 Transmembrane domain prediction of Gal-1 protein in White Leghorn chickens
图6 白来航鸡Gal-1蛋白信号肽预测Fig.6 Signal peptide prediction of Gal-1 protein in White Leghorn chickens
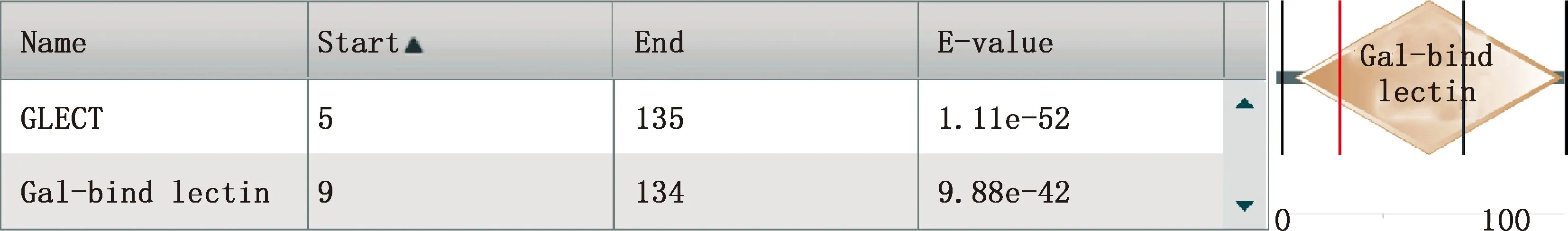
图7 白来航鸡Gal-1蛋白保守结构域预测Fig.7 Conserved structure domain prediction of Gal-1 protein in White Leghorn chickens
2.3.4 磷酸化位点与糖基化位点预测 蛋白修饰结构预测结果表明,该蛋白有6个丝氨酸(Ser)磷酸化位点、6个苏氨酸(Thr)磷酸化位点和1个酪氨酸(Tyr)磷酸化位点(图8);不存在O-糖基化位点,在第94位天冬酰胺残基的酰胺氮原子处存在1个N-糖基化修饰位点(图9),其概率为0.5062。
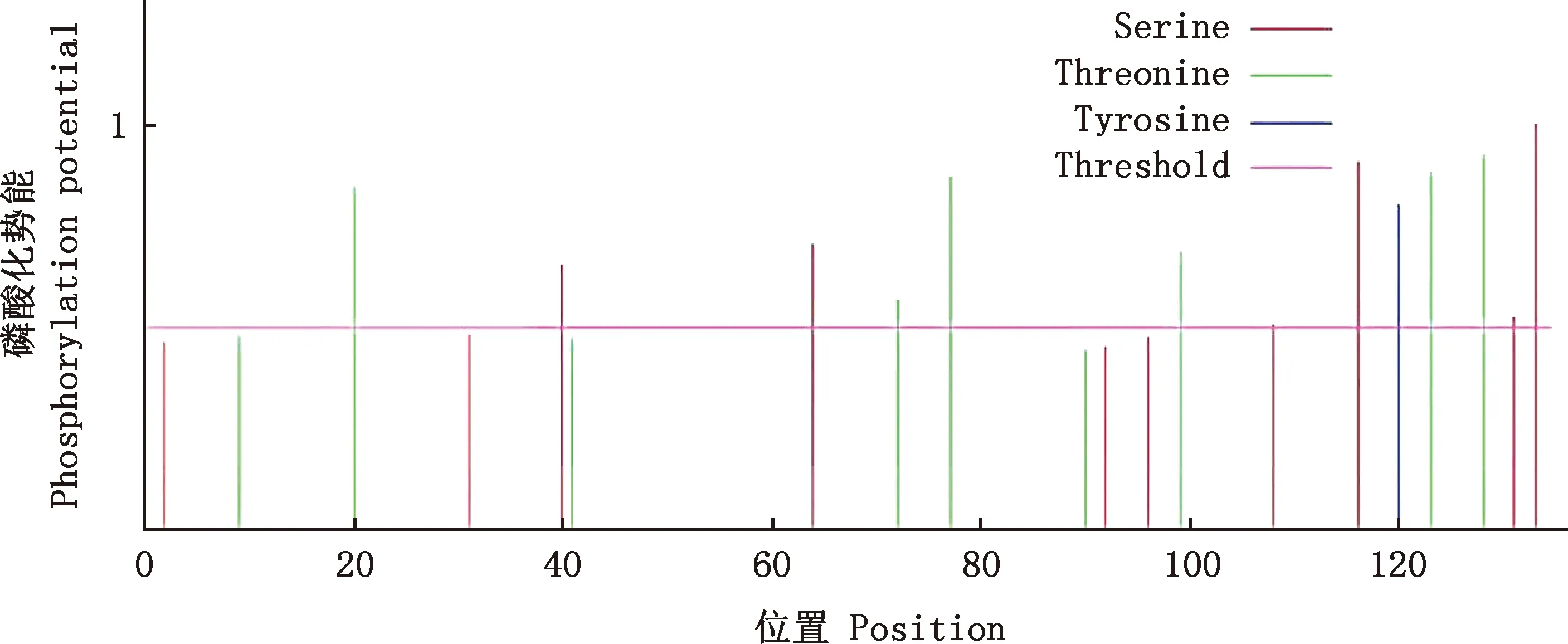
图8 白来航鸡Gal-1蛋白磷酸化位点预测Fig.8 Phosphorylation site prediction of Gal-1 protein in White Leghorn chickens
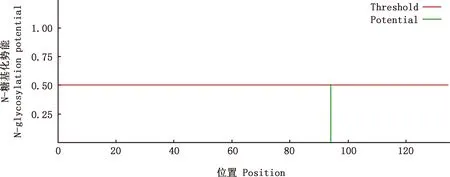
图9 白来航鸡Gal-1蛋白N-糖基化位点预测Fig.9 N-glycosylation site prediction of Gal-1 protein in White Leghorn chickens
2.3.5 二级结构与三级结构预测 利用SOPMA在线软件预测Gal-1蛋白二级结构,结果显示,该蛋白由α-螺旋、β-折叠、延伸链及无规则卷曲组成,所占比例分别为2.22%、10.37%、41.48%和45.93%(图10);利用SWISS-MODEL预测该蛋白的三级结构,结果显示,三级结构主要由无规卷曲及延伸链构成(图11),与二级结构预测结果一致。
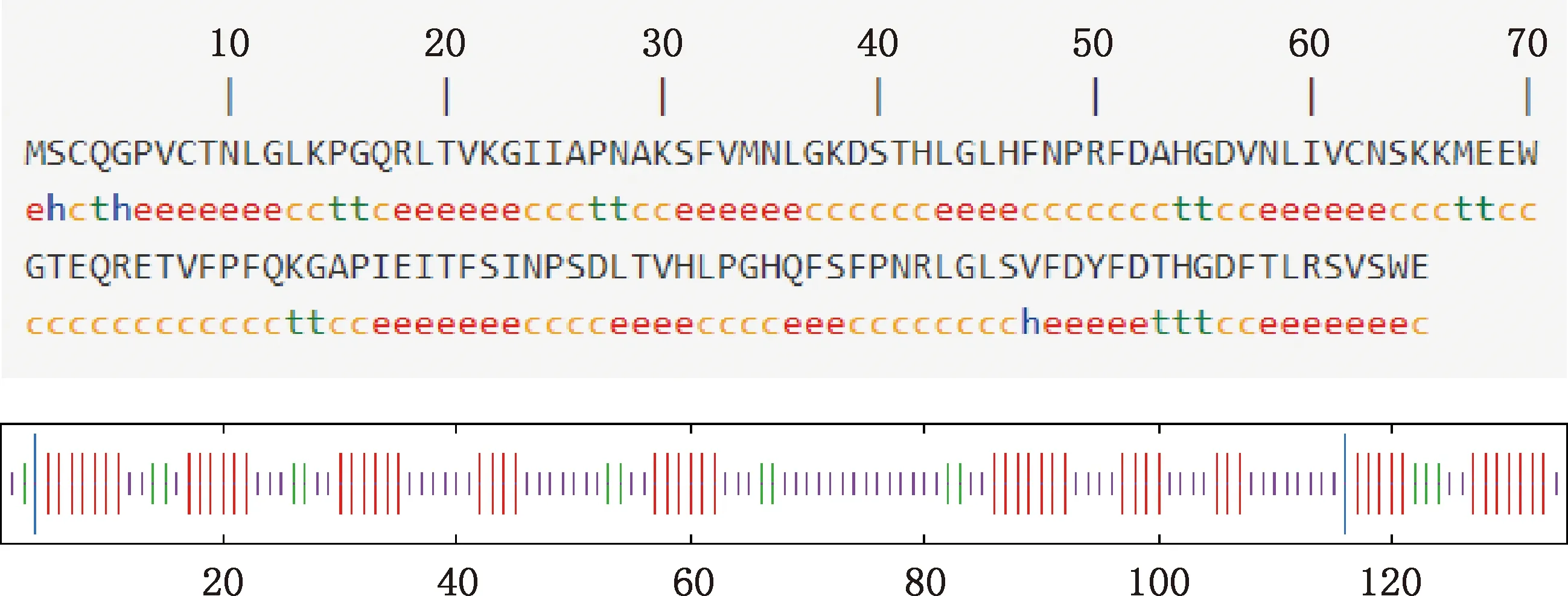
①h,α-螺旋;t,β-转角;c,无规则卷曲;e,延伸链。②线条从长到短依次代表α-螺旋、延伸链、β-转角和无规则卷曲 ①h,Alpha helix;t,Beta turn;c,Random coil;e,Extended chain.②The lines by the length represent alpha helix,extended chain,beta turn and random coil,respectively图10 白来航鸡Gal-1蛋白二级结构预测Fig.10 Secondary structure prediction of Gal-1 protein in White Leghorn chickens

图11 白来航鸡Gal-1蛋白三级结构预测Fig.11 Tertiary structure prediction of Gal-1 protein in White Leghorn chickens
2.4 Gal-1基因在鸡各组织中的表达
由图12可知,Gal-1基因在肺脏中的表达量显著高于其他组织(P<0.05),在脑中表达量最低。在不同组织中的表达排序为:肺脏>盲肠>脾脏>直肠>空肠>肌胃>腺胃>十二指肠>腿肌>肝脏>肾脏>胸肌>心>脑。
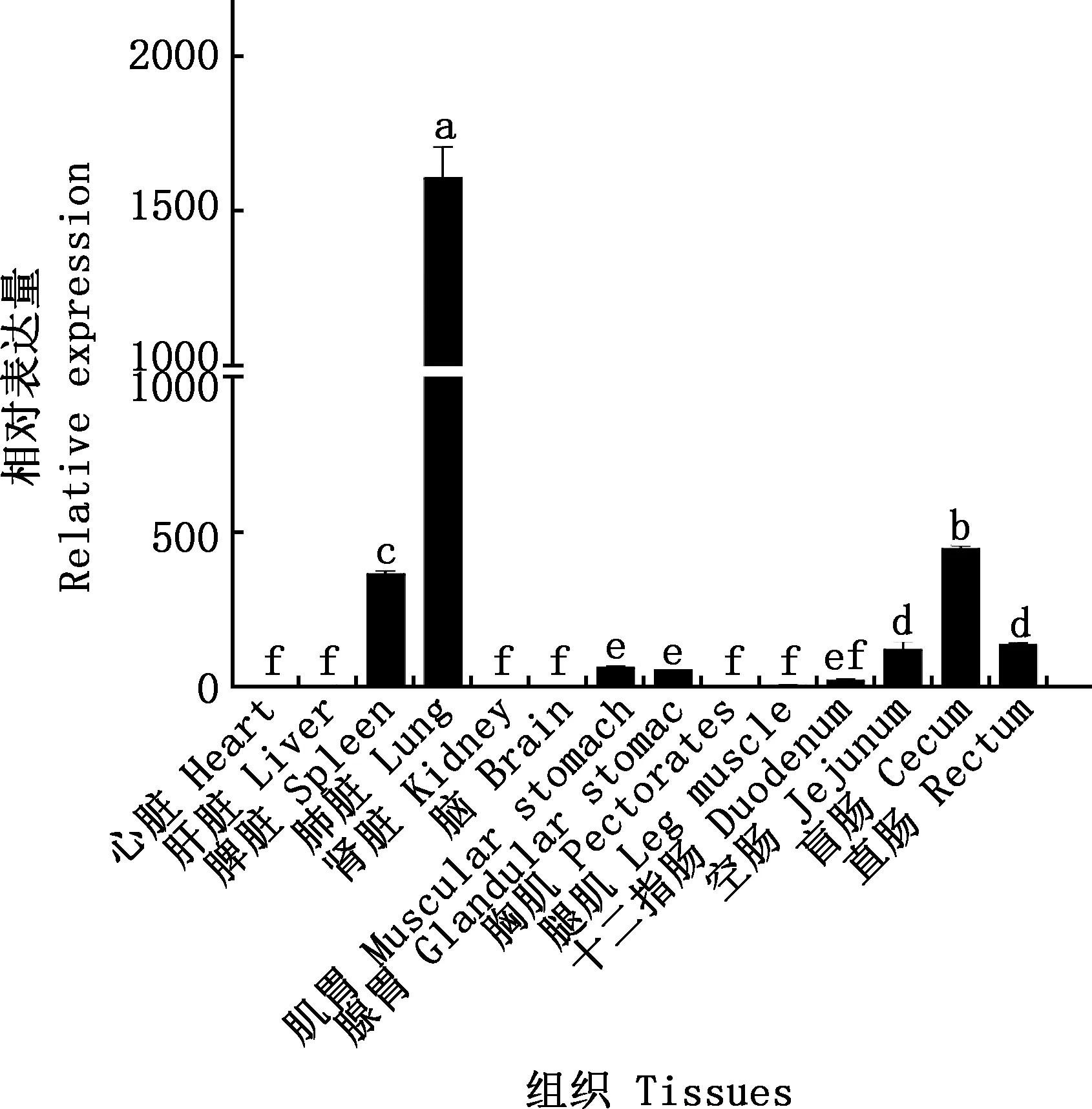
肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05) Values with different letter superscripts mean significant difference (P<0.05);While with the same letter superscripts mean no significant difference (P>0.05)图12 Gal-1基因在白来航鸡不同组织中的相对表达量Fig.12 Relative expression of Gal-1 gene in different tissues of White Leghorn chickens
3 讨 论
半乳糖凝集素是一类多功能凝集素,在病原体黏附宿主细胞和激活宿主固有免疫和适应性免疫中发挥关键作用,其不仅可以作为模式识别受体,还可以作为效应因子,通过促进吞噬、自噬等方式调节机体反应[10]。Gal-1是一种结合β-半乳糖苷的哺乳动物凝集素,可表达于多种类型的细胞,通过调节细胞与细胞、细胞与基质的黏附,在诱导凋亡、影响细胞间信号转导等方面发挥作用[11-12]。Gal-1可通过与囊膜病毒表面的糖蛋白结合,介导宿主与病原体之间的相互作用[13-15],已有研究结果表明,Gal-1与猪繁殖与呼吸综合征病毒(PRRSV)膜蛋白 E相互作用抑制病毒的复制,此外,Gal-1可抑制猪瘟病毒、伪狂犬病病毒、马动脉炎病毒、日本脑炎病毒和猪流行性腹泻病毒等多种病毒复制[16]。本研究结果表明,Gal-1基因CDS区长度为408 bp,编码135个氨基酸,编码蛋白无跨膜区、不含信号肽,这与Han等[9]和赵志峰等[17]对樱桃谷鸭和梅花鹿的Gal-1基因研究结果一致。本研究对Gal-1基因编码蛋白跨膜结构及信号肽预测结果提示该蛋白可能在细胞内发挥生物学功能,与Camby等[18]研究发现Gal-1基因主要分布于细胞质,可能通过与细胞质蛋白和细胞核中的核糖核蛋白结合,在转录调节、mRNA前体剪切和转运过程中发挥功能的预测结果一致。本研究对白来航鸡Gal-1基因编码蛋白潜在磷酸化位点和糖基化位点预测分析结果显示,该编码蛋白共有13个潜在磷酸化位点和1个N-糖基化位点,提示这些位点作为Gal-1蛋白翻译后修饰的关键位点可能在其发挥信号转导、免疫等生物学功能中起到一定作用。本研究通过预测分析鸡Gal-1基因编码蛋白的结构及功能,可为Gal-1蛋白的抗病毒功能的深入研究提供参考依据。
Han等[9]对樱桃谷鸭Gal-1基因组织表达特性研究发现,Gal-1在健康樱桃谷鸭心脏、肺脏、脾脏、肾脏、食管、气管等不同组织中均有不同程度的表达。本试验利用实时荧光定量PCR对白来航鸡Gal-1基因分析显示,该基因在白来航鸡心脏、肝脏、脾脏、肺脏、肾脏、脑、十二指肠、空肠、盲肠、直肠、腺胃、肌胃、胸肌、腿肌组织中均有表达,其中在肺脏中表达量最高,在脑中表达量最低,提示Gal-1基因广泛分布于宿主的先天免疫系统中,且其表达量具有组织特异性。Gal-1一般可参与肿瘤细胞的各个发展阶段,在肿瘤的发展和转移中发挥重要作用[19-20]。高波波等[21]研究表明,肺癌组织中Gal-1基因阳性表达率较高,张卉等[22]研究证实Gal-1基因在结肠腺癌组织中高表达,且与结肠腺癌的发生、发展密切相关。此外,研究发现Gal-1基因在多种肿瘤如黑色素瘤、星形细胞瘤、前列腺癌、甲状腺肿瘤等中的表达均增高[23]。因此,抑制Gal-1被认为是潜在的治疗癌症的方法之一[24]。Gal-1还能够与CD4细胞特异性结合,被认为是开发抗艾滋病药物的有效分子靶点[25]。本试验通过对白来航鸡Gal-1基因编码蛋白进行生物信息学分析预测及组织表达特性分析,为后续研究Gal-1基因在先天免疫系统中的作用提供数据支撑,并为Gal-1编码蛋白功能的深入研究奠定基础。
4 结 论
本试验成功克隆了白来航鸡Gal-1基因CDS序列,其全长为408 bp,编码135个氨基酸。Gal-1基因编码蛋白不属于分泌蛋白,不存在跨膜结构,无信号肽,为稳定的亲水性蛋白。Gal-1基因在鸡不同组织中均有表达,其中在肺脏表达量最高,在脾脏和盲肠表达量相对较高,在脑中表达量最低。

