温湿度与光照对葡萄霜霉病菌孢子囊萌发及存活的影响
李卓,金恭玺,郎宁,孙琦,任毓忠,赵宝龙,张莉,李国英
(石河子大学绿洲农作物病害防治重点实验室,新疆石河子 832000)
温湿度与光照对葡萄霜霉病菌孢子囊萌发及存活的影响
李卓,金恭玺,郎宁,孙琦,任毓忠,赵宝龙,张莉,李国英
(石河子大学绿洲农作物病害防治重点实验室,新疆石河子 832000)
【目的】研究温湿度、光照对葡萄霜霉病菌孢子囊萌发及存活的影响,为葡萄霜霉病的预报与防治提供理论依据。【方法】通过人工控制温湿度、光照等三因子交叉试验设计和人工接种叶盘的方法,明确孢子囊萌发的条件及存活的气象因子。【结果】孢子囊只有在水中才能够萌发并释放游动孢子,最适萌发温度是18~22℃。孢子囊的存活与温度,湿度,光照有较密切的关系,在35℃,70%和100%湿度条件下,孢子囊只能存活3 d。而在10~20℃各个湿度条件下,无论完全光照、完全黑暗或光暗交替孢子囊都可存活6 d以上。用干瘪的孢子囊接菌叶盘,仍然发病,说明不能用干瘪孢子囊作为孢子囊死亡的标志。孢子囊经0.58×102μW/cm2的紫外光照射5 h、直射光照射8 h就死亡,但散射光照射10 h孢子囊仍然存活。【结论】孢子囊只有在水中才能萌发,水是孢子囊萌发的决定性因素;萌发的最适温度为18~22℃;孢子囊对紫外光比较敏感,在光照强度为65 000~107 100 lx的直射光下8 h孢子囊就死亡。
葡萄霜霉病;温湿度与光照;孢子囊;萌发;存活
0 引 言
【研究意义】葡萄霜霉病是一种流行性很强的多循环病害,主要依靠气流和雨水传播,在葡萄生长季节该病菌主要以孢子囊的形式进行多次再侵染,一旦气候条件适合,可产生大量的孢子囊,很易暴发成灾[1]。【前人研究进展】葡萄霜霉病的发生对气候条件的要求比较严格,其中主要是孢子囊的萌发和侵染要求的条件比较严格。对此国内外学者都曾进行过不少研究,但其结论并非完全一致。Thind和Galet等[2,3]认为,孢子囊萌发释放游动孢子的温度为3~30℃,最适温度为22~25℃。李怀方等[4]认为,孢子囊萌发的温度范围为12~30℃,最适温度18~24℃;董金皋[5]认为孢子囊萌发的温度范围为5~21℃,最适温度10~15℃;他们都认为孢子囊萌发需要在水滴中进行;而孢子囊存活时间较短,在高温干燥环境中,存活4~6 d,低温环境中可存活14~16 d。邱强等[6]报道,湿度不够或过高,孢子囊萌发长出芽管,孢子囊的存活力随温度升高、湿度降低而降低,在30℃时仅能存活6 h,对低湿度敏感。Kennelly等[7]认为园内温度超过42.8℃,霜霉菌孢子囊就会死亡,大多数新生的孢子囊通常在白天会被杀死,然而在黑暗环境中,12~24 h后50%以上的孢子囊仍然可以产生并释放游动孢子。【本研究切入点】不同地区的报道存在较大差异。研究针对以往多从单因子入手研究气候因子对孢子囊萌发的影响,改为三因子交叉试验设计进行研究;对孢子囊死亡的鉴别除观察其形态变化外,还采用人工接种的方法观察其致病性的有无;只有其形态改变,并丧失致病性,才认为已经死亡。【拟解决的关键问题】研究孢子囊萌发及存活的最适温湿度和光照条件,为葡萄霜霉病的测报与防治提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 同龄孢子囊的获取
实验前1 d的20:00~21:00在石河子大学试验站葡萄园感病品种无核紫上采集典型新鲜的霜霉病叶,用流水冲洗10 min,直至霉层完全冲净,室温下放置10 min,使叶片表面无明显水分,然后在保湿缸中20 ℃黑暗条件下保湿培养12 h,待病部生长出新的孢子囊,即视为同龄孢子囊。
1.1.2 供试品种及叶盘的制备
供试品种为感病品种红地球,每次实验前从健株红地球新梢上选取倒数第3~6片展开的健康新叶,用直径2 cm灭菌打孔器打孔,制成2 cm直径的叶盘,放到保湿的塑料袋中供接种用。
1.1.3 主要仪器
培养箱:上海一恒科学仪器有限公司生产的MGC-250型智能型光照培养箱,HOBO记录仪:Oneset Computer Corporation生产的U12-012 Temp/RH/Light /External Data Logger,透明塑料盒10×10×5 cm3,凹玻片,照度计:优利德数字式照度计UT381/382 照度仪,紫外辐照仪:上海嘉定学联实业有限公司学联仪表厂生产的ZDZ-1型自动换挡外辐射照度计,紫外灯:上海惠光照明生产的紫宝牌ZWS、8W紫外杀菌灯管、1%水琼脂平板。
1.2 方 法
1.2.1 气候因子对霜霉病菌孢子囊萌发的影响
光照采用3种处理:完全光照(光照强度为14 000 Lx)、完全黑暗和光暗交替(以12 h光照,12 h黑暗为一个光周期)。温度采用10种处理:10、15、16、18、20、22、24、25、30和35℃。相对湿度(RH)采用5种处理:85%、90%、95%、100%和游离水,共150个组合处理,每种组合处理均设3次重复。共观察7次,分别为接种后2、4、6、8、10、12和24 h。培养箱内设定上述对应的光照和温度,其内不同湿度场的配制按照国家标准(GB/T 15309-94)[8],即用不同浓度丙三醇溶液配制而成,将塑料盒放于培养箱中,盒中加入二分之一体积不同浓度丙三醇溶液分别制成85%、90%、95%、100%的不同湿度场,温、湿度场及光照用HOBO调试校对。
将制备的新鲜同龄孢子囊用小排笔刷到灭菌的平皿中混匀,再用小排笔刷到凹玻片上,游离水处理组是将上述同龄孢子囊加无菌水混匀制成悬液,将悬液滴到1%水琼脂平板表面。将载有孢子囊的凹玻片和水琼脂平板放置于配置好的150个不同温湿度和光照处理的环境中,分别以规定时间进行镜检,每种处理的每个重复随机观察3个视野,每个视野100个孢子囊,记录萌发率。
1.2.2 温湿度和光照条件对霜霉病菌孢子囊存活的影响
1.2.2.1 不同温湿度和光照对葡萄霜霉菌孢子囊存活的影响
不同温度设置为10、15、20、25、30和35℃,光照条件的设置与1.2.1相同,相对湿度(RH)采用3种处理:40%、70%和100%,湿度场的配置方法与1.2.1相同;共54个组合,每个组合均设3次重复。均于处理后1、3和6 d测定孢子囊的萌发率,并接种观察其致病性。以孢子囊不能萌发,接种后也不能致病作为孢子囊死亡的依据。
将制备的新鲜同龄孢子囊用小排笔轻轻拍打到灭菌的培养皿中,使其孢子囊均匀且薄薄地平铺于皿底,分别置于所设不同温湿度及光照条件下的54个组合处理中。经1、3和6 d后,滴加无菌水混匀制成孢子囊悬液,供以下三种处理用:其中一部分用于检测孢子囊在水中24 h后的萌发率,即将孢子囊悬液滴加到1%水琼脂平板表面,置于100%湿度场中,20℃黑暗条件放置24 h后,随即镜检,观察3个视野,每个视野100个孢子囊,记录孢子囊的萌发率。另一部分配成1×105个/mL孢子囊悬浮液,用叶盘法[9]进行接种。即将该浓度的孢子囊悬浮液滴加到准备好的红地球品种的叶盘上,用于叶盘法[9]接种。设9个重复,置于20℃黑暗条件下培养7 d,观察其致病性。剩余者立即镜检观察孢子囊的干瘪情况。
1.2.2.2 紫外线照射对葡萄霜霉菌孢子囊存活的影响
实验在25℃,相对湿度41%的培养箱内进行。分为紫外线照射和完全黑暗(对照)两种处理。紫外线由培养箱内紫外灯提供,所有处理放置在距紫外灯50 cm处,该处的UVC紫外辐照度经测定为0.58×102μW/cm2。紫外照射时间分别为0、10、20、30、60、120、180、240、300、360、420、480、540和 600 min,照射结束后按1.2.1中的方法分别测定其孢子囊的萌发率和致病性,以相同时间黑暗条件处理组的孢子囊萌发率和致病性为对照,每个处理设3次重复。两者结果进行比较,明确紫外线照射对葡萄霜霉菌孢子囊存活的影响。
1.2.2.3 自然光对葡萄霜霉菌孢子囊存活的影响
自然光设三种处理:直射光、散射光和完全黑暗。实验于2015年7月27日10:00~20:00时完全晴朗天气下进行,在室外阳光充沛处放置一张方桌,桌面铺有隔热材料,将盛有孢子囊的无盖平皿置于隔热材料上。直射光处理即直接放在阳光下直射,每隔1 h用照度计测定一次光照强度;散射光处理是在盛有孢子囊的平皿上部30 cm处用遮阳网遮阴,同样每隔1 h照度计测定一次光照强度;完全黑暗处理是用不透光塑料盒将平皿封盖。分别处理0、1、2、3、4、5、6、、8、9和10 h,后按1.2.1中的方法测定孢子囊的萌发率和致病性;并观察不同时间内孢子囊的干瘪情况,每种处理3次重复。
2 结果与分析
2.1 温湿度与光照对霜霉病菌孢子囊萌发的影响
研究表明,在供试温度范围内,孢子囊在85%、90%、95%和100%的相对湿度环境中,无论完全黑暗、完全光照和光暗交替的环境,其萌发率均为0,即不能萌发,只有在水中可以萌发,说明水是孢子囊萌发的决定性因素,这与葡萄生长季节只要遇阴雨连绵的天气,葡萄霜霉病便会暴发性流行的情况是一致的。
在水中无论完全光照、完全黑暗和光暗交替的环境,孢子囊在10~25℃的水中均可萌发,且以18~22℃孢子囊的萌发率最高,24℃其萌发率有明显下降,30和35℃孢子囊均不能萌发,且均以完全黑暗萌发率较高,其次是光暗交替,说明光照对孢子囊萌发有一定的影响。图1
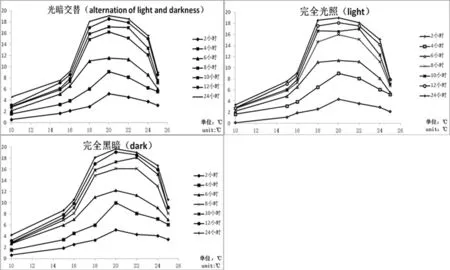
图1 不同温度、光照条件下的孢子囊在水中萌发率
Fig.1 The germination rate of sporangium urder different temperatures and light in the water
2.2 温度、湿度和光照对霜霉病菌孢子囊存活的影响
2.2.1 不同温度、湿度、光照对霜霉菌孢子囊存活的影响
研究在54个温度、湿度和光照组合处理中,无论是置于完全光照,光暗交替,还是完全黑暗,24 h后孢子囊在水中均可萌发,且具致病性;且以6~8 h内的萌发率最高,以后则增加的不够明显;在高温高湿条件下孢子囊容易死亡,而低温干燥的条件下,孢子囊的存活时间较长。如在相对湿度100%、30~35℃条件下,孢子囊在3 d后萌发率为0,并失去致病力,则认为已经死亡;而置于较低温度和湿度的处理下,孢子囊既可萌发,也能致病。又如相对湿度100%、25℃条件下6 d后的孢子囊就不能萌发,也失去致病能力;而置于10、15和20℃和较低湿度的孢子囊仍可萌发,且具有致病力,说明低温低湿的条件有利于孢子囊的存活。另外,以往认为干瘪的孢子囊都已死亡,但事实并非完全如此,实验中发现有些干瘪的孢子囊置于水中,不仅可以恢复原状,用其接种也可致病,据此认为干瘪的孢子囊并非都已死亡,如在35℃,相对湿度40%,处理第6 d的孢子囊全部干瘪,但用干瘪的孢子囊接种叶盘,发现仍然发病,所以不能用干瘪的孢子囊作为死亡的标志。图2~4
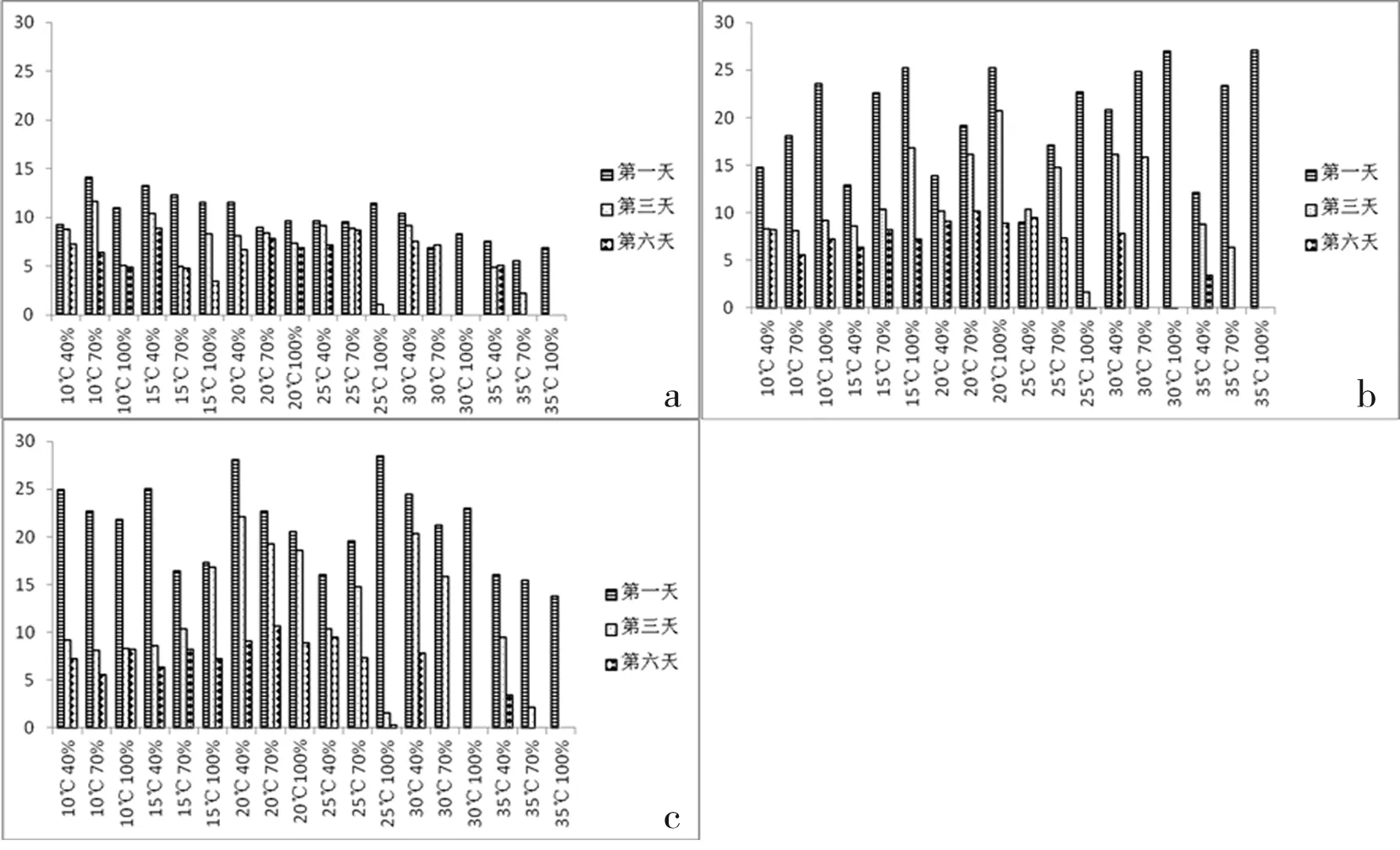
a.完全黑暗; b.光暗交替; c.完全光照
a.dark; b.alternation of light and darkness; c.light
图2 不同温度、湿度、光照条件下霜霉菌孢子囊萌发率
Fig.2 The sporangia germination rate under different temperatures, humiditys and light

注:a. 处理前的孢子囊形态;b.干瘪的孢子囊形态;c. 干瘪孢子囊在水中不能恢复的形态;d.干瘪孢子囊在水中恢复的形态
Note: a. the sporangium morphology before the treatment; b. the withered sporangium; c. The cannot recovered sporangium in water; d. The recovered sporangium in water
图3 处理前后孢子囊形态对比
Fig.3 The morphological comparison of sporangium before and after the treatment

图4 完全黑暗条件下,不同温湿度处理第6 d的孢子囊接菌新鲜的叶盘,7 d后的叶盘发病情况(黑色框内为未发病的叶盘)
Fig.4 The sporangium, which had been treated by different temperatures and humidity six days in the dark, was inoculated in the leaf disk seven days, and then the incidence was observed
2.2.2 紫外线照射对葡萄霜霉菌孢子囊存活的影响
研究表明,孢子囊对紫外光比较敏感,在25℃、相对湿度41%的培养箱中,经紫外强度为0.58×102μW/cm2UVC照射5 h后,孢子囊既不能萌发,也无致病性,说明孢子囊已经死亡;而对照(黑暗处理)即使10 h,孢子囊仍有较高的萌发率和致病能力,由此说明孢子囊对紫外光比较敏感。图5
2.2.3 自然光对葡萄霜霉菌孢子囊存活的影响
在温度为22~37℃,相对湿度为36%~66%的条件下,将霜霉病菌的孢子囊分别置于直射光、散射光和完全黑暗的条件下,其孢子囊的萌发率和存活情况存在明显区别。实验证明,以直射光照射对孢子囊的杀伤力最强,经2 h直射光照射(光照强度为65 000~88 000 lx)后,其萌发率开始较明显下降,但仍具有致病性,4 h后萌发率大幅度降低,6 h时孢子囊出现部分干瘪现象,8 h时萌发率降到0,此时用其接种的叶盘已不发病,表明孢子囊已经死亡。散射光对孢子囊的杀伤力明显减弱,在此条件下即使放置10 h,仍然具有一定的萌发率和致病力;而在完全黑暗的条件下放置10 h后,其萌发率和致病性仍然较高,据此在病害初发期选择高温晴朗的天气摘除病叶,对该病的防治具有重要的意义。表1

图5 紫外光处理后葡萄霜霉菌孢子囊萌发率
Fig.5 The germination rate of grape downy mildew sporangium which was treated by ultraviolet light
表1 自然光处理后葡萄霜霉菌孢子囊存活率和致病性
Table 1 The survival rate and pathogenicity of grape downy mildew sporangium which was treated by natural light
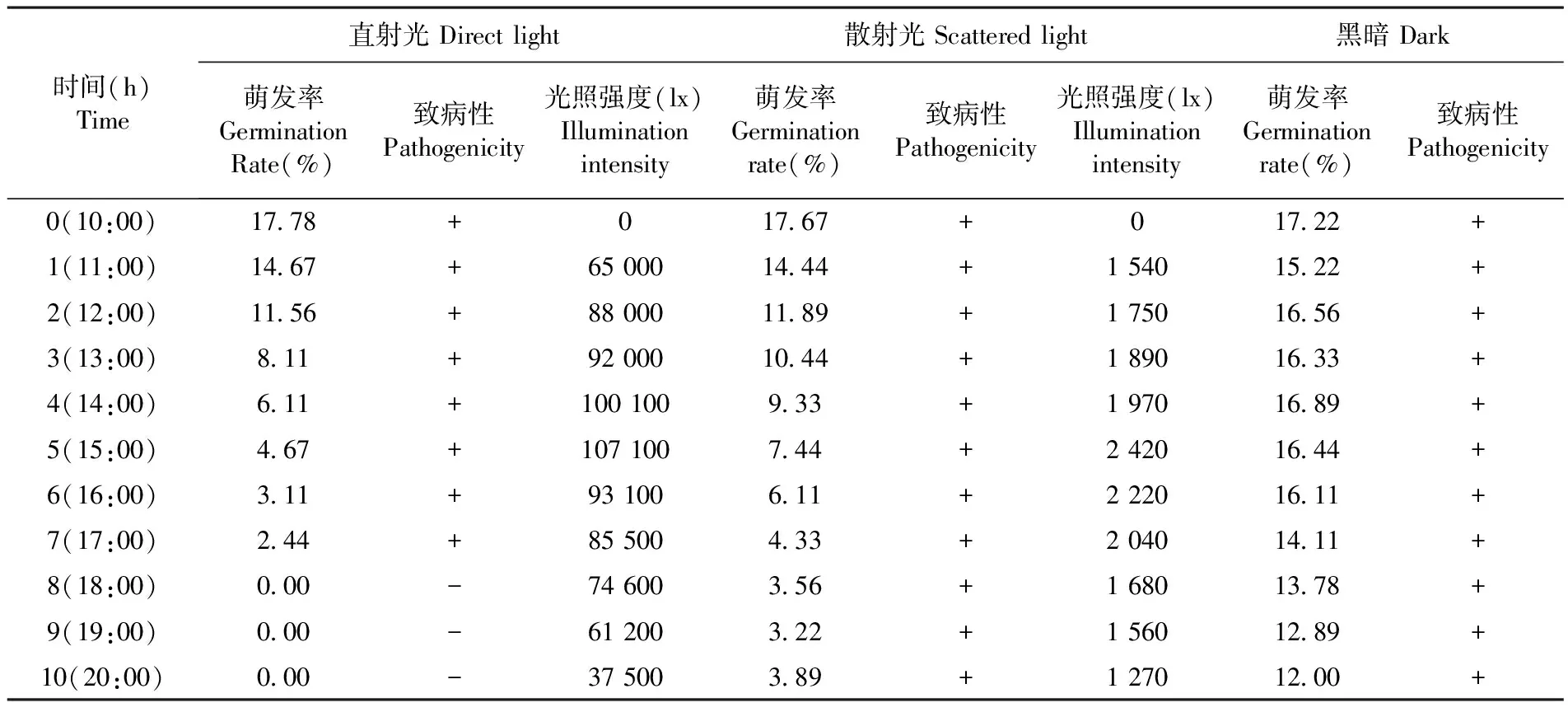
时间(h)Time直射光Directlight散射光Scatteredlight黑暗Dark萌发率GerminationRate(%)致病性Pathogenicity光照强度(lx)Illuminationintensity萌发率Germinationrate(%)致病性Pathogenicity光照强度(lx)Illuminationintensity萌发率Germinationrate(%)致病性Pathogenicity0(10:00)1778+01767+01722+1(11:00)1467+650001444+15401522+2(12:00)1156+880001189+17501656+3(13:00)811+920001044+18901633+4(14:00)611+100100933+19701689+5(15:00)467+107100744+24201644+6(16:00)311+93100611+22201611+7(17:00)244+85500433+20401411+8(18:00)000-74600356+16801378+9(19:00)000-61200322+15601289+10(20:00)000-37500389+12701200+
注:+ 有致病性,- 无致病性
Note:+ pathogenicity,- no pathogenicity
3 讨 论
经不同温度、湿度和光照条件对葡萄霜霉菌孢子囊萌发的研究,结果表明,该菌的孢子囊只有在水中才能萌发,即使100%湿度下都不能萌发,水是葡萄霜霉菌孢子囊萌发和侵染的决定性因素,也是测报中最重要的依据,这一结果与国淑梅等[10]对黄瓜霜霉病的描述相符;研究表明,该菌孢子囊在10~25℃的水中均可萌发,萌发的最适温度为18~22℃左右,与李怀方[4]与Keil等[11]最适侵染温度最适萌发温度较一致。与其他学者[12-18]的研究有一定的差别。
没有把孢子囊干瘪作为孢子囊死亡的标志,主要考虑到孢子囊出现干瘪后部分在水中不仅可恢复原来形状,且仍可侵染。如在完全光照25℃,40%相对湿度的条件下,6 d后孢子囊出现干瘪现象,但在水中仍可恢复原来的形状,用干瘪的孢子囊接种新鲜的叶盘,7 d后叶盘仍然发病,故不能把孢子囊干瘪作为孢子囊死亡的标志。具体孢子囊干瘪多长时间才失去侵染力,有待继续研究。初步认为孢子囊因水分蒸发导致干瘪,但并不很快失去致病力的这种现象,可能是该菌对不良环境适应的一种结果。
关于孢子囊存活与温湿度的关系,一般认为孢子囊的存活时间很短,在高温干燥环境中,只能存活4~6 d,低温环境中可存活14~16 d。也有认为孢子囊的存活力随温度的升高,湿度降低而降低,在30℃时仅能存活6 h,对低湿度敏感。实验查明,低温干燥的条件有利孢子囊的存活。
实验还证明,孢子囊对紫外光比较敏感,经紫外强度为0.58×102μW/cm2紫外线照射5 h后,孢子囊就死亡。自然光的实验表明,直射光照射对孢子囊的杀伤力较强,照射1 h后,其萌发率开始下降,8 h后孢子囊就死亡。散射光照射10 h后孢子囊仍能萌发致病,说明散射光对孢子囊的杀伤力明显减弱。这一结果与国淑梅等[10]对黄瓜霜霉病菌的研究结果比较一致。
在自然条件下,夏季阴雨连绵、气温较低的气候有利于孢子囊大量萌发和侵染,这与2007和2013年6、7月间新疆葡萄霜霉病暴发性发生与流行的情况是十分吻合的。
4 结 论
孢子囊只有在水中才能萌发,水是孢子囊萌发的决定性因素。在水中无论完全光照、完全黑暗和光暗交替的环境,孢子囊在10~25 ℃均可萌发,其萌发的最适温度为18~22℃左右,30℃以上孢子囊均不能萌发。高温高湿条件下孢子囊容易死亡,而低温干燥的条件有利于孢子囊的存活。用干瘪的孢子囊接种叶盘,仍然发病,说明孢子囊干瘪后并非马上死亡,不能用干瘪孢子囊作为孢子囊死亡的标志。孢子囊对紫外光比较敏感,经紫外强度为0.58×102μW/cm2照射5 h后,孢子囊死亡,直射光对孢子囊的杀伤力也很强,夏季经2 h直射光照射(光照强度为65 000~88 000 lx)后,其萌发率开始较明显下降,4 h后萌发率明显降低,8 h时孢子囊死亡。
References)
[1] 吉丽丽, 李海强, 任毓忠,等. 葡萄霜霉菌孢子囊扩散动态及与田间病情的相关性[J]. 果树学报, 2012,29(1):94-98.
JI Li-li, LI Hai-qiang, REN Yu-zhong, et al. (2012). Dynamics of sporangium diffusion of Plasmopara viticola and its correlation with disease incidence in vineyard [J].JournalofFruitScience, 29(1):94-98. (in Chinese)
[2] Thind, T. S., Arora, J. K., Mohan, C., & Raj, P. (2004).EpidemiologyofPowderyMildew,DownyMildewandAnthracnoseDiseasesofGrapevine.DiseasesofFruitsandVegetablesVolumeI. Springer Netherlands.
[3] ALET, P( 1977):.LESMaladiesetlesparasitesdelavigne.Champignosetlesvines. Vol.1. France: Paysan la Midi Montpellier, 871.
[4] 李怀方, 刘凤权, 郭小密. 园艺植物病理学[M]. 北京:中国农业大学出版社, 2001:122-123.
LI Huai-fang, LIU Feng-quan, GUO Xiao-mi. (2001).GardeningPlantPathology[M]. Beijing: China Agricultural University Press: 122-123. (in Chinese)
[5] 董金皋. 农业植物病理学[M]. 北京:中国农业出版社:2007:323-324.
DONG Jin-hao.(2007).AgriculturalPhytopathology[M]. Beinjing: China Agriculture Press: 323-324. (in Chinese)
[6] 邱强. 原色葡萄病虫图谱 [M]. 北京:中国科学技术出版社, 2000:44-48.
QIU Jiang.(2000).PrimaryGrapeDiseasesandPestsAtlas[M]. Beijing: China Science and Technology Press: 44-48. (in Chinese)
[7] Kennelly, M. M., Gadoury, D. M., Wilcox, W. F., Magarey, P. A., & Seem, R. C. (2007). Primary infection, lesion productivity, and survival of sporangia in the grapevine downy mildew pathogen plasmopara viticola.Phytopathology, 97(4):512-522.
[8] GB/T 15309-94,附录A: 饱和盐溶液、丙三醇溶液标准湿度场测试方法[S].
GB/T 15309-15309, appendix A. (1995) :saturatedsaltsolution,glycerolsolutionstandardhumidityfieldtestmethods.(in chinese)
[9] 汤钿.葡萄霜霉病离体接种方法的研究[J]. 微生物学通报, 1994,21(6):373-374 .
TANG Tian. (1994). The Study of Vitro Inoculation Methods in the Grapevine Downy Mildew Pathogen [J].MicrobiologyChina, 21(6):373-374. (in Chinese)
[10] 国淑梅,牛贞福. 温湿度对黄瓜霜霉菌病斑产孢和孢子囊萌发的影响[J].北方园艺, 2012,(13):151-153.
GUO Shu-mei, NIU Zhen-fu.(2012). Effect of Temperature and Moisture to Sporangium Germination and Formation of Cucumber Downy Mildew[J]NorthernHorticulture, (13):151-153. (in Chinese)
[11] Laviola, C., Burruano, S., & Strazzeri, S. (1986). Influenza della temperatura sulla germinazione delle oospore di plasmopara viticola (berk et curt.) berl. et de toni.PhytopathologiaMediterranea, 25(1/3):80-84.
[12] Gregory C T.( 1915).Studies on Plasmopara viticola (Downy Mildew, The official report of the session of the International Congress of Viticulture: 126-150.
[13] Kortekamp, A., Wind, R., & Zyprian, E. (1998). Investigation of the interaction of plasmopara viticola with susceptible and resistant grapevine cultivars.JournalofPlantDiseases&Protection, 105(5):475-488.
[14] Galet P,Les maladies et les parasites de la vigne. Tome 1, Imprimerie du Paysan du Midi: Montpellier,1977.
[15] Caffi, T., Legler, S. E., González-Domínguez, E., & Rossi, V. (2015). Effect of temperature and wetness duration on infection by plasmopara viticola, and on post-inoculation efficacy of copper.EuropeanJournalofPlantPathology: 1-14.
[16] 常永义,朱建兰.全球红葡萄霜霉病防治及病菌生物学特性研究[J].中外葡萄与葡萄酒,2001,(1):17-20.
CHANG Yong-yi, ZHU Jian-lan.( 2001 ). Study on the Control of "Quan Qiu Hong" Grape Downy Mildew and Its Pathogen Biological Characteristics [J].Sino-OverseasGrapevine&Wine, (1):17-20. (in Chinese)
[17] 郭明浩, 李华, 杨永锋. 葡萄霜霉病原孢子囊萌发特性及其多元回归分析[C]//.第四届国际葡萄与葡萄酒学术研讨会论文集. 西安:陕西人民出版社, 2004:59-63.
GUO Ming-hao, LI Hua, YANG Yong-feng.(2004).GerminationCharacteristicsandMultipleRegressionAnalysisofSporangia,Plasmoparaviticola[C]//.Xián:TheProceedingoftheFourthConferenceonInternationalGrapeandWine,PublishedbyShanxiPeople'sPublishingHouse: 59-63. (in Chinese)
[18] Williams, M. G., Magarey, P. A., & Sivasithamparam, K. (2007). Effect of temperature and light intensity on early infection behaviour of a western australian isolate of plasmopara viticola, the downy mildew pathogen of grapevine.AustralasianPlantPathology, 36(4):325-331.
Fund project:Supported by the earmark funds for public welfare industry(201203035)
Effects of Temperature, Humidity and Illumination on the Germination and Survival of Sporangia of Downy Mildew of Grapes
LI Zhuo, JIN Gong-xi, LANG Ning, SUN Qi, REN Yu-zhong,ZHAO Bao-long, ZHANG Li, LI Guo-ying
(Key Laboratory of Prevention and Control of Oasis Crop Diseases, Shihezi University,ShiheziXinjiang832000,China)
【Objective】 The objective of this project is to study the effects of climate factors on the germination and survival of grape downy mildew sporangia, and provide the theoretical basis to control the disease.【Method】The survival and germination of sporangium was researched by controlling temperature, humidity, light and other climatic factors.【Result】The results showed that sporangia could germinate in water and release zoospores, and the optimum germination temperature was approximately 18-22℃. Sporangia survival was related to temperature, humidity, and light. At 35℃ and relative humidity of either 70% or 100%, sporangia died within three days. Sporangia survived for more than six days at 10-20℃, regardless of light conditions. Disease was observed when these shriveled sporangia were inoculated onto leaf discs. This indicated that shriveled sporangia cannot be used as an indicator whether the sporangia were dead or not. Sporangia were dead after illumination with 0.58 × 102μW / cm2of ultraviolet light for 5 h. The sporangium did not germinate and was not pathogenic after exposure to 8 h direct light. The sporangium survived with 10 h irradiance of scattered light.【Conclusion】Sporangia could germinate in water and release zoospores, and the optimum germination temperature is about to 18-22℃; the sporangium was sensitive to ultraviolet light. At the direct light intensity of 65,000-107,100 lx, the sporangium would die in 8 hours.
downy mildew of grape;temperature and humidity and light;sporangium;germination;survival
10.6048/j.issn.1001-4330.2016.11.017
2016-05-04
公益性行业专项(201203035)
李卓(1988-),女,甘肃人,硕士研究生,研究方向为葡萄病害及其防治,(E-mail)349927259@qq.com
张莉(1970-),女,江苏人,教授,研究方向植物病理学,(E-mail)1602784618@qq.com
李国英(1941-),男,河北人,教授,研究方向为植物病原真菌与真菌病害,(E-mail)lgyshu@163.com
S436.64
A
1001-4330(2016)11-2090-08

