甲状腺钙化性病变的超声和CT联合诊断
韩志江项晶晶包凌云陶晓峰
甲状腺钙化性病变的超声和CT联合诊断
韩志江1项晶晶2包凌云3陶晓峰4
甲状腺钙化性病变的CT检查中,钙化的大小、形态及分布对其良、恶性的判断具有重要价值,尤其是对超声不占优势的粗钙化和厚壁环状钙化。日常工作中,对甲状腺钙化性病变良、恶性的准确识别,有助于甲状腺恶性病变的早期手术治疗,同时减少良性病变不必要的手术创伤。
甲状腺结节;钙化;体层摄影术,X线计算机;超声检查
Int J Med Radiol,2016,39(4):416-421
钙化是甲状腺病变最常见的影像征象之一,占良性病变的15.7%~38.7%,占恶性病变的49.6%~78.8%[1-2]。近年来,随着对良、恶性病变钙化形成机制研究的深入,从影像诊断方面也为钙化性病变选择治疗方案提供了重要依据。超声因具有高软组织分辨力及经济、无创伤、无辐射等优势,在甲状腺钙化性病变的影像诊断中最常用,其在微钙化的观察及性质判断方面的价值也已得到广泛认可,但用于粗钙化和厚壁环状钙化诊断时由于钙化后方形成了显著声衰减,故在很大程度上减低其诊断价值。CT由于体层成像和软组织分辨力较低,对微钙化的显示不及超声,但其不受声衰减的影响,可以显示粗钙化和厚壁环状钙化的完整形态,并可通过比较增强前后钙化内部及周围软组织的强化程度,以及钙化周围伪影的情况,对甲状腺病变的良、恶性进行预测。为了较全面认识钙化在甲状腺良、恶性病变中的价值,笔者在总结国内、外文献的基础上,结合个人经验,对甲状腺病变中钙化的病理和超声、CT及两者联合应用方面的价值进行探讨。
1 钙化的病理学基础
根据组织学特征,甲状腺病变中的钙化分为砂粒体、间质钙化和骨化[3]。砂粒体是最受关注的钙化类型,存在于近50%的乳头状癌中,而少见于其他型甲状腺癌,甲状腺良性病变中更是极为罕见。砂粒体是一种直径为50~70 μm的同心圆分层状的结构,状如散砂,切面呈洋葱样,多与肿瘤细胞伴行,常见于乳头纤维轴心、纤维性间质和实性肿瘤细胞巢之间。乳头状癌中砂粒体的形成机制主要包括3方面:①肿瘤纤维血管轴心血栓形成并继发性梗死,或淋巴管中转移性肿瘤细胞巢坏死引起钙质沉积于死亡细胞,最终导致砂粒体的形成;②由完好的肿瘤细胞释放到局部的代谢产物而继发产生的营养不良性钙化,砂粒体的形成与坏死的细胞并无必然联系;③肿瘤细胞代谢的变化可能与骨形态发生蛋白-1(BMP-1)的大量表达和巨噬细胞产生的骨桥蛋白有关[3-6]。
间质钙化形态多样,可表现为规则或不规则的颗粒状、团块状、环状、弧状或线状,其形成机制主要包括以下两点:①致病因素导致滤泡上皮增生和复旧交替发生过程中,因纤维结缔组织增生而影响血供,造成出血、坏死、囊变等继发性改变,血肿吸收、机化后形成钙化,可见于各种形态钙化;②由于血供不足,包膜缺血发生玻璃样变性,继而发生钙化,多见于弧形及环形钙化。骨化是在间质钙化的基础上形成的,两者在影像上无法分辨,其组织学成分与正常骨相似。环形钙化是间质钙化的典型表现,Park等[7]和笔者[8]报道的64枚和67枚环状钙化中,尽管良、恶性病变所占比例显著不同,分别为19∶45和49∶18,但无一例外均由间质钙化(部分发生骨化)构成,表明间质钙化或骨化不代表病变的良、恶性。
2 钙化在超声和CT检查中的表现和意义
尽管不同研究者对甲状腺病变钙化的超声分型不尽相同,但微钙化、粗钙化和环状钙化已成为不可缺少的类型[1,7,9-10],孤立性粗钙化常因周围无软组织肿块的特性也被部分研究者单独分型来研究[1,9]。与超声相比,CT在甲状腺病变中的应用较少,其分型多借鉴于超声的分型方法。
2.1微钙化在甲状腺病变钙化的超声分型中,微钙化的诊断价值最大,其对于恶性病变诊断的敏感度为24.0%~44.0%,特异度为88.0%~97.0%。微钙化的重要病理基础之一为砂粒体,在200倍的高倍镜视野中,至少含有5个砂粒体才能构成一枚超声可见的微钙化[11],而构成一枚CT显示的微钙化需要多少砂粒体,目前尚无定论。有文献报道超声诊断微钙化的阈值包括最大径≤2.0 mm、≤1.0 mm和≤0.5 mm,其中直径≤2.0 mm曾是应用最广泛的阈值,但随着高分辨超声的广泛应用,将≤1.0 mm作为微钙化的阈值更多见[5,10,12]。对比阈值由大到小,虽诊断恶性病变的特异度增高,但敏感度减低。此外,随阈值的变小,实际工作中判断及测量难度也不断增大,如病理上的微小胶原化、纤维化及少量胶质等在超声上均可呈强回声,与微钙化容易混淆[9,11];而较大阈值则能减少类似情况的发生,故选择不同的超声微钙化阈值,各有利弊。以≤2.0 mm为阈值,可以得到较高的敏感度;以≤1.0 mm或≤0.5 mm为阈值,则可以得到较高特异度。超声显示微钙化的敏感度随瘤体直径不同而异,Moon等[10]报道在≤1.0 cm和>1.0 cm的甲状腺癌中,微钙化对其诊断的敏感度分别为36.6%和51.4%,黄等[13]研究显示,在<1.0 cm、1.0~2.0 cm和>2.0 cm 3组乳头状癌中,微钙化的敏感度分别为46.4%、66.7%和73.3%,因此对于甲状腺病变不能忽视病变大小而单独强调微钙化的敏感度。
CT多以≤2.0 mm为微钙化的阈值(图1),与超声一致,其对甲状腺癌诊断的敏感度亦随瘤体大小不同而异,如笔者前期研究[14-15]显示微钙化在对于≤1.0 cm和>1.0 cm乳头状癌诊断的敏感度分别为15.0%和33.0%,而特异度相仿,分别为93%和94%。CT三维重组可从多个层面观察病变,在一定程度上增加了微钙化的显示率,但对于部分微钙化,CT三维重组仍无法将密度稍高的微钙化与平扫呈高密度的甲状腺分辨开,另外,微钙化越小,判断时越易受主观因素影响,其结果越不可靠,故在微钙化的显示方面,CT不及超声。

图1 甲状腺左侧叶微小乳头状癌。CT平扫示甲状腺左侧叶病变,呈低密度,形态不规则,内见微钙化(箭)。
以结节性甲状腺肿为主的良性病变,其钙化常位于病变边缘呈弧形、环形,或位于间隔呈条状,而以乳头状癌为主的恶性病变,钙化易发生于病变内部呈规则或不规则结节状,但如何对病变内部及周围进行分界缺乏共识,主要依靠检查者主观经验,其结论可能相差很大。超声或CT中单一微钙化,在病理学上可能是砂粒体或钙化,也可能是纤维化、微小胶原化和少量浓缩胶质,随着微钙化数量的增加,尤其是簇状微钙化,甲状腺癌的可能性明显增大。由于软组织分辨率不同,相同钙化在超声和CT上可表现为不同的钙化类型,如CT上单一微钙化在超声上可能为多发微钙化或粗钙化,表明微钙化的判断与检查设备有关,不能忽视这些差异而单独强调微钙化的重要性。
甲状腺呈弥漫性微钙化而无软组织肿块的情况少有发生[16],超声和CT上分别表现为弥漫性回声和密度增高而无软组织肿块,以弥漫硬化亚型乳头状癌多见,常因体检或其他检查偶然发现,确诊时常伴有颈部淋巴结转移,故对该类病人原发灶进行影像评估时,需仔细观察淋巴结情况。
2.2粗钙化与微钙化的阈值对应,粗钙化的阈值包括最大径>2.0 mm、>1.0 mm或>0.5 mm的钙化。因粗钙化常引起后方声衰减而影响病变观察,并且良、恶性粗钙化周围均常伴有纤维化而致病变回声不均,因此超声对粗钙化性病变的诊断不及微钙化明确,其结果也不尽相同,有研究者[17-18]认为,粗钙化有助于恶性结节的诊断,Lee等[19]将粗钙化分为环状钙化、弧形钙化、不规则钙化和结节状钙化,结果显示各亚型钙化在良、恶性结节中的分布无统计学差异,而谷等[20]研究显示粗钙化更常见于良性病变。由此可见,超声对粗钙化性病变的价值尚存在一定争议,需多中心、大样本的联合研究才能确定。

图2 甲状腺右侧叶结节性甲状腺肿。A CT平扫示甲状腺右侧叶粗钙化灶,其周围密度与甲状腺一致;B CT增强示钙化周围带状低强化区(箭),与甲状腺分界清晰。
CT对于粗钙化性病变的诊断价值研究尚少,Wu等[21]、刘等[22]曾报道粗钙化有助于恶性病变的诊断,但由于样本量较小,其结果还有待大样本的验证。笔者结合自己参加的一项研究[23]认为,单纯依靠粗钙化的有无很难对病变的性质做出判断;而增强前后钙化周围的情况有助于粗钙化病变性质的判断,如增强后钙化周围出现低强化晕征,或晕征较平扫明显,提示良性病变(图2),而消失或较平扫模糊提示恶性病变(图3),其机制为良性钙化周围纤维化乏血供,增强后与周围明显强化的甲状腺组织相比呈低密度区,而恶性钙化周围虽然也存在较多纤维化,但纤维组织易被肿瘤侵犯,呈分隔状,血供增加,故强化较明显,同CT平扫相比,与甲状腺组织之间的密度差异缩小,低密度区消失。另外,簇集状的钙化分布模式对恶性病变的诊断具有重要价值,目前其机制尚不明确。桥本氏甲状腺炎可引起甲状腺平扫密度及强化程度均减低,增强前后甲状腺组织与病变之间的密度差异均缩小,两者之间的密度差异不能反映钙化周围与甲状腺组织之间的差异,造成诊断价值明显降低。
2.3环状钙化环状钙化常指平行于结节边缘连续或不连续的曲线状结构,曲线长度总和≥结节周长的1/2~2/3。超声检查中,环状钙化壁的厚薄对其性质的判断具有重要作用:对于薄壁环状钙化,声波常可通过薄壁对钙化环内部回声进行显示;而对于厚壁环状钙化,声波常无法穿过厚壁,从而形成后方声衰减,即超声仅能通过钙化前缘提供的信息对其性质进行判断,故而其价值明显受限。

图3 甲状腺右侧叶乳头状癌。A CT平扫示甲状腺右侧叶粗钙化灶,钙化周围见软组织密度影(箭),后者与甲状腺组织分界清晰;B CT增强示钙化周围软组织明显强化,并与周围甲状腺组织分界不清(箭)。
环状钙化的常见超声参数包括钙化是否中断、环内部回声、壁的厚度及钙化周围低回声晕等[7,24-25],其中钙化中断对恶性病变的诊断价值已经得到部分研究者的认可,敏感度和特异度分别为76.3%~84.4%和47.4%~64.7%[7,24],其发生机制为恶性肿瘤组织对钙化环的破坏而引起中断,目前文献中尚无关于钙化中断的定义。若不论钙化环大小,只要出现任何一处不连即判断为中断,那么根据笔者经验,实际工作中绝大部分环形钙化均属于中断范畴,此征象对环状钙化良、恶性判断的价值就明显降低,故笔者[26]提出用长弧形钙化和短弧形钙化来判断环形钙化的良、恶性,前者指最长钙化≥2 mm,或长度≥1/4环,用此标准诊断良性病变的敏感度和特异度分别为77.6%和90%;而环内部回声、壁的厚度及钙化周围低回声晕均存在一定的局限性而受到质疑,如环内部回声及壁的厚度仅适用于薄壁环状钙化,钙化环周围薄层低回声晕易受主观因素影响而得出不同结果。
与超声比较,CT无声衰减限制,能完整显示钙化环的大小、形态及内部结构,并可通过比较钙化与甲状腺组织之间平扫和增强间的密度差异,对其性质进行判断,如增强后环状钙化内部或边缘较平扫清晰及环内强化程度高于甲状腺则提示良性病变(图4)。前者机制为良性结节的环内或周围纤维成分、梗死、胆固醇结晶沉着及玻璃样变性等因素,均可引起环内或周围毛细血管床减少,与甲状腺组织间的血管床差异增大,增强CT上表现为边界较平扫清晰。后者机制为细胞或小滤泡成分增多时,这些成分所占毛细血管床少于正常甲状腺滤泡,增强CT表现为高强化,两者联合对良性病变诊断的敏感度和特异度分别为77.2%~77.6%和65%~83.3%,与超声比较,敏感性相仿,特异性不足;增强后钙化内部或周围较平扫模糊提示恶性病变 (图5),以甲状腺乳头状癌为例,其内纤维及细胞成分多丰富,而梗死、胆固醇结晶沉着及玻璃样变性相对较少见,增强CT表现为环状钙化周围或内部较平扫模糊或一致[8]。甲状腺弥漫性病变,如桥本氏甲状腺炎等,可以引起甲状腺平扫密度及强化程度均减低,增强前后甲状腺组织与病变之间的密度差异均缩小,两者之间的密度差异不能反映钙化环内部真实的组织结构,故此种方法不适用于合并弥漫性病变的病人。
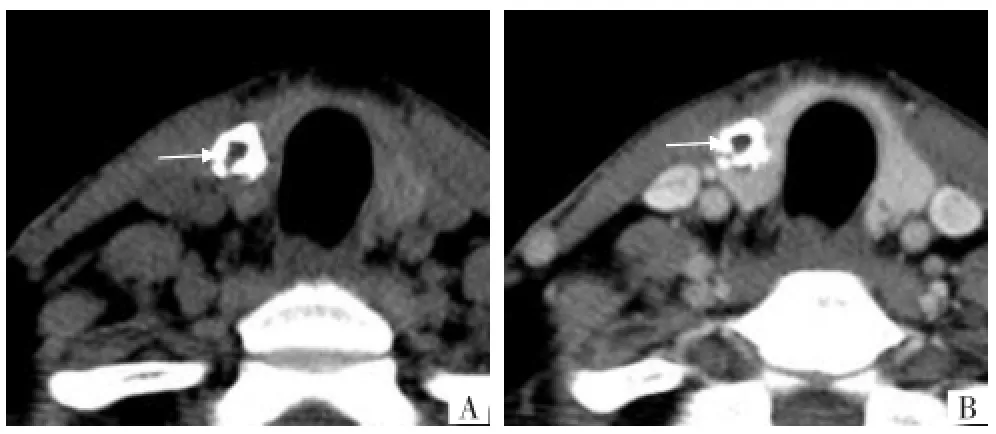
图4 甲状腺右侧叶结节性甲状腺肿。A CT平扫示甲状腺右侧叶环状钙化,环内见软组织密度影(箭),密度低于周围甲状腺组织,两者之间的密度差约20 HU;B CT增强示环状钙化内部强化不明显,而周围甲状腺组织明显强化,两者之间的密度差约100 HU,与平扫对照,环内软组织轮廓显示更清晰(箭)。
超声长弧形钙化联合CT增强后环状钙化内部或边缘较平扫清晰,或环内强化程度高于甲状腺即可对良性病变进行判断,其敏感度和特异度分别为39.3%和100%。由此可见,虽然超声与CT联合时诊断良性病变的敏感度有所降低,但特异度达100%,提示两者联合可对良性钙化确诊,这对减少不必要的手术创伤具有重要意义。
2.4孤立性粗钙化孤立性粗钙化是指周围无软组织肿块的粗钙化。部分较大的孤立性粗钙化在超声上仅表现为其后方伴有显著声衰减的弧形强回声。对其性质进行判断时,仅能以弧形强回声提供的信息为基础,故价值有限,目前尚无这方面的大样本报道。周等[27]借鉴环状钙化的超声表现,以钙化中断作为诊断恶性的超声征象,其敏感度和特异度分别为66.7%和76.7%,尽管其敏感度相对较高,但特异度明显不足,提示不能依靠超声对孤立性粗钙化进行判断。
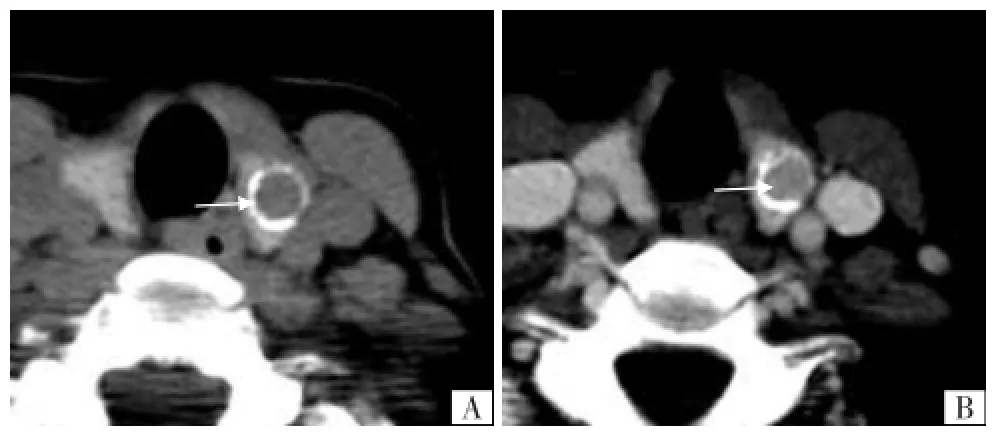
图5 甲状腺左侧叶滤泡细胞癌。A CT平扫示甲状腺左侧叶环状钙化,内部见软组织密度影(箭),平扫密度明显低于周围甲状腺组织,两者之间密度差约为45 HU;B CT增强示环内软组织强化较明显,但低于周围甲状腺组织(箭),两者之间密度差约为25 HU,与平扫对照,环内软组织轮廓显示模糊。
因周围无软组织肿块,增强CT对于孤立性粗钙化没有优势,仅能依靠平扫对其性质进行判断。笔者的既往研究[27-28]显示,钙化周围伪影有助于良性病变的诊断 (图6),其敏感度和特异度分别为70.4%~80.7%和81.7%~87.5%。钙化伪影产生机制是射线硬化效应和部分容积效应[29],前者是X线穿过高密度的孤立性钙化结节后发生衰减,导致对应的投影数据缺失,周围组织信息丧失而产生钙化伪影。典型的硬化伪影表现为“杯状”,中间黑,边缘白;后者是同一层扫描中包含孤立性钙化和甲状腺组织时,所测值是这两种物质的平均密度,而不能反映出单纯孤立性钙化结节或甲状腺密度。不难理解,钙化越密实、连续,其周围伪影越显著,而越间断、松散,其伪影越不明显。笔者在良、恶性孤立性粗钙化组织学对比研究[27-28]中发现,恶性粗钙化多以间断且松散的小斑状、沙粒状、分隔状为主,钙化间可见恶性肿瘤细胞的浸润,而良性粗钙化或骨化多以连续且密实的板状、块状、条状、弧状及结节状为主。由此可见,孤立性粗钙化伪影的产生与组织学具有非常好的对应关系。

图6 甲状腺右侧叶结节性甲状腺肿。CT平扫示甲状腺右侧叶类圆形钙化灶,周围见中间黑(黑箭)、边缘白(白箭)的“杯口状”伪影。甲状腺右侧叶后方另见一枚结节性甲状腺肿钙化结节。
超声钙化中断结合CT平扫钙化无伪影对孤立性恶性粗钙化结节的诊断敏感度和特异度分别为44.4%和95%,超声钙化连续和CT平扫钙化周围伪影联合对良性孤立性粗钙化结节诊断的敏感度和特异度分别为63.3%和92.6%[27],由此可见,超声与CT征象联合同样可以显著提高对良、恶性孤立性粗钙化结节的鉴别能力,值得推广应用。
3 小结
总之,微钙化、增强CT粗钙化周围低密度区消失和环状钙化内部或周围边界较平扫模糊、短弧形钙化、超声检查孤立性粗钙化前缘中断和CT平扫钙化周围无伪影有助于恶性结节的诊断;而长弧形钙化、增强CT粗钙化周围出现低强化晕和环状钙化内部或周围较平扫清晰或强化程度高于甲状腺、超声检查孤立性钙化前缘连续和CT平扫钙化周围出现伪影有助于良性病变的诊断。超声和CT在钙化性病变的诊断中各具优势,两者结合可提高钙化性病变诊断的特异度,可有效减少误诊的发生。
[1]Lu Z,Mu Y,Zhu H,et al.Clinical value of using ultrasound to assess calcification patterns in thyroid nodules[J].World J Surg,2011,35:122-127.
[2] Seiberling KA,Dutra JC,Grant T,et al.Role of intrathyroidal calcifications detected on ultrasound as a marker of malignancy[J]. Laryngoscope,2004,114:1753-1757.
[3] Bai Y,Zhou G,Nakamura M,et a1.Survival impact of psammoma body,stromal calcification,and bone formation in papillary thyroid carcinoma[J].Mod Pathol,2009,22,887-894.
[4]Hunt JL,Barnes EL.Non-Tumor-associated psammoma bodies in the thyroid[J].Am J Clin Pathol,2003,119:90-94.
[5]Cameron RI,Mc Cluggage WG.Extensive psammomatous calciflcation of the uterus and cervix associated with a uterine serous carcinoma[J].J Clin Pathol,2004,57:888-890.
[6] Tunio GM,Hirota S,Nomura S,et al.Possible relation of osteopontin to development of psammoma bodies in human papillary thyroid cancer[J].Arch Pathol Lab Med,1998,122:1087-1090.
[7]Park M,Shin JH,Han BK,et al.Sonography of thyroid nodules with peripheral calcifications[J].J Clin Ultrasound,2009,37:324-328.
[8]韩志江,陈文辉,项晶晶,等.CT环状钙化鉴别甲状腺结节良恶性的价值[J].中华放射学杂志,2014,48:275-278.
[9]Wu G,Zhou Z,Li T,et al.Do hyperechoic thyroid nodules on B-ultrasound represent calcification[J].J Int Med Res,2013,41:848-854.
[10]Moon WJ,Jung SL,Lee JH,et al.Benign and malignant thyroid nodules:US differentiation-multicenter retrospective study[J].Radiology,2008,247:762-770.
[11]Wang Y,Li L,Wang YX,et al.Ultrasound findings of papillary thyroid microcarcinoma:a review of 113 consecutive cases with histopathologic correlation[J].Ultrasound Med Biol,2012,38:1681-1688.
[12]徐上妍,詹维伟,周建桥,等.超声评估甲状腺结节内钙化的初步探讨[J].中国超声医学杂志,2012,28:789-792.
[13]黄雅元,包凌云,韩志江,等.各种超声征象在不同大小甲状腺乳头状癌诊断价值中的比较[J].中国临床医学影像杂志,2015,26:558-561.
[14]瞿佳丽,朱妙平,韩志江.各种CT征象联合应用在甲状腺微小乳头状癌诊断中的价值[J].影像诊断与介入放射学,2015,24:151-155.
[15]朱妙平,周秀艳,韩志江.不同CT征象及其联合应用在甲状腺乳头状癌诊断中的价值[J].中国临床医学影像杂志,2014,25:840-843.
[16]Kwak JY,Kim EK,Son EJ,et al.Papillary thyroid carcinoma manifested solely as microcalcification on sonography[J].AJR,2007,189:227-231.
[17]Frates MC,Benson CB,Charboneau JW.Management of thyroid nodules detected at US:Society of Radiologists in Ultrasound consensus conference statement[J].Ultrasound Q,2006,22:231-238;discussion 239-240.
[18]Taki S,Terahata S,Yamashita R,et al.Thyroid calcifications:sonographic patterns and incidence of cancer[J].Clin Imaging,2004,28:368-371.
[19]Lee J,Lee SY,Cha SH,et al.Fine needle aspiration of thyroid nodules with macrocalcification[J].Thyroid,2013,23:1106-1112.
[20]谷莹,雷志锴,韩志江,等.超声在钙化性甲状腺良、恶性结节鉴别诊断中的价值[J].中国超声医学杂志,2015,31:1051-1053.
[21]Wu CW,Dionigi G,Lee KW,et al.Calcifications in thyroid nodules identified on preoperative computed tomography:patterns and clinical significance[J].Surgery,2012,151:464-470.
[22]刘伟,杨军,张毅,等.钙化征在CT鉴别甲状腺良、恶性病变中的价值[J].中华放射学杂志,2010,44:147-151.
[23]舒艳艳,陈文辉,韩志江,等.甲状腺结节粗钙化的CT诊断和鉴别诊断[J].中国临床医学影像杂志,2013,24:849-853.
[24]Kim BM,Kim MJ,Kim EK,et al.Sonographic differentiation of thyroid nodules with eggshell calcifications[J].J Ultrasound Med,2008,27:1425-1430.
[25]Yoon DY,Lee JW,Chang SK,et al.Peripheral calcification in thyroid nodules:ultrasonographic features and prediction of malignancy[J].J Ultrasound Med,2007,26:1349-1355.
[26]黄雅元,包凌云,韩志江,等.CT和超声的联合应用在良性甲状腺环状钙化诊断中的价值[J].中国临床医学影像杂志,2014,25:385-388.
[27]周金柱,雷志锴,韩志江,等.超声与CT联合在声衰显著甲状腺孤立性钙化结节诊断中的价值[J].中华内分泌外科杂志,2016,10:184-186.
[28]Zhu D,Chen W,Xiang J,et al.The diagnostic value of CT artifacts for solitary coarse calcifications in thyroid nodules[J].Int J Clin Exp Med,2015,8:5800-5805.
[29]Barrett JF,Keat N.Artifacts in CT:recognition and avoidance[J]. Radiographics,2004,24:1679-1691.
(收稿2016-03-15)
Combined ultrasound and CT in diagnosis of thyroid calcified lesions
HAN Zhijiang1,XIANG Jingjing2,BAO Lingyun3,TAO Xiaofeng4.1 Department of Radiology,2 Department of Ultrasound,3 Department of Pathology,Hangzhou First People's Hospital,Hangzhou 310006,China;4 Department of Radiology,Shanghai Ninth People's Hospital,Shanghai Jiao Tong University School of Medicine
In the CT examination of thyroid calcified lesions,the size,shape and distribution of calcificationit are useful to distinguish between benignancy and malignancy,especially for the coarse calcification and thick-walled annular calcification which can not be well detected in ultrasound examination.In the daily work,accurate identification for the benignancy and malignancy of thyroid calcified lesions is essential for early surgical treatment for the malignant thyroid lesions,and reducing unnecessary surgical trauma in the patients with benign lesions.
Thyroid nodule;Calcification;Tomography,X-ray computed;Ultrasonography
陶晓峰,E-mail:cjr.taoxiaofeng@vip.163.com
10.19300/j.2016.J4246
R736.1;R445.3
A
杭州市第一人民医院 1放射科,2病理科,3超声科,杭州 310006;4上海交通大学附属第九医院放射科