牛病细菌分离鉴定及药物敏感性试验
胡东方 程子龙 刘 朋 肖一红 屈亚锦 刘思当(山东农业大学 动物科技学院 山东 泰安 271000)
试验研究
牛病细菌分离鉴定及药物敏感性试验
胡东方 程子龙 刘 朋 肖一红 屈亚锦 刘思当*
(山东农业大学 动物科技学院 山东 泰安 271000)
摘要本文就接诊的牛细菌性呼吸道病例采集的117份奶样进行了实验室分离鉴定和药敏试验,结果表明,牛病常见致病菌的多重耐药现象较为普遍,仅有少数几种药物,如头孢类及喹诺酮类药物能够发挥有效抗菌作用。
关键词牛病 细菌分离 鉴定 药敏试验
近年来,随着经济的发展及居民生活水平的提高,民众对肉、奶的消费水平也越来越高,这在很大程度上促进了养牛业的发展。但是频繁的犊牛贸易、流动以及越来越大的规模化牛场出现使得牛细菌性疾病呈现出一些新的流行特点,细菌性疾病成为影响养牛业发展的主要因素,如何高效防控牛病成为养牛业的一大难题。据调查,当前除牛布氏杆菌病、结核病、副结核病等需要检测净化的疾病外,由巴氏杆菌、链球菌、葡萄球菌、大肠杆菌及沙门氏菌等引起的运输热、乳房炎、腹泻等也成为影响养牛业发展的重要疾病[1,2]。在当前细菌耐药性普遍及食品安全问题频出的背景下,要想准确、高效地对牛常发细菌病进行诊断和防控,必须依赖实验室进行细菌分离鉴定和药物敏感试验。本文就接诊的牛细菌病病例的实验室诊断及药敏试验进行总结,希望能为牛场常见细菌性疾病的病原学研究及药物防治提供理论依据和防控思路。
1 材料与方法
1.1 材料
2014年4月至2015年10月间接诊山东各地70余个牛场的呼吸道病及犊牛腹泻病例,并采集奶样117份。
1.2 方法
对疑似细菌病病例进行实验室综合诊断和药敏试验,并针对性地提出了防控方案。
2 结果
2.1 牛巴氏杆菌病
牛巴氏杆菌病是由多杀性巴氏杆菌引起的一种败血性传染病,临床上以高热、肺炎或急性胃肠炎并发多器官广泛性出血为主要特征[3]。巴氏杆菌为革兰氏阴性菌,用碱性美兰染色血涂片或组织触片后可发现两端深染的短杆菌。一般认为该菌为条件性致病菌,平时即大量寄生在牛的上呼吸道黏膜和消化道黏膜上,当机体受到各种应激因素刺激后而导致抵抗力下降时,该菌便可乘虚而入,经血液循环遍布全身多个组织器官而发生内源性感染和发病[4]。之前一般认为牛运输热的发生与多杀性巴氏杆菌的感染直接相关,但最近研究发现,牛运输热的发生是由多种病原微生物感染引起的以高热、间质性及大叶性肺炎为主的一种应激性综合征,当然,巴氏杆菌在该病的发生中起到重要作用。
2.1.1 临床症状和病理变化 病牛呈精神沉郁、目光呆滞、离群独处、食欲废绝、反刍减少或停止,体温38.9~40.8℃,严重的患牛抽搐后死亡。剖检可见病牛肺脏高度肿胀,呈暗红色实变、质度较硬(图1),肺切面小叶间隔水肿、增宽;气管环充血、气管内有泡沫样液体(图2);肝脏暗红色淤血肿胀、质脆;肠黏膜、肠浆膜均见有弥散性出血斑点,肠黏膜脱落;胃黏膜有弥漫性出血。
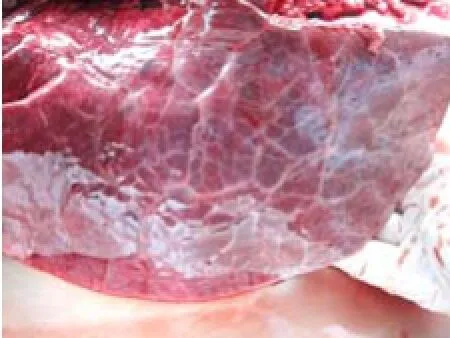
图1 病牛肺脏暗红色实变、肺小叶间隔增宽

图2 病牛气管环充血、管腔内有大量泡沫性液体
2.1.2 实验室诊断(1)细菌分离与纯培养:无菌条件下从病牛肺脏、喉头中分离病料划线接种于绵羊血琼脂平板,倒置放在37℃培养箱中24h后,可见在血平板上形成灰白色湿润而黏稠菌落,无溶血现象。在45°折光下,呈现鲜明的蓝绿色并带金属光泽,边缘有狭窄的红黄色带。(2)菌落鉴定:挑取单个菌落、涂片,干燥后经瑞氏染色,镜下可见两极着色的短杆菌(图3);经革兰氏染色可见呈革兰氏阴性的短杆菌(图4)。(3)细菌生化试验:分离培养物在进行生化鉴定前需要先检查培养物的纯度。将菌株分别划线接种血平板,37℃培养24h后观察。如划线平板上生长的菌落分布均匀,有可供观察的一定数量的单个菌落,通过不同光角度观察和比较菌落的一致性。如菌落形态特征一致,可作为鉴定用菌株;若菌落特征不一致,则需要继续进行划线培养,直至菌落形态一致或80%以上菌落一致即可。菌落形态特征一致的菌落,先进行涂片和革兰氏染色,镜检特征为革兰氏阴性短杆菌后方可进行生化鉴定。生化鉴定可进行如下项目的测定:葡萄糖、果糖、甘露醇、麦芽糖、乳糖、吲哚、VP等,按照说明进行试验。巴氏杆菌能够发酵葡萄糖、果糖及甘露醇;不发酵麦芽糖、乳糖;吲哚试验阳性;VP试验阴性。(4)巴氏杆菌PCR检测:根据GenBank公布的序列设计特异性引物,上游:ATCCGCT ATTTACCCAGTGG;下游:GCTGTAAACGAACTCGC CAC,扩增片段长度457bp[5]。用接种环挑取单菌落,均匀混于含50μl无菌水的离心管中,置于100℃水浴中煮5~10min,然后迅速置于冰上冷却5min,10000rpm离心2min,上清即为PCR模板。按照常规PCR体系和反应条件(退火温度56℃)进行PCR扩增。(5)药敏试验:药敏试验可用纸片扩散法和梯度稀释法进行,目前常用较为经济、简便的纸片法(K-B法)。挑取已鉴定好的巴氏杆菌单菌落,接种于肉汤培养基中增菌培养(37℃,16~24h)。比浊法计数后,用培养基稀释至3×109个/ml[4]。用灭菌棉拭子蘸取稀释后的菌液均匀涂抹于血平板(或吸取30μl菌液至平板上,用灭菌L棒均匀涂满平板),待菌液吸收后,按照图5所示贴药敏纸片(每两个纸片的中心间距应不低于24mm)。将贴完药敏纸片的平皿置于37℃温箱中倒置培养16~24h后观察结果。根据抑菌圈直径判断细菌对药物的敏感性。
图3 瑞氏染色可见巴氏杆菌为两极深染的短杆菌

图4 革兰氏染色 为阴性短杆菌

图5 直径9cm平板贴药敏片示意图
经分离培养及鉴定,共从28份疑似病料中分离得到16株巴氏杆菌,对这16株分离菌进行了以下药物的药敏试验:强力霉素、四环素、庆大霉素、环丙沙星、卡那霉素、丁胺卡那霉素、氟苯尼考。药敏试验结果如表1所示。

表1 巴氏杆菌药物敏感情况 (%)
2.2 奶牛乳房炎
奶牛乳房炎是由物理、化学或微生物等因素刺激奶牛乳腺而引发的一种炎症反应,其中多种病原微生物如葡萄球菌、链球菌及大肠杆菌等细菌的感染是引起该病的主要原因。该病已经成为危害世界奶牛养殖业的主要疾病之一[6]。据世界奶牛协会统计,该病在多个国家和地区普遍发生,世界范围内的发病率高达50%,中国奶牛隐性乳房炎的阳性率介于46.4%~85.7%之间[7,8]。当前,主要采取抗生素疗法对该病进行防治,由于临床治疗过程中存在盲目使用、大剂量或长时间使用抗生素等诸多问题,致使疗效较差及耐药菌株不断增加,非但提高养殖成本、不利于奶牛产业的发展,还会通过残留在乳中的抗菌药物威胁人类健康[9]。因此,及时准确地掌握奶牛乳房炎相关病原的种类及药物敏感性,将有助于指导临床合理用药及提高该病的防治效果,对乳房炎相关致病菌的耐药性研究也大有裨益。
2.2.1 奶样采集 从山东地区共采集奶样117份,样品为临床型或亚临床型乳房炎(根据SMT检测结果而筛选的)患牛奶样。人工挤奶,采样前对奶牛乳房及挤奶工双手进行消毒,手工挤去前3把奶,而后将奶挤至灭菌的10ml离心管中,标记后冰浴中运送至实验室待检。送检的奶样短时间保存于4℃冰箱中,并在12h内开展细菌分离工作。
2.2.2 细菌分离与纯培养 将无菌采集的奶样摇匀后,分别取0.1ml接种于绵羊血琼脂平板及伊红美蓝琼脂平板中,用灭菌L棒涂布均匀。将涂布后的平板倒置放于37℃温箱中培养24h后进行菌落形态观察,并对可疑菌落进行涂片、革兰氏染色及镜检。金黄色葡萄球菌在血平板上的菌落形态为黄色或白色大菌落,周围有完全透明溶血圈(图6);挑取疑似菌落革兰氏染色后,镜检可见革兰氏阳性、排列成葡萄串样或短链簇状的球菌;将疑似金黄色葡萄球菌菌落接种于营养肉汤中,置于37℃摇床中进行纯培养。链球菌在血平板上的菌落形态为有溶血环或无溶血环的圆形突起的细小菌落;挑取疑似链球菌菌落革兰氏染色后,镜检可见革兰氏阳性、排列成长链状的球菌;将疑似链球菌菌落接种于营养肉汤中,置于37℃摇床中进行纯培养。大肠杆菌在伊红美蓝琼脂平板中的菌落形态为紫黑色并带有绿色金属光泽的菌落;挑取疑似菌落革兰氏染色后,镜检可见革兰氏阴性的棒状杆菌;将疑似大肠杆菌菌落接种于营养肉汤中,置于37℃摇床中进行纯培养。

图6 葡萄球菌在血平板上形成黄色或白色大菌落,周围有透明溶血环
2.2.3 细菌生化鉴定(1)疑似葡萄球菌用触酶试验、血浆凝固酶试验及甘露醇发酵试验等葡萄球菌属细菌生化鉴定管进行鉴定。疑似链球菌的用CAMP试验、6.5%NaCl肉汤生长试验、七叶苷及马尿酸钠发酵试验等进行鉴定。疑似大肠杆菌的用乳糖发酵试验、三糖铁、吲哚、甲基红及VP试验进行鉴定。(2)从117份奶样中共分离到致病菌107株,其中金黄色葡萄球菌70株,占分离菌株的65.4%;无乳链球菌27株,占分离株的25.2%;大肠杆菌10株,占分离株的9.3%。在采集的117份奶样中,未分离出细菌的奶样有11份,可能为非特异性乳房炎或是由其他病原微生物引起。106份有菌奶样中,多数样本(79/106)只分离到一种优势菌,其余27份奶样(25.5%)中分离得到两种或两种以上细菌。乳房炎奶样分离到的细菌感染情况见表2。

表2 乳房炎样本的细菌感染情况
2.2.4 药敏试验 经分离培养及鉴定,将分离到的107株致病菌进行了以下药物的药敏试验:青霉素、阿莫西林、头孢噻呋、氧氟沙星、红霉素、庆大霉素、环丙沙星、氟苯尼考。药敏试验结果如表3所示。
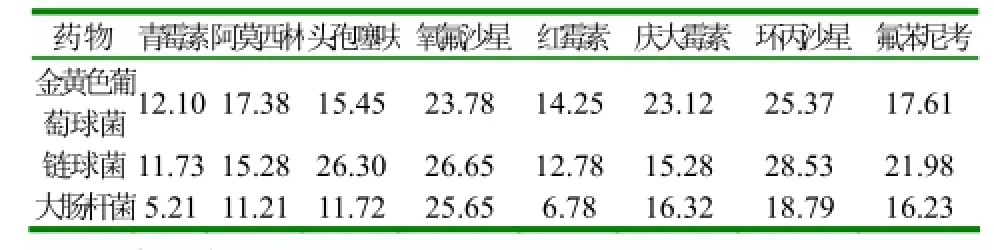
表3 药物对三种病原菌的平均抑菌圈直径(mm)
2.3 犊牛腹泻
犊牛腹泻是指断奶前的犊牛所发生的一种以消化不良及腹泻为主要特征的消化道疾病。该病是由肠道内的细菌、病毒或寄生虫等病原微生物或是营养性因素、环境因素致使机体抵抗力下降及发病后所表现出来的一种多因素综合征,是造成犊牛死亡、生长发育不良且危害犊牛养殖最为严重的疾病之一,给牛场造成巨大的经济损失,严重阻碍了养牛业的发展[10]。引起犊牛腹泻的细菌主要有大肠杆菌、沙门氏菌、巴氏杆菌及魏氏梭菌等,单一细菌的感染往往不会引起严重的腹泻,往往是伴随着饲养管理因素或应激因素一起导致犊牛抵抗力下降、肠道菌群失调,加之细菌感染而诱发严重的腹泻[11,12]。因此,如何预防和治疗犊牛腹泻就成了急需解决的难题。目前,对犊牛腹泻病的治疗主要采用抗生素治疗并结合支持疗法,由于致病因素众多,针对性不强,临床治疗效果往往不够理想,加之长期而广泛地使用抗生素,细菌耐药性和药物残留引起的社会问题也日益凸显。为明确犊牛腹泻病例中细菌性致病因素所占的比重及致病细菌的耐药情况,特对接诊的犊牛腹泻病例进行了细菌的分离鉴定及药敏试验。
2.3.1 样品采集 应用灭菌棉拭子采取病牛肛门处新鲜粪便或肛门拭子共计50份,标记后冰浴中运送至实验室待检。送检的样品短时间保存于4℃冰箱中,并在12h内开展细菌分离工作。
2.3.2 细菌分离及纯培养 将无菌采集的棉拭子样品置于0.5ml灭菌生理盐水中,混匀后,分别取0.1ml接种于普通营养琼脂平板、伊红美蓝琼脂平板及SS平板中,用灭菌L棒涂布均匀。将涂布后的平板倒置放于37℃温箱中培养24h后进行菌落形态观察,并对可疑菌落进行涂片、革兰氏染色及镜检。大肠杆菌在伊红美蓝琼脂平板中的菌落形态为紫黑色并带有绿色金属光泽的菌落;挑取疑似菌落革兰氏染色后,镜检可见革兰氏阴性的棒状杆菌(图7);将疑似大肠杆菌菌落接种于营养肉汤中,置于37℃摇床中进行纯培养。沙门氏菌在SS平板中的菌落形态为中心黑色的圆形菌落;挑取疑似菌落革兰氏染色后,镜检可见革兰氏阴性的小杆菌;将疑似沙门氏菌菌落接种于营养肉汤中,置于37℃摇床中进行纯培养。

图7 大肠杆菌镜下为革兰氏阴性短杆菌
2.3.3 细菌生化鉴定 将分离自选择性培养基上的、经染色镜检为疑似大肠杆菌及沙门氏菌的菌落增菌培养后调整浓度为0.5麦氏比浊单位的菌液。根据E40/12肠杆菌科细菌生化反应鉴定系统说明对疑似大肠杆菌进行生化试验鉴定,先进行葡萄糖发酵试验,糖发酵试验阳性菌株继续进行16种生化反应试验。与大肠杆菌生化特性100%符合的菌株判为大肠杆菌。对疑似沙门氏菌进行鉴定时,先进行葡萄糖发酵试验,阳性菌株继续进行E40/12肠杆菌科细菌生化反应鉴定系统规定的16种生化试验,试验结果与沙门氏菌符合率为100%的确定为沙门氏菌。经过细菌分离、染色及生化鉴定,最终从50份腹泻粪便样品中分离得到39株大肠杆菌和17株沙门氏菌(表4)。

表4 犊牛腹泻粪便样品中细菌分离情况
2.3.4 药敏试验 经分离培养及鉴定,将分离到的56株致病菌进行常用药物的药敏试验,试验结果如表5所示。
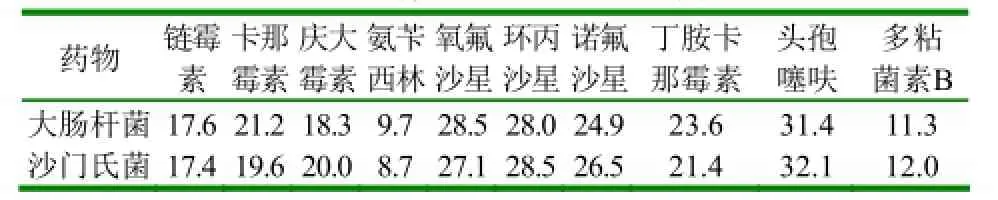
表5 药物对两种病原菌的平均抑菌圈直径 (mm)
由于抗生素在人医及兽医临床的大量应用,细菌耐药性问题较为普遍,特别是葡萄球菌、链球菌、大肠杆菌及沙门氏菌的耐药性急剧增强,尤其严重的是多重耐药菌株的大量出现,会经由食物链传递给人类而危及人类健康。
3 结论
从表1、表3及表5可知,牛病常见致病菌的多重耐药现象较为普遍,仅有少数几种药物如头孢类及喹诺酮类药物能够发挥有效抗菌作用,提示在生产中要选对药、用对药,在维护畜禽健康的同时保障人类健康。
参考文献
[1]胡长敏,程淑芳,彭清洁等.肉牛主要细菌性疾病的诊治及疗效评价[J].养殖与饲料,2013,8:9-11.
[2]石慧,郑明学,王仲兵等.近年来牛主要细菌性传染病及其流行特点[J].动物医学进展,2009,1:116-120.
[3]岳瑞超,程子龙,薛仲行等.对一例疑似肉牛运输热的诊断[J].中国动物检疫,2014,11:60-62+68.
[4]俸忠兰,石凤海,陶永艳等.一起牛巴氏杆菌病的细菌分离及药敏试验[J].上海畜牧兽医通讯,2015,2:59-61.
[5]唐先春.猪多杀性巴氏杆菌的分离鉴定及生物学特性研究[D].武汉:华中农业大学,2004.
[6]邓海平,俞诗源,王玲等.内蒙古地区奶牛乳房炎病原菌的分离鉴定及药敏试验研究[J].安徽农业科学,2009,2:595-596+598.
[7]张中文,吴国娟,刘凤华等.北京地区奶牛乳房炎病原菌的分离鉴定及药敏试验[J].北京农学院学报,2002,4:42-47.
[8]张忠厚.呼市地区奶牛隐性乳房炎主要病原菌的分离鉴定及药敏试验[D].呼和浩特:内蒙古农业大学,2005.
[9]郭海勇,韩国华,崔京春.大连地区奶牛隐性乳房炎主要病原菌的分离鉴定及药敏试验[J].中国畜牧兽医,2011,9:163-166.
[10]荔霞,王胜义,刘永明等.犊牛腹泻病因及其药物防治研究进展[J].中国畜牧兽医,2010,10:161-165.
[11]曹斌斌,赵勐,林涛等.犊牛腹泻病因及治疗方法[J].中国奶牛,2012,5:51-53.
[12]王静,何生虎,葛松等.犊牛腹泻的发病原因及治疗的研究进展[J].农业科学研究,2013,3:59-62
中图分类号:S858.23
文献标识码:A
文章编号:1007-1733(2016)04-0001-04
基金项目:山东省牛产业技术体系资助(SDAIT-12-011-04)
*通讯作者
收稿日期:(2016–01–21)

